はじめに
ヘテロ接合型家族性高コレステロール血症(FH)は,早発の動脈硬化性心疾患(ASCVD)に関連する一般的な遺伝性疾患である。 未治療のFHの子どもは、20歳以降に早発性ASCVDを発症するリスクが高い1。 低比重リポ蛋白コレステロール(LDL-C)値の重度の上昇は胎児期に始まり、動脈壁が持続的にLDL-Cにさらされることで、コレステロールの沈着と血管の炎症が加速され、特に冠動脈と大動脈における動脈硬化の早期開始を素因としています。
スタチンなどの脂質低下療法(LLT)は、LDL-Cを効果的に低下させ、小児や青年期でも安全であり、早期に内皮機能を回復させることができます2。-4 最近、治療が必要な人を発見するために、2歳から8歳前までの小児を対象としたユニバーサルスクリーニングが提案されています5,6。 しかし,この方法は理論的な考察に基づくものであり,現実には証明されていない。
にもかかわらず,18歳未満のFH患者の特徴,これらの患者に用いられるLLT,および現実の脂質目標の達成についてはほとんどわかっていない。 フォローアップデータについてはさらに情報不足である。 全国規模の登録は、FHのケアモデル、治療プロトコル、医療政策の改善に必要な、この重要な情報を提供するために利用することができる7,8。 SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) は、FH集団におけるASCVDおよび死亡率の発症に影響を及ぼす予後因子とメカニズムについて洞察を深めるためにデザインされました。
我々の目的は、SAFEHEARTに登録された18歳未満のFH患者において、患者の特徴を分析し、登録時およびフォローアップ中のLLTおよび脂質の目標を評価し、これらの目標達成の可能性を予測する要因を明らかにすることである
METHODS研究デザインと集団
SAFEHEARTは、スペインにおける分子的に定義したFH集団の公開多施設、全国、長期前向きコホート研究である。 FHの家族からの参加者の募集は2004年に開始され,現在も継続中である。 参加基準は、FHの遺伝子診断を受けたインデックス症例とその15歳以上のFHの遺伝子診断を受けた親族、およびFHの遺伝子診断を受けていない親族(対照群)であった。 それでも、両親の希望があれば、15歳未満の参加者も登録された。 この研究は、地元の倫理委員会によって承認された。 すべての適格者、および/または、少なくとも両親か法的保護者の1人が、書面によるインフォームドコンセントを提供した。 スペイン・マドリッドにあるコーディネートセンターが参加者のフォローアップを管理する責任を負っていた。 患者および/またはその両親には、標準化された電話連絡により、生活習慣や投薬の変化、心血管イベントやその他の医学的問題を記録するために、毎年連絡が取られた。 この登録に参加した医師はトレーニングを受け、この分野の専門医が出席する年次会議でベストプラクティスのガイドラインを強化した。さらに、電子ベースのプログラムと電話によるアドバイスが使用され、必要に応じて管理をさらに支援するためのWebベースのトレーニングプログラムも配備された。 治療法の決定は、各患者の担当医が独占的に行った。
臨床検査値
人口統計学的および臨床的特性は、他の文献に記載されているように記録された。 血清、血漿、DNAは分注し、-80℃で保存した。 血清総コレステロール、トリグリセリド、高密度リポ蛋白コレステロール(HDL-C)値は、中央検査室で酵素法を用いて測定された。 血清LDL-C濃度はFriedewaldの式で算出した。 全血から標準的な方法でDNAを分離し、DNAマイクロアレイを用いてFHを遺伝的に診断した10。LDL-Cの目標は、最近の勧告と目的に従って定義した。 低比重リポ蛋白コレステロール
mg/dLが第一目標であった。11 14歳未満の患者に対する代替目標は、他の心血管危険因子(喫煙、HDL-C mg/dL、リポ蛋白(a)> 50mg/dL、LDL-C > 250mg/dL)または祖先または祖父母が早期心血管疾患を有していない場合にLDL-C mg/dLとした6。 脂質低下療法の分類
スタチン最高用量は、アトルバスタチン40〜80mg/日、ロスバスタチン20〜40mg/日とし、高強度スタチン投与量とした。 最大併用療法は、最大スタチン量とエゼチミブ10mg/日と定義された。 最大LLTは、LDL-Cベースライン値を50%以上低下させることが期待されるLLTと定義された。 シンバスタチン20、40、または80mg/日とエゼチミブ10mg/日の併用、プラバスタチン40mg/日とエゼチミブ10mg/日の併用、フルバスタチン80mg/日とエゼチミブ10mg/日の併用、アトルバスタチン40または80mg/日とエゼチミブ10mg/日の併用または非併用。 アトルバスタチン10または20mg/日とエゼチミブ10mg/日の併用;ロスバスタチン20または40mg/日とエゼチミブ10mg/日の併用;ロスバスタチン10mg/日とエゼチミブ10mg/日の併用;およびピタバスタチン4mg/日とエゼチミブ10mg/日の併用。12,13
遺伝子解析
低密度リポタンパク質コレステロール受容体(LDLR)変異は、LDL受容体タンパク質の機能に対する既知の影響に従って、以前に記述したようにヌル(受容体陰性)変異と欠陥(受容体欠損)変異に分類した14。in vitro機能解析またはコンピュータシミュレーション解析によって示されるタンパク質の完全欠如またはトランケーション(機能喪失)につながる変異は受容体陰性と分類された。 これらの変異には、a) 早期停止コドンを引き起こす点変異、b) LDL-C受容体遺伝子のリガンド結合ドメインの5番目のシステインリッチリピートに影響を与えるミスセンス変異(クラス2A変異)、c) フレームシフトと早期停止コドンを引き起こす小さな削除または挿入、および d) 大きな再配列が含まれる。 受容体欠損変異は、残りのインフレーム点変異と小さなインフレーム欠失および挿入であった。 in vitro試験やコンピューターシミュレーション解析による機能解析が不明な変異はすべて、受容体への影響が陰性か欠陥か確信が持てないため「機能不明」に分類した。しかし、これらの変異のうち1つを持つすべての個体が高コレステロール血症となり、変異を持たない親族はコレステロール値が正常だったことから病原性と考えた14
統計解析
統計解析にはSPSS version 18.0 (SPSS Inc, Chicago, Illinois, United States) を使用した。 変数の分布の正規性は、Kolmogorov-Smirnov検定で分析した。 定量的データは中央値および四分位範囲(IQR)、定性的データは絶対数および百分率で表した。 2つの集団が定義された:エントリー時の集団(n = 241)とフォローアップ時の集団(別称、コホート)であり、フォローアップ時に血漿脂質プロファイルを完全に把握していた患者(n = 217)が含まれた。 登録時と追跡時の比較はすべてコホート研究で行われた。 質的な変数間の頻度の比較は、カイ二乗検定を使用して行った。 二値変数の変化はMcNemar検定で解析した。 量的変数の中央値の比較は、適宜、Mann-Whitneyノンパラメトリック検定またはペアのWilcoxon符号付順位検定で行った。 スタチン使用と関連する変数を決定するために、コホート研究において前方2値ロジスティック回帰分析を行った。 単変量解析で統計的に有意であった変数と、先験的な予測因子や交絡因子である年齢、性別、一次/専門的な環境でのフォローアップを含めた。 また,LDL-C<4957>mg/dLの達成に関連する変数を明らかにするため,エントリ時に目標を達成した患者を除いたコホート研究において,別の前方2値ロジスティック回帰分析を実施した。 単変量解析で統計的に有意であった変数に加え、年齢、性別、変異のタイプ(nullまたはdefect)、エゼチミブの使用、プライマリー/スペシャライズドセッティングでのフォローアップなど、事前の予測因子および交絡因子を含めた。 5397>現在までに4141人がSAFEHEARTレジストリーに登録され,392人が18歳未満である。 このうち241名がFHであることが分子的に確認され,217名が完全な脂質プロファイルでフォローアップされている(90.0%)(図1)。 24人の患者は、フォローアップ時に完全な脂質プロファイルが得られなかったため、解析から除外された。 40人の患者(18.4%)のフォローアップがプライマリーケアで行われた。 追跡期間の中央値は4.69年(IQR,2.48-6.38年)であった。
図2.FH, 家族性高コレステロール血症.
研究の模式的なフローチャート。 FH, familial hypercholesterolemia.
登録時(at entry population)のFH患者129人(53.5%)は男性であった。 年齢中央値は15.0歳(IQR, 14.0-16.0歳)であった。 最年少の患者2名は8歳であった。 ASCVDの既往は1例もなく、家族性ASCVDが40例(16.6%)に認められた。 ベースラインの特徴を表1に示す。 コホート患者とフォローアップされなかった患者との間の組み入れ時のベースライン特性の比較を表1に示す。 2群間に有意差は認められなかった。 ASCVD、高血圧、糖尿病の既往を有する患者はいなかった。 フォローアップなし群の方がプライマリケアで管理されている割合が高かったが、その差は統計学的に有意ではなかった。 このコホートでは、総コレステロール、LDL-C、トリグリセリド、non-HDL-Cの血漿濃度が有意に低下し、フォローアップ時にはHDL-Cの有意な上昇も観察された(表2)。
エントリー集団のベースライン特性
| FH患者におけるフォローアップ Median (IQR)/no. (%) |
FH 患者でフォローアップなし 中央値(IQR)/no. (%) |
P | |||
|---|---|---|---|---|---|
| 人数 | 217 | 24 | |||
| 性別(男) | 117 (53.9%) | 12 (50%) | となった。72 | ||
| 年齢、y | 15.0 (14.0-16.0) | 15.0 (13.0-15.8) | .06 | ||
| 早期の身近なASCVD | 36 (16.6) | 4(16.7%) | 1.0 1.0 | 4 (16.7%)00 | |
| 積極的なたばこ喫煙者 | 13 (6.0%) | 2 (8.3%) | .65 | ||
| 黄色腫 | 1 (0%) | 0 (0%) | .65 | 0.5% (0.5%)99 | |
| Corneal arcus | 6 (2.8%) | 1 (4.2%) | .53 | ||
| BMI, kg/m2 | 21.09 (19.40-22.80) | 20.79 (17.80-22.70) | .53 | .64 | |
| ウエスト周囲径、cm | 72.0 (66.0-78.0) | 72.0 (66.0-75.8) | .94 | ||
| 総コレステロール、mg/dL | 223.5 (194.0-262.3) | .3) | 217.5(194.5-277.5) | .76 | |
| LDL-C, mg/dL | 162.6(133.3.0-195.8) | 153.9(13.1-209.3) | .71 | ||
| HDL-C, mg/dL | 49.0 (42.8-55.0) | 48.5 (41.5-56.0) | .96 | ||
| TG, mg/dL | 62.0 (49.0).0-80.3) | 66.0(42.1-82.3) | .90 | ||
| Non-HDL-C, mg/dL | 174.0(42.0) | 182.3(42.1) | 182.3(42.1) | 167.0 (146.5-225.3) | .74 |
| Lp (a), mg/dL | 18.80 (7.00-48.50) | 13.45 (9.10-28.10) | .74 (7.00-49.30) | .74 (7.00-29.30) | Lp (a), mg/dL46 |
| プライマリーケアで管理されている | 40 (22.9%) | 7 (46.7%) | .06 |
ASCVD, atherosclerotic cardiovascular disease; BMI, body mass index; FH, familial hypercholesterolemia; HDL-C, high-density lipoprotein cholesterol; LDL-C, low-density lipoprotein cholesterol; Lp (a), lipoprotein (a); IQR, interquartile range; TG, triglycerides.Lp (a); TG はリポ蛋白の略。
Plasma Lipid and Lipoprotein Concentrations (Cohort)
| Cohort at entry | Cohort at follow-> | P | |||
|---|---|---|---|---|---|
| 総コレステロール, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 | ||
| LDL-C, mg/dL | 157.7 (132.8-194.5) | 138.0 (116.5-165.0).4) | .001 | ||
| HDL-C, mg/dL | 49.0 (43.0-55.0) | 50.0 (44.0-58.0) | 10.0 (43.0-55.0) | .002 | |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | 70.0 (49.0-80.2) | 62.0 (49.0-80.2)0) | .004 |
| Non-HDL-C, mg/dL | 171.0 (145.8-209.2) | 154.0 (144.8-209.2) | 154.0 (145.8-209.2) | 154.0 (144.8-209.2)0 (132.0-182.5) | .001 |
HDL-C, 高密度リポタンパク質コレステロール; LDL-C, 低密度リポタンパク質コレステロール; TG, トリグリセリド
数値は中央値(四分位範囲)である。
機能的変異
LDL-C受容体遺伝子に変異を有する患者212名(97.7%),アポリポ蛋白B遺伝子に変異を有する患者5名(2.3%)が確認された。 LDL-C受容体遺伝子の変異のうち,95例(43.8%)はnull変異,92例(42.4%)はdefective変異,25例(11.5%)は機能不明変異に分類された。
脂質低下療法と目標達成
表3に,エントリー時とフォローアップ時の異なるLLTレジメン使用状況について示す。 スタチン(開始時44.2%,追跡時68.2%),エゼチミブ(開始時8.7%,追跡時15.2%),スタチン最大量(開始時3.3%,追跡時13.9%),最大LLT(開始時7.9%,追跡時23.6%)の使用率が大幅に増加したことが示された。 最も多く処方されたスタチンは、エントリー時(25.3%)およびフォローアップ時(30.5%)はアトルバスタチンであった。 ロスバスタチンの処方は増加した(組み入れ時の6.0%からフォローアップ時の20.3%)。 スタチン治療期間の中央値は7.0年(5.0〜9.0年)であった。 初潮年齢は,スタチン治療を受けた女子では 12.0 歳(12.0 ~ 13.0 歳),スタチン治療を受けなかった女子では 12.0 歳(11.0 ~ 13.0 歳)だった(P = 0.77). 肝トランスアミナーゼおよびクレアチンホスホキナーゼのいずれにも増加は認められなかった。 フィブラート系薬剤および胆汁酸系薬剤の使用は、組み入れ時の15例(7.0%)とフォローアップ時の3例(1.5%)に限られていた。 スタチンを併用しないエゼチミブ単剤療法は、組み入れ時18例(8.3%)、追跡時24例(11.1%)で使用された。 治療アドヒアランスについては、10名(4.6%)の患者が、フォローアップ期間中に毎月1日以上薬を飲まなかったと回答した。 多変量解析では,スタチン使用と独立して関連する変数はなかった
Lipid-lowering Therapies and LDL-C Goal Achievement (Cohort)
| At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ P | ||||
|---|---|---|---|---|---|---|
| スタチン使用者 | 60(27.6%) | 61(28.1%) | 9(4.1%) | 87(40.1%) | .001 | |
| 最大スタチン量患者 | 186(85.7%) | 24(11.1%) | 1(0.5%) | 6(2.8%) | .001 | |
| ezetimibe投与患者 | 177(81.6%) | 21(9.7%) | 7(3.2%) | 12(5.5%) | .013 | |
| 最大併用療法患者 | 211(97.2%) | 6(2.8%) | 0(0.1%)。0%) | 0(0.0%) | N/A | |
| 最大LLT施行患者 | 163(75.1%) | 37(17.1%) | 3(1.4%) | 14(6.5%) | .N/A001 | |
| ldl-c | 111 (51.2%) | 62 (28.6%) | 16 (7.5%) | 16 (7.4%) | 28(12.9%) | .001 |
| ldl-c | 44(20.3%) | 64(29.5%) | 19(8.8%) | 90(41.5%) | .001 |
LDL-C, low-density lipoprotein cholesterol; LLT, lipid-lowering therapy.
数値はn(%)で表記されています。 – LLTの分類は本文参照。
血漿LDL-C濃度は平均12.5%減少し,追跡時の中央値は138.0mg/dLとなった。 FHに関する最近の国際勧告で定義された低密度リポ蛋白コレステロールの目標値に達したのは,エントリー時20.3%,フォローアップ時41.5%であった(表3,図2)。 14歳未満の患者を対象にLDL-C<4957>mg/dLという代替目標を検討したところ、組み入れ時と追跡調査時にそれぞれ48例中8例(16.7%)、6例中1例(16.7%)が目標に到達していた。 多変量解析でLDL-C目標達成と独立して関連した唯一の変数はスタチン使用であった(オッズ比,13.83;95%信頼区間,2.98-64.15). 医療機関の種類(専門医またはプライマリケア医),年齢,性別,リポ蛋白(a)値,変異の種類はLDL-C目標達成と関連しなかった。
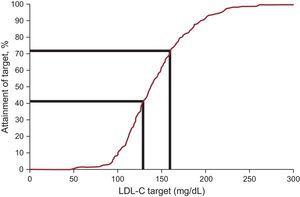
18歳未満の家族性高コレステロール血症患者における治療目標:LDL-C目標値を達成した患者の割合。 LDL-C, low-density lipoprotein cholesterol.
DISCUSSION
今回,SAFEHEARTレジストリーに登録した分子定義FH患者の18歳未満の長期コホートの特徴,LLT使用,LDL-C目標達成状況を報告する。 このユニークなFH患者の登録は、スペインの専門医療とプライマリーケアの両方において、実際の生活から得られたデータに基づいている。 その結果、LDL-C治療目標値<4957>mg/dLに達したのは、登録時20.3%、追跡時41.5%にとどまり、LLTを受けた患者は68.2%であったことが判明した。 スタチン使用は,LDL-C目標達成と独立して関連する唯一の因子であった。 我々の知る限り,18歳未満のFH患者における目標達成を示した研究はなく,本研究が大規模集団における最初の報告である。
最近,英国のレジストリ15が207人のFH小児患者を分析し,64%の小児患者で変異を同定し,48%がLLTを受けており,35%のLDL-C低下が達成されていることが明らかになった。 しかし、著者らは目標達成の結果を報告していない。 16 このような大きな減少は、おそらく併用療法がより頻繁に行われたため(56%)であろう。 目的達成の結果は示されていない。 オランダの207人の患者を対象とした別のレトロスペクティブな論文では、LLTを受けた患者は26%にすぎず、ここでもLDL-C目標達成に関する結果は報告されていない17
この縦断研究では、18歳未満のFH患者のLDL-C値はLLTの変更と医師の教育により経時的に変化する可能性があることが示されている。 スタチン服用患者の割合,スタチン最大投与量,最大LLTは追跡期間中に有意に増加した。 興味深いことに,フォローアップされなかった患者とコホートとの間に統計的に有意な差は認められなかったため,我々のコホートは偏っていないことが示された。
成人期のASCVD発症を防ぐためには,特に子供や青年においてFHの早期診断と管理が不可欠である。 小児におけるFHのスクリーニングは価値があり,高コレステロール血症の小児は早期にASCVDを発症するリスクが高いため,8歳までに実施する必要がある。 さらに、スクリーニングによって最もリスクの高い患者を特定し、動脈硬化の進行を効果的に抑制し、ASCVDリスクを減少させることが示されているLLTの投与を速やかに開始することができるかもしれない。 FHの小児は通常、臨床的なASCVDを発症しない。 しかし、将来的なリスクの存在は、スタチンをFH管理の基礎とするLLTの使用を支持するものである18
小児FHにおけるLLTの安全性と忍容性は、成人のそれと同様であると報告されているものの、常に議論の的となっている5,19,20 最近、Ramaswamiら15は安全性に関する懸念がないと報告したが、それは我々の結果同様であった。 しかしながら、特に高用量のスタチンを投与されている患者については、厳重な管理が望まれる。 また、思春期の女の子には、妊娠を考えているときはスタチン治療を中断するよう助言する必要があります。 しかし、LLTによる長期治療を受けている小児の安全性に関するより多くのデータが必要であるが、最近の長期追跡調査では、優れた安全性プロファイルが示されている。21 この知見は、追跡調査中にLLTを開始した患者の割合が高く、脱落者がほとんどいなかったことから、我々のデータによって間接的に支持されている。 我々の結果は、スタチンを使用する患者の割合が増加し、スタチンの高用量、最大LLTを実施し、投薬を断念する患者の割合が少ないことを明確に示している。 これらのデータは、18歳未満のFH患者において、高用量で使用した場合でも、スタチンの安全性、服薬性、忍容性が確認された22。さらに、今回の結果は、性的成熟に影響を与えないという過去の報告と一致している23。これらの結果はすべて、これらの若いFH患者におけるスタチン開始の理想年齢に関する「The young, the better」という概念を再確認させるものであった23。
今回の結果は、18歳未満のFH患者が多いことを示しており、これまでの研究15,16と同様に、成人のFH患者が近親者をスクリーニングや登録活動に参加させることを望んでいることが示唆された。 この事実は、これらの患者が自分の問題を深刻に受け止めていること、そして医師の助言が患者のライフスタイルの変化に影響を与えうることを反映している。 24
18歳未満のFH患者の最も一般的な目標は130mg/dL未満のLDL-C値であるが、14歳未満で非喫煙者、HDL-C≧40mg/dL、リポ蛋白(a)mg/dL、LDL-C mg/dL、子孫や祖父母が早期心臓血管疾患を持たない患者には、LDL-C mg/dLという別のアプローチが用いられることがある6。 他の最近のガイドラインでは、LDL-Cを治療前の値から50%減少させることを推奨しているが、10歳以上の小児では、特にリポ蛋白(a)の上昇を含む追加の心血管危険因子がある場合、LDL-Cの目標値はmg/dLにすべきである。25 さらに、LDL-C目標達成は、患者が専門医またはプラチナドクターによって治療を受けても同様であることが示された。 このように、プライマリーケアにおいても、小児FH患者に対して専門医による治療と同レベルの治療を行うことは可能である。 この目標を達成するためには、臨床医が登録や専用のトレーニングプログラムを通じて受けるサポートを重視することが重要である。 登録は、プライマリーケアと専門医のケアの統合を可能にすることによって、18歳未満のFH患者の管理を最適化することができ、また、意思決定において保健当局を支援することができる8,26
限界と長所
18歳未満のFH患者のこの大規模追跡調査では、介入は患者の医師によって行われたものと変わらなかった。 登録時にすでに治療を受けていた患者もいたため,この登録では信頼できるベースラインの脂質プロファイルが欠落している。 さらに、異なるライフスタイルなどのいくつかの条件や、異なる心血管危険因子との関連によって結果が変化した可能性がある。
結論
SAFEHEART登録データは、18歳未満のFH患者の高い割合がLDL-C値を持ち、推奨LDL-C目標値を達成できていないことを示している。 追跡期間中にLLT強度が上昇し,LDL-C値が有意に低下することがわかった。 スタチン使用は、LDL-C目標達成の唯一の独立した予測因子であった。 さらに、フォローアップ期間中に安全性に関する懸念は検出されなかった。 これらの結果は、多くのFH患者が十分にコントロールされておらず、まだ治療改善の余地があることを示している。 さらに、このFH患者の追跡調査は、生涯にわたるLLTの安全性および成人期のASCVD発症を予防するための治療開始の至適年齢に関する知見に貢献するものと思われる。
FUNDING
本研究は、Fundación Hipercolesterolemia FamiliarよりG03/181、Instituto de Salud Carlos IIIよりFIS PI12/01289、Centro Nacional de Investigación Cardiovascularより08-2008助成を受けて行われた。
- –
未治療のヘテロ接合型家族性高コレステロール血症の小児は、20歳以降に早期ASCVDのリスクが高まる。
- –
スタチンや他の脂質低下療法はLDL-Cを効果的に下げ、児童や青年に安全である。
- –
18歳未満のFH患者の特徴、これらの患者に使用されている脂質低下療法、実生活で達成された脂質目標値についてはほとんど知られていない。
- –
この情報不足はフォローアップデータでさらに大きくなる。
- –
18歳未満のFH患者の高い割合が、推奨されるLDL-C目標値を達成できない。
- –
我々は、フォローアップ中にLLT強度の上昇とLDL-Cレベルの有意な減少を認めた。
- –
スタチン使用はLDL-C目標達成の唯一の独立した予測因子であり、フォローアップ中に安全性の懸念は検出されなかった。
- –
これらの結果は「若いほど良い」という概念を強化した。
- –