学習目標
- 元素の電子配置を周期表の形と関連づけること。
- 周期表上の位置から元素の予想される電子配置を決定する。
第3章「原子、分子、イオン」で、既知の化学元素を整理するツールとして周期表を紹介しました。 周期表を図8.11「周期表」に示す。 元素は原子番号(原子核に含まれる陽子の数)で表示され、化学的性質の似た元素は列でまとめられています。
図8.11 周期表
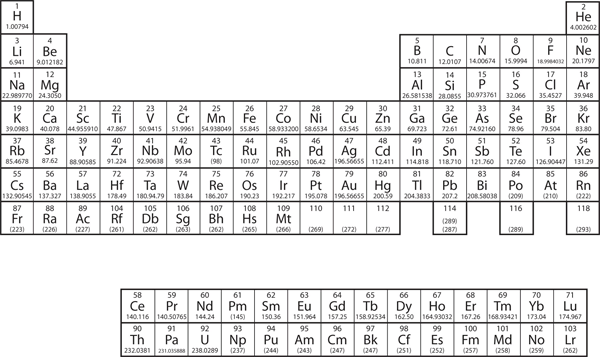
なぜ周期表がそのような構造になっているか? その答えは、電子の配置を理解すれば、むしろ簡単です。周期表の形は、電子が副殻に充満するのを真似ています。 電子配置はそれぞれ 1s1 と 1s2 で、He の場合は n=1 の殻が埋まっています。 この2つの元素は周期表の1行目を構成します(図8.12「1」参照)。
Figure 8.12 The 1s Subshell
H and Heは1s副殻を満たします。
次の2つの電子、LiとBeは2s副殻へ入ることになります。 図8.13「2」は、この2つの元素が周期表で隣接していることを示しています。
Figure 8.13 The 2s Subshell
In Li and Be, the 2s subshell being filled.
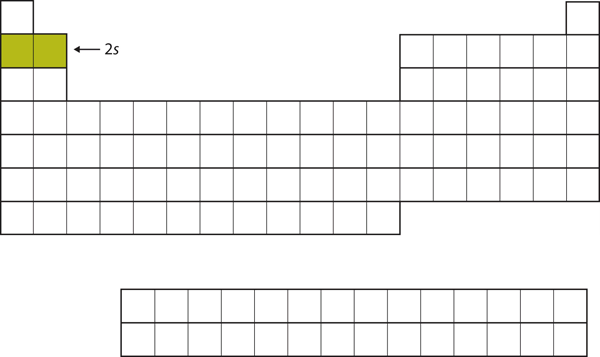
For the next six elements, the 2p subshell being occupied with electrons.
Features in the 2s subhell. 周期表の右側には、この6つの元素(BからNe)をまとめてあります(図8.14「2」)。
図8.14 2p副殻
BからNeは、2p副殻が占有されています。
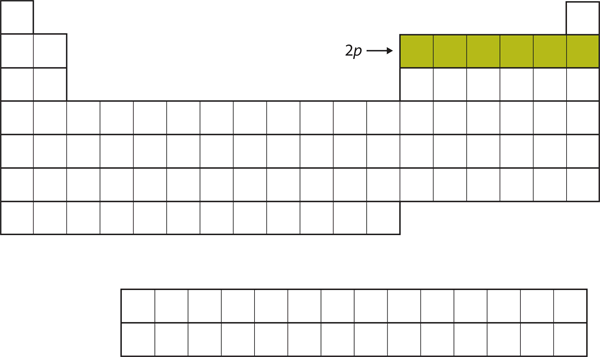
次に満たされるべき副殻は3s副殻です。 この副殻が満たされているときの元素、NaとMgは周期表の左側に戻っています(図8.15「3」)
Figure 8.15 3s副殻
これで3s副殻が占められた。
次に3p副殻が次の6元素で埋められる(図8.16「3」)。
図8.16 3p副殻
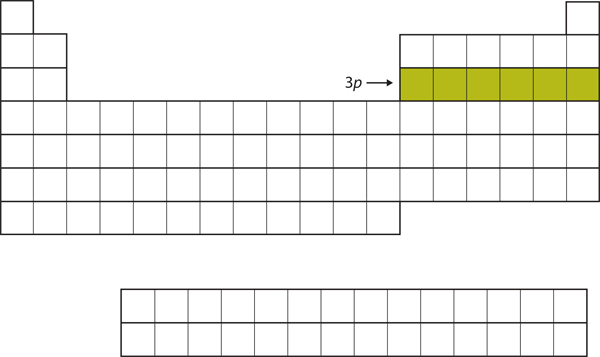
次に、3p副殻は電子で満たされます。
次は3d副殻を満たすのではなく、電子は4s副殻に入ります(図8.17「4」)。
Figure 8.17 The 4s Subshell
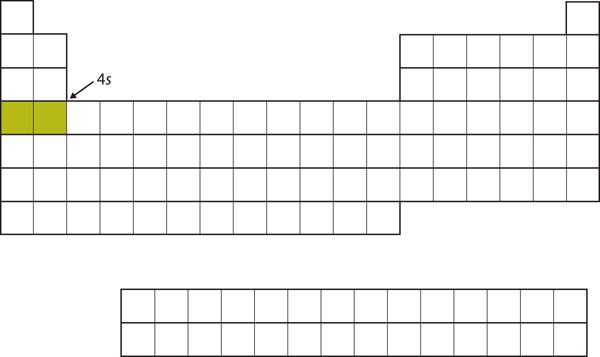
4sサブシェルは3dサブシェルより先に満たされる。 4274>
4s殻が埋まった後、3d殻は最大10個の電子で満たされる。 これは周期表の真ん中の10個の元素のセクション(図8.18「3」)を説明しています。
Figure 8.18 The 3d Subshell
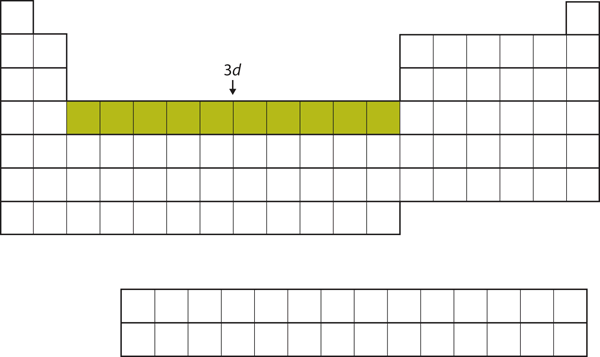
3d subhell is filled in the middle section of the periodic table.
and so forth.のように、このセクションは周期表の3d殻を埋めています。 周期表の行を渡っていくと、表の全体的な形が、電子がどのように殻や副殻を占めているかを概説しています。
周期表の左側の最初の2列は、s副殻が占められているところです。 このため、周期表の最初の2列はsブロックと呼ばれる。 同様に、pブロックは周期表の右端6列、dブロックは周期表の中央10列、fブロックは通常周期表本体から切り離されて描かれる14列の部分である。 本体の一部にすることもできるが、そうすると周期表がかなり長くなり、煩雑になる。 図8.19「周期表のブロック」
Figure 8.19 Blocks on the Periodic Table
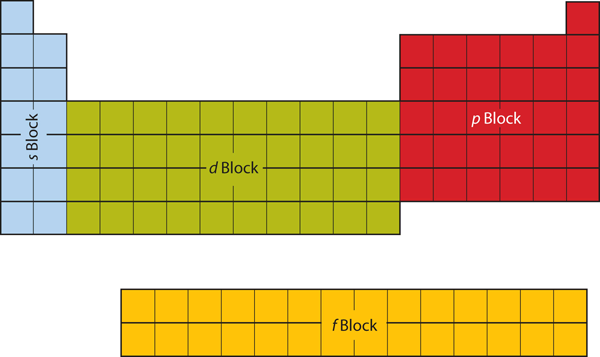
周期表はそのセクションに属する原子がどのサブシェルに入るかでブロックが分かれています。
最も高い番号の殻にある電子と、最後に埋まっていない部分殻にある電子を合わせて価電子と呼び、最も高い番号の殻を価電子殻と呼びます。 (この価電子が原子の化学的性質を大きく支配している。 価電子の電子配置だけを見ると、各列で価電子の電子配置は同じであることがわかる。 例えば、周期表の第1列の元素を例にとると、以下のようになる。 H、Li、Na、K、Rb、Csです。 それらの電子配置(大きな原子は省略)は次のとおりで、価電子帯の電子配置が強調されています:
| H: | 1s1 | |
| Li: | 1s22s1 | |
| Na.K: | 1s22s1、 | |
| Li: | Na.K: | 3s1 |
| K: | 4s1 | |
| Rb: | 5s1 | |
| Cs: | 6s1 |
これらはすべて、価電子帯の電子配置が似ており、s電子が1個である。 元素の化学的性質の多くは価電子の影響を受けるので、これらの元素は似たような化学的性質をもつと予想されますし、実際そうです。 原子の電子の構成は、周期表の形だけでなく、周期表の同じ列の元素が同じような化学的性質を持っているという事実も説明しています。 各列の元素は同じ価電子配置を持ち、元素の化学的性質はある程度似ている。 これは厳密にはsとpのブロックにあるすべての元素に当てはまります。 dブロックとfブロックでは、副殻に電子を充填する順序に例外があるため、これらのブロックでは類似した価電子殻は絶対的なものではありません。
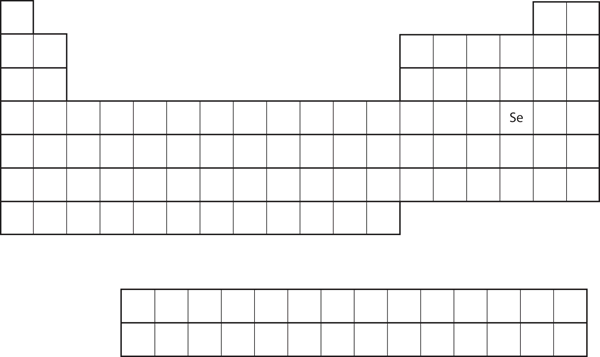
価電子配置の類似性は、周期表上の位置だけで原子の電子配置を決定できることを意味する。 図8.20「周期表上のセレン」に示すように、Seを考えてみましょう。 これはpブロックの4列目にある。 これは、その電子配置がp4の電子配置で終わるはずであることを意味する。 実際、Seの電子配置は予想通り4s23d104p4です。
Figure 8.20 Selenium on the Periodic Table
Example 8
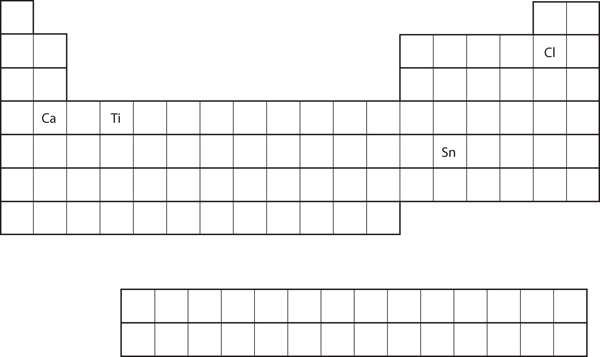
元素の周期表の位置から各原子の価電子配置を予測しましょう。 図8.21「周期表のいろいろな元素」参照)
- Ca
- Sn
答え
- Caはsブロックの2列目に位置しています。 その電子配置はs2で終わるはずだと予想される。 カルシウムの電子配置は4s2です。
- Sn はpブロックの2列目に位置しているので、その電子配置はp2で終わると予想されます。 スズの電子配置は5s24d105p2です。
Test Yourself
周期表上の元素の位置から、各原子の価電子配置を予想しましょう。 4274>
- Ti
- Cl
答え
- 4s23d2
- 3s23p5
図 8.20「周期表の各種元素の位置」を参照してください。21 周期表のさまざまな元素
Food and Drink App: 人工着色料
物体の色は、ネオンなどの放電灯の色とは異なるメカニズムで生まれます。 カラーライトは色を出しますが、モノが色づくのは、モノに当てた白色光から特定の色を優先的に反射させるからです。 トマトをはじめ、多くの食品は彩度が高く、「まず目で食べる」というのは、味と同じくらい視覚的な魅力が重要だということを暗に示しているのです。 しかし、加工食品についてはどうでしょうか。
多くの加工食品には、着色料が添加されています。 着色料には、天然着色料と人工着色料の2種類があります。 天然着色料には、茶色のカラメル糖、オレンジや黄色のアナトー、ターメリック、サフラン、紫色のビート由来のベタニン、そして中南米のサボテンに寄生する小さな虫コチニールから抽出される深紅の染料カルミンがあります。 (その通り、あなたは虫の汁を食べているかもしれません!)
着色料の中には、人工的なものもあります。 米国では現在、食品医薬品局(FDA)が食品、飲料、化粧品の人工着色料として7つの化合物のみを認可しています。
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- FD&Cグリーン#3.Creen
- FD
- FCF&C Blue Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- RD&C Red #3: Erythrosine
- FD&C Red #40: Allura Red AC
- FD&C Yellow #5.Erythrosine
- FD&C。 Tartrazine
- FD&C Yellow #6: Sunset Yellow FCF
下位の番号は、様々な理由により、現在では市場に出ていない、または除去された色である。 一般に、これらの人工着色料は分子が大きく、特定の色の光を非常に強く吸収するため、食品や化粧品に含まれる濃度が非常に低くても有用である。 このような低濃度であっても、人口の一部(特に子供)は人工着色料に敏感であると主張し、その使用を抑制または停止するよう促す評論家もいる。 しかし、人工着色料とその行動への影響に関する正式な研究は、結論が出なかったり、矛盾していたりする。 にもかかわらず、ほとんどの人が人工着色料を使った加工食品(添付の図のようなもの)を楽しみ続けています。

人工食品着色料は、加工食品、キャンディー、卵色素など、いろいろな食品に含まれています。 ペットフードにも、動物が気にしていない可能性が高いですが、人工着色料が入っています!
出典:日本経済新聞社。 Photo courtesy of Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- 原子の電子配置は周期表の形状に関係しています。
- 電子配置は周期表での原子の位置から予測することができます。
演習
-
周期表のどこにs副殻があるか、電子が占有しているか。
-
d殻は周期表のどこを占めていますか?
-
Raはどのブロックにありますか?
-
Brはどのブロックにありますか?
-
周期表第2列の元素の価電子配置はどうなっていますか。
-
周期表の最後から2番目の列の元素の価電子配置は?
-
pブロックの最初の列の元素の価電子配置を答えよ?
-
pブロックの最後の列の元素の価電子配置はどうなっていますか。
-
周期表上の元素の位置から、各原子の電子配置を予想せよ。
a)Sr
b)S
10.原子核の電子配置は? 周期表上の元素の位置から、各原子の電子配置を予測せよ。
a) Fe
b) Ba
11. 周期表上の元素の位置から、各原子の電子配置を予測せよ。
a) V
b) Ar
12. 周期表上の元素の位置から、各原子の電子配置を予測せよ。
a) Cl
b) K
13. 周期表上の元素の位置から、各原子の電子配置を予測せよ。
a) Ge
b) C
14. 周期表上の元素の位置から、各原子の電子配置を予想せよ。
a) Mg
b) I
答え
最初の2列
sブロック
ns27.S
答え
a) Mg
b) I
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.1s22s22p63s23p411.
a) 1s22p63s23p64s23d3
b) 1s22p63s23p613.
a) 1s22sp63s23p64s23d104p2
b) 1s22s22p2