WHAT IS A CONGENITAL CORONARY ARTERY ANOMALY?
何が正常で何が冠動脈異常(CAA)とみなされるべきかについては、現在も議論が続いています。 Angeliniによれば、CAAは除外診断される。つまり、冠動脈の形態が正常でない場合、統計的基準(平均値のプラスマイナス2標準偏差の間隔)に従って正常を定義する。 したがって、CAAは一般人口の1%未満に観察される冠動脈形態となる。1,2 CAAは正常または病的な心形成時に生じることがある。前者の場合、この論文で取り上げる孤立したCAAとなり、後者の場合、他の心奇形と関連して生じる。 最近、診断基準の標準化を試み、CAAを7つのカテゴリーに分類した新しいものが提唱されている4(表1)。


国際的なグループは、少なくともCAAに起因する臨床イベント(突然死と心筋虚血)の大部分を引き起こす異常の登録を呼びかけている。5-7は、対側または「間違った」バルサルバ洞に由来するものである。 このグループには単脈冠動脈(Rigatelliらによる分類では “hyperdominance”)が含まれる。なぜなら、これらの冠動脈は単一の冠動脈口より心筋に血液を供給しなければならず、時には誤ったValsalva洞に由来するCAAと同様のルートを確立しているからである(図1)。

図1. 左前斜投影による冠動脈造影で、単脈右冠動脈を示す。
発生率
異なる定義や分類、血管造影8、9、剖検シリーズ10、近年では心エコーシリーズ11の分析により、CAAの発生率は0.1%~8.4%と報告されており1、8、11、問題の大きさを正確に把握することは困難になっている。 全体として、その発生率は、より正確に定義できるようになった他の疾患、たとえば
肥大型心筋症(0.2%)12 や Wolff-Parkinson-White 症候群(0.1 ~ 0.3%)13 にかなり近いかもしれません。2,3,8,9,14-16 その臨床的重要性を考慮し、これらの異常のレビューに焦点を当てます。
CLINICAL PRESENTATIONS
当初、これらの異常は弁疾患や虚血性心疾患の患者に対して行われた冠状動脈造影で診断され、臨床的意義がないと考えられていました。 その後、冠動脈に由来する異常が唯一の病徴であった若いスポーツ選手の突然死が報告され始めた。8,17
発症時の臨床スペクトルは様々で、無症状の患者がいる一方で、狭心症、呼吸困難、失神、急性心筋梗塞、心不全、突然死などが見られる。 現在、CAAは米国におけるスポーツ選手の突然死の原因の第2位と考えられている21
これは、すべてのCAAが高リスクを示すと考えるべきということでしょうか。 しかし、戦略的な観点からは、異常によって誘発された心筋虚血を除外するための追加検査が行われるまで、それらは「悪性の可能性がある」と考えるべきである。
大きな懸念は、どのCAAが突然死を呈しうるかを決定することにある。 現在では、動脈間(または壁内)の経過をたどるもの、異常冠動脈が優位なもの、30~35歳未満で臨床症状を示すものが、突然死の発生率が最も高いことがわかっている22~26
このため、CAAに対するアプローチは患者の年齢によって異なる必要がある。 35歳以下の若年者では、突然死の予防に「注力」し、35歳以上では心筋虚血の治療が主目的となる(図2)
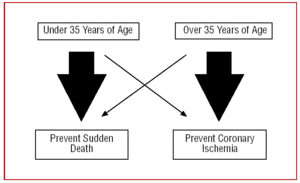
図2. 患者の年齢によるアプローチの違い
時に、その起源と異常なコースのため、CAAは弁置換術の手術中に損傷することがあるが、これは経皮的卵円孔閉鎖術の際にも起こりうることである。 27-30
冠動脈異常における虚血の病理学
CAAの虚血を引き起こすメカニズムを説明する理論はいくつかあるが31、どれも明確に証明されていない。 その1つは、大動脈から出る異常動脈が著しく角張ることが原因と考えられている。 正常冠動脈はその起始部で大動脈に対して垂直であるのに対して、異常冠動脈はその反対側のバルサルバ洞から正常供給領域に到達するために、自ら曲がらなければならないのである。 このため、異常冠状動脈の骨膜は、正常な円形の骨膜に比べて小さく、弁のような隆起があり、激しい運動時に見られるような大動脈の著しい拡張の場合には、圧迫される可能性がある32
別の理論は、CAAの最初のコースに言及している。 大動脈と肺動脈との間である動脈間にある場合、労作時に発生する2つの血管の圧力の上昇は、異常冠動脈の圧迫をもたらす。33 さらに、初期の経路が硬膜内である場合、高血圧時に冠動脈が大動脈壁内で変形することがあるので、閉塞は増大することがある34。
虚血に至るメカニズムとして、異常な経路によって生じる内皮障害の結果として異常な冠動脈にスパズムが生じると考える著者もいれば35、大動脈壁におけるCAAの近位部のインタスセッションが生じると考える著者もいる31)。
最後に、論じたすべてのメカニズムは、急性または慢性の虚血(軽度の虚血事象)を生じ、心筋線維化を誘発し、その結果、致死的不整脈の発生の原因となりうる36
冠動脈異常はどのようにして診断されるのか? 前述したように、ほとんどのCAAは、虚血性心疾患または弁疾患を有する患者が弁置換術の手術前に受ける冠動脈造影検査中に偶然発見される。 24,26,35 明らかに、私たちが最初に行う診断検査は、標準的なエルゴメーターである。 しかし、これは通常陰性であるため、この種の患者にはあまり有用でないことが示されており、この事実は、CAAによる虚血はごくまれにしか現れないことを示しています35,36
したがって、「機能」検査があまり役に立たないことを考えると、冠動脈解剖を調べることができる画像検査を選択しなければなりません。 7,26,37-40 これらの患者の大部分において、大動脈基部の平面における傍胸骨短軸投影の単純CTEの実施により、2つの冠動脈口を区別し、CAAの初期経路を決定することさえ可能である。 Pelliciaらは、1360人のエリートアスリートを対象に心エコー検査を行い、97%の症例で左冠動脈主幹部、80%で右冠動脈主幹部が確認された。41
最近,Frommeltら34は,1997年から2002年にかけて,心筋虚血,先天性心疾患の疑い,筋骨格痛の症状で自分の病院に紹介されたすべての子供と青年(年齢範囲,3か月から20歳)を対象に心エコー検査を実施した。 彼らは全員、血流の方向を決定するためにドップラーカラーフローマッピングの助けを借りて、従来のTTEを受けた。 彼らは、間違った洞に冠動脈が発生する異常な患者を10人(右バルサルバ洞に左冠動脈が発生する6人と左バルサルバ洞に右冠動脈が発生する4人)同定した。 カラー・ドップラーを用いた心電図検査により、9例は大動脈壁内を、残りの1例は心筋内を走行することが確認された。 このように、間違った洞に由来するCAAのコースが硬膜内である場合、正常な洞から出現しているように見えることがある。
心エコー画像診断技術の向上により、特定の患者群におけるCAAの起源を決定し、その初期経過を追跡することができるようになった。 小児、青年、エリートアスリートにおける研究は行われているが、通常の成人集団を含む大規模なシリーズはまだ研究されていない。 したがって、このような症状を持つ若い患者における冠動脈オスティアの同定は、TTE検査において系統的に行われるべきである7,26。
心エコー窓が不十分な患者、あるいは臨床的適応にもかかわらず診断上の疑いが残る場合、CAAの起源と初期経過を可視化できるように、経食道心エコー(TEE)、7、26、42、43コンピュータ断層撮影(CT)26、44-46–電子線またはマルチスライス付き–(図3)や心臓磁気共鳴画像(CMRI)26、47、48が実施可能(図4)である。

図3. 右冠動脈(CD)から発生した冠状動脈(Cx)が後大動脈を経て正常分布域に到達している様子を示す多変量解析CT画像。 Aoは大動脈を、APは肺動脈を示す。 Gabriel C. Fernández博士(Servicio de Radiología, Hospital Povisa, Vigo, Spain)ご提供)
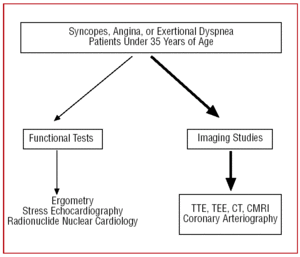
図4. 冠動脈の異常が疑われる35歳以下の患者に対して提案された診断プロトコル。 CMRIは心臓磁気共鳴画像、CTはコンピュータ断層撮影、TEEは経食道心エコー、TTEは経胸壁心エコー
どの技術をどの順番で使うべきか? この質問に対しては、各医療チームが利用可能な手技とその経験に応じて対応する必要がある。 私たちがすべきことは、利用可能な最も侵襲の少ない手技によってCAAとその初期経過を確認することである。 TEEはいくつかのCAAの診断と初期経過の同定に利用されてきたが,その半侵襲的な性質から,他の手技がうまくいかなかった場合にのみ用いるべきものであると考える。 現在では、CTの普及と優れた3次元画像の取得により、Multidetector CT(図5)やCMRIを選択することが賢明と思われる49,50。 この点に関して、2005年4月に発表された第36回ベセスダ会議51では、心血管異常のある競技選手の選考について推奨している。 「労作性失神や症候性心室性不整脈のあるアスリートには、冠動脈の異常を考慮し、心エコー、CMR、超高速コンピュータ断層撮影などの適切な検査で調べる必要がある。 他の検査で診断がつかない場合は、冠動脈造影が適応となります。” 要するに、1つの診断的な検査か他の検査かを選ぶわけではないのです。
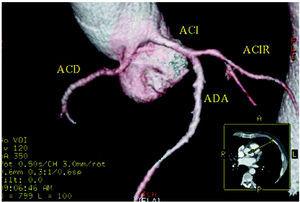
図5. マルチスライスコンピュータ断層撮影(16スライス);左バルサルバ洞に起始する右冠動脈(ACD)を示す3次元レンダリング再構成図。 ACIは左冠動脈、ACIRは回旋冠動脈、ADAは前下行冠動脈。
狭心症の臨床症状を呈する35歳以上の患者では、機能検査(エルゴメーター、運動負荷心エコーなど)の後、動脈硬化の発生率が高いことから冠動脈疾患が疑われるため、通常はカテーテル検査が実施されます。 この技術を導入している施設では、非典型的な臨床像を示す患者に対して、マルチディテクターCTやCRMIによる初期スクリーニングを行うことが可能です。 いずれの場合でも、CAAは所見となる(図6)。
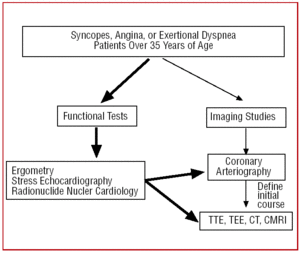
図6. 冠動脈異常が疑われる35歳以上の患者に対して提案された診断プロトコル。 CRMは心臓磁気共鳴画像、CTはコンピュータ断層撮影、TEEは経食道心エコー、TTEは経胸壁心エコーである。
これはCAAの研究において最も複雑な点の1つであり、リスク識別の基本的な側面を構成している。 したがって、右バルサルバ洞から発生した冠動脈が分岐して前下行動脈とCx動脈に供給する場合、それは右冠動脈ではなく、間違った洞に発生した左冠動脈主幹部であると言える。 2
冠動脈が逆バルサルバ洞から発生した後、異常冠動脈は少なくとも5つの異なる経路で正常な供給領域に達することができる2,52:
1. 僧帽弁および三尖弁の後ろの心室内経路
2. 大動脈後方、通常は右バルサルバ洞または右冠動脈を起始部とするCxが続き、大動脈後壁に隣接し、心房と大動脈の間の溝(横静脈洞)に位置する(図3)。
3. 大動脈前または動脈間(大動脈と肺動脈の間)で、異常な右冠状動脈、左前下行動脈、左冠状動脈が中隔または大動脈肺胞を横切る場合。 このコースは虚血や突然死の徴候と最も頻繁に関連している(図7と8)
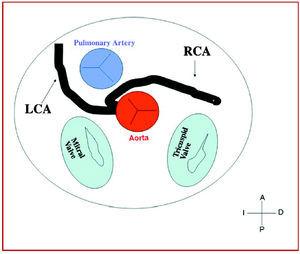
図7. 制御側洞に起始する右冠動脈(RCA)の動脈間経路を示す図。
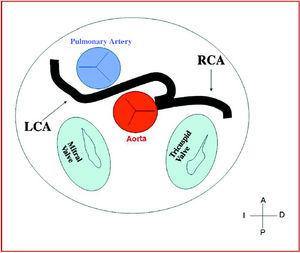
図8. 左冠状動脈(LCA)が制御側洞に起始する動脈間コースを示す図
4. 心室内隔膜の上部を通る心室内側。 大半の症例では心筋内であり、心筋橋に似た収縮期の狭窄と、通常このゾーンに1~2本の中隔穿通枝があることから血管造影で認められる(図9)

図9. 右バルサルバ洞に起始する左冠状動脈(CI)の中隔内を示す図
5. 心前部または肺前部で、右心室流出路または内腔の前壁の心膜下に位置することが特徴である。
他の可能性のあるコース、あるいはある患者において複数のコースが報告されている。2
これらの初期コースを冠動脈造影でどのように特定することができるのか? 当初は、肺動脈にガイドワイヤーを挿入し、側方投影で冠動脈造影を行えば、異常と大血管の関係を特定するのに十分であると考えられていた。 しかし、例えば、側面図では、中隔と動脈間のコースは両方とも肺動脈より後方で大動脈より前方にあるように見えるが、実際には中隔コースは両方の血管の尾方に位置しているので、この手法の価値は限定的である53
異常とその初期コースを認識するための異なる冠状動脈造影の特徴も、可視化する前にさえ報告されている。 この点に関して、Pageら54は、Cxの異常な起源とその初期経過を認識することを可能にする2つの徴候を提案している。 非灌流心筋」徴候。 左冠動脈の選択的開存の際、左心室後外側に無血管域を認め、これがCxの異常な起始を示す。 前下行動脈とCx動脈に独立した動脈管の関与を否定するため、まず左冠状静脈洞に造影剤を注入する必要がある。 しかし、Cxの同定が明確でない場合、左冠状動脈洞に独立したOstiaが存在するよりも、右冠状動脈洞や右冠状動脈に由来するCxを観察することがより一般的であることを忘れてはならない55
2. 「大動脈基部」サイン。 心室造影では、右前斜投影で異常なCxの輪郭を示し、右冠状静脈洞の後ろを通るようにその経過を追う(図10)
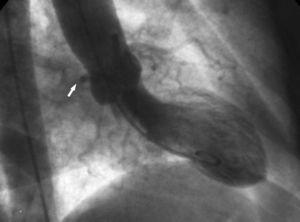
図10. 1985年に石川ら56が、1990年にセロータら57が、異常血管と大動脈および肺動脈の間の初期経過に沿った関係を定義することを目的とした一連の冠動脈造影基準を提案した(図11)。 これらの著者らは、異常冠状動脈と残りの冠状動脈との間に形成される “ループ “の向きに基づいて、あるいは “ドット “の概念(CAAの造影柱が回転することにより、ドットの形態をとることの視覚化57)を適用して、異なるコースを識別しようとしたのである。
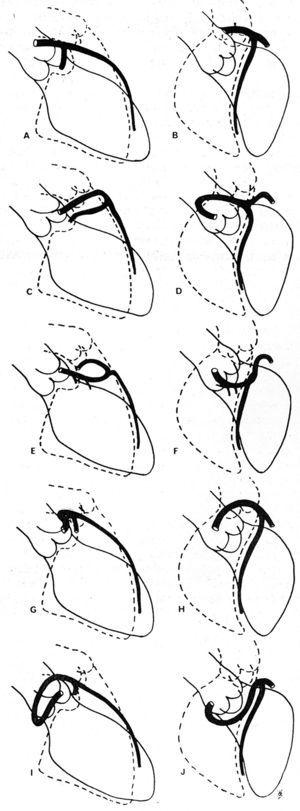
図11. 右前斜投影(A, C, E, G, I)および左前斜投影(B, D, F, H, J)の左冠状動脈前下行および近位回旋冠状動脈の冠状動脈造影c画像のイラストで、右バルサルバ洞に由来する左冠状動脈の異なる可能な初期経路を示す。 AとBは正常な冠動脈、CとDは前胸部の “ループ”、EとFは前尾部の “ループ”、中隔部のコース、GとHは後胸部の “ループ”、動脈間のコース、IとJは後尾部の “ループ”、後胸部コースである。 石川らより引用56
多くの場合、冠動脈造影によるCAAの初期コースの特定は、この手法が複雑な3次元構造である冠動脈樹の2次元ビューを提供するので困難である。 CAAの診断に精通したインターベンショナル・カーディオロジストであれば、冠動脈造影検査で十分な診断が可能であろうが、CAAの診断に精通したインターベンショナル・カーディオロジストであれば、冠動脈造影検査で十分な診断が可能である。 しかし,その発生率の低さから,ほとんどのインターベンショナル・カーディオロジストは,CAAの研究において限られた経験しか持っていない。 したがって,ほとんどの症例において,CAAの経過は正しく説明されていない。 スペインの13の病院を含む最近の登録では、報告されたCAAの最初の経過は、大部分の症例で特定されなかった16
したがって、多くの場合、間違った洞に由来するCAAの最初の経過の特定は、追加の画像技術を必要とする。 前述したように、TTEとTEEはこの目的のために用いることができるが、我々の病院では、手術の候補となりうる患者の冠動脈解剖と隣接構造との関係をより正しく正確に定義する非侵襲的技術がますます利用可能になっていることから、CMRIまたはマルチディテクターCTを選択している35, 37, 47, 49。
最善の治療法は何か?
この点に関して公式なガイドラインが確立されていないため、これはこの疾患の最も議論の多い側面の1つです。
一旦CAAが診断され特徴付けられたら、それが心筋虚血を起こしているかどうかを判断しようとするのは論理的と思われます。 もし、患者が心筋梗塞を起こしたことがあるか(動脈硬化との関連は証明できない)、異常による突然死で蘇生術を受けたことがあり、35歳以下であれば、ほとんどの著者は血行再建を勧めている。
薬物または運動負荷によるタリウム負荷試験または心エコー検査で、異常領域の可逆的虚血を示すことは、意思決定プロセスの助けとなる。 26,35
Corradoらは、若いスポーツ選手と非スポーツ選手の突然死を比較し、CAAまたは不整脈源性右室異形成に起因するものだけが労作と関連していた58。治療に関しては、血行再建術は議論の余地があるが、これらの患者では突然死は予測できず、CAAの最初の兆候かもしれないからこのアプローチを選択する著者もいる24, 26,34,35 これらの症例では、心エコーやタリウム負荷試験による年1回の経過観察を支持し、その結果に基づいて判断する著者もいる7,36。 突然死のリスクは低くなるが、CAAは症候性心筋虚血を誘発するため、場合によっては再灌流を行う(図12)24,26
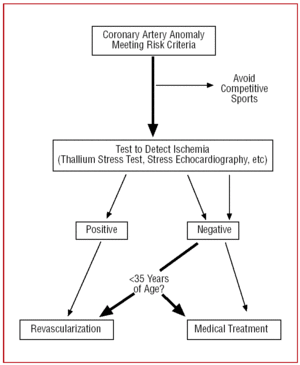
Figure 12.
いくつかのグループは、特定の診断プロトコル(安静時およびドブタミン注入または体液過負荷後の異常な冠動脈オステムを評価するための冠動脈内エコー)の利用59または虚血を検出するための冠動脈内圧線の利用を調査している60。
この問題に関して公式のガイドラインが確立されるまで、最も妥当なアプローチは、第一に、患者の年齢とCAAの解剖学的構造がリスクと関連しているかを確認すること、第二に、(患者によって示されるか示された)冠動脈虚血が明らかに異常によって引き起こされたことを確認することであると思われる。
論理的には、冠動脈の解剖学的構造に基づいて個々の症例に対処する必要があります。したがって、再灌流療法は外科的または経皮的に行うことができます。
経皮的インターベンションは、大血管の圧迫部位と異常な血管の入口部にステントを留置し、成人の数例で行われ、短期間の成功を収めている64。 今日まで、外科的血行再建術は若い患者に好まれ、経皮的方法は成人でのみ行われている。 しかし、小児や青年に「生涯」治療を開始することに反対する著者もいる7
MAJOR UNSOLVED PROBLEMS
各異常に伴う真の突然死リスクは不明である5
手術が拒否された患者では2年および5年のフォローアップに関する報告がある。 その理由は、リスクは剖検調査に基づいて計算されるため、CAAの結果として人が死亡する真のリスクを示すものではなく、突然死を経験した人がCAAである可能性を示唆するものであるからである7。 さらに、計算されたリスクは、報告されているように、座っている人より突然死のリスクが2倍高い競技スポーツ選手のシリーズから得られたものであるため、一般集団に対して過大評価されている可能性がある69。 これらのカットオフポイントは、この問題を扱った数少ない研究に基づいており23,25、したがって、単なる指標と考えるべきであろう。 6589>
上記のような手術療法を採用する場合、2年以上経過を観察した症例がないことを考慮しなければならない。 バイパスの開存性についての不確実性に加えて、アンルーフ手術がもたらす大動脈弁への損傷の可能性がある。 この点で、この手術後に大動脈不全や弁置換の報告さえある。70 心臓手術には常に神経学的合併症のリスクが伴うことを忘れてはならず、若年者におけるその発生率は約2.3%と推定されている71
最後に、心血管系の異常を持つ競技選手の選択のためのガイドラインでは、すべての競技スポーツからCAA患者の除外を推奨する51また、選手集団のデータは、一般集団に外挿されている。 青少年の場合、「競技」という言葉を定義するのは難しいかもしれない。 さらに、思春期や若い成人に体育の授業や本人が楽しんでいるスポーツへの参加を禁止することは、メリットよりもダメージを与える可能性があります。 7
結論
誤ったバルサルバ洞に由来する冠動脈は、心筋虚血、特に突然死と最もよく関連するCAA群を構成する。
狭心症、呼吸困難または労作性失神の臨床症状を示す若い患者では、この異常の疑い指数を高くする必要がある。 これらの症例では、TTEを行い、両冠動脈の狭窄部および初期経路を確認する。
当院の特徴に合わせて、TTE、TEE、できればマルチディテクターCTまたはCMRIなどの画像技術を使用して、異常冠動脈の初期経路を明確に定義する必要がある。
これらの異常の発生率、関連する罹患率や死亡率、予後、治療、遺伝や環境の影響の可能性、要するにこれに関してできる限り多くを知ることができるよう、国内および国際レジストリーの設立を優先しなければなりません。 いずれにせよ,再灌流療法(外科的または経皮的)は,この種の疾患の患者にとって有効であると思われる。