INTRODUZIONE
L’ipercolesterolemia familiare eterozigote (FH) è un comune disordine genetico associato a malattia cardiovascolare aterosclerotica prematura (ASCVD). I bambini con FH non trattata sono ad aumentato rischio di ASCVD prematura dopo 20 anni di età.1 La grave elevazione dei livelli di colesterolo delle lipoproteine a bassa densità (LDL-C) inizia nel feto e porta all’esposizione prolungata della parete arteriosa alle LDL-C, che accelera il deposito di colesterolo e l’infiammazione vascolare e predispone l’inizio precoce dell’aterosclerosi, in particolare nelle arterie coronarie e nell’aorta.
Le statine e altre terapie di riduzione dei lipidi (LLT) abbassano efficacemente l’LDL-C, sono sicure nei bambini e negli adolescenti e ripristinano la funzione endoteliale in giovane età.2-4 Recentemente è stato proposto lo screening universale dei bambini a partire dai 2 anni e prima degli 8 anni di età5,6 per individuare i soggetti che necessitano di trattamento. Tuttavia, questo approccio si basa su considerazioni teoriche e non è stato dimostrato nella vita reale.
Nonostante ciò, si sa poco sulle caratteristiche dei pazienti con IF di età inferiore ai 18 anni, sulla LLT utilizzata in questi pazienti e sugli obiettivi lipidici raggiunti nella vita reale. Il deficit di informazioni è ancora maggiore per i dati di follow-up. I registri nazionali possono essere utilizzati per fornire queste informazioni cruciali, necessarie per migliorare i modelli di cura dell’IF, i protocolli terapeutici e la politica sanitaria.7,8 Lo SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) è stato progettato per migliorare la comprensione dei fattori prognostici e dei meccanismi che influenzano lo sviluppo di ASCVD e la mortalità in una popolazione FH.
Il nostro obiettivo è stato quello di analizzare le caratteristiche dei pazienti e valutare gli obiettivi di LLT e lipidici all’inclusione e durante il follow-up nei pazienti FH di età inferiore ai 18 anni arruolati in SAFEHEART e di determinare i fattori che predicono la probabilità del raggiungimento di questi obiettivi.
METHODSStudy Design and Population
SAFEHEART è uno studio di coorte aperto, multicentrico, nazionale, prospettico a lungo termine in una popolazione FH molecolarmente definita in Spagna. Il reclutamento dei partecipanti delle famiglie FH è iniziato nel 2004 ed è ancora in corso. I criteri di inclusione erano casi indice con una diagnosi genetica di FH e i loro parenti di età superiore ai 15 anni con una diagnosi genetica di FH, così come i loro parenti senza una diagnosi genetica di FH (gruppo di controllo). Tuttavia, sono stati arruolati anche partecipanti di età inferiore ai 15 anni, se richiesto dai loro genitori. Questo studio è stato approvato dai comitati etici locali. Tutti gli individui idonei e/o almeno 1 dei loro genitori o tutori legali hanno fornito il consenso informato scritto. Un centro di coordinamento con sede a Madrid, Spagna, era responsabile della gestione del follow-up dei partecipanti. I pazienti e/o i loro genitori sono stati contattati annualmente con una telefonata standardizzata per registrare i cambiamenti rilevanti nelle abitudini di vita e nei farmaci e qualsiasi evento cardiovascolare o altri problemi medici. I medici partecipanti che arruolavano i pazienti e le famiglie in questo registro hanno ricevuto una formazione, con linee guida sulle migliori pratiche rafforzate in occasione di incontri annuali a cui hanno partecipato medici esperti del settore; inoltre, sono stati utilizzati un programma elettronico e una consulenza telefonica ed è stato implementato un programma di formazione basato sul web per supportare ulteriormente la gestione quando necessario. Le decisioni di trattamento sono state prese esclusivamente dal medico di ciascun paziente.
Misurazioni cliniche e di laboratorio
Le caratteristiche demografiche e cliniche sono state registrate come descritto altrove.9 I campioni di sangue venoso sono stati prelevati dopo 12 ore di digiuno. I campioni di siero, plasma e DNA sono stati aliquotati e conservati a -80°C. I livelli sierici di colesterolo totale, trigliceridi e colesterolo lipoproteico ad alta densità (HDL-C) sono stati misurati in un laboratorio centrale con metodi enzimatici. La concentrazione di LDL-C nel siero è stata calcolata usando la formula di Friedewald. Il DNA è stato isolato dal sangue intero utilizzando metodi standard e la FH è stata diagnosticata geneticamente utilizzando un microarray di DNA.10 Gli obiettivi LDL-C sono stati definiti secondo le recenti raccomandazioni e obiettivi. Il colesterolo delle lipoproteine a bassa densità
mg/dL era l’obiettivo primario.11 Un obiettivo alternativo per i pazienti più giovani di 14 anni consisteva nel LDL-C mg/dL in assenza di altri fattori di rischio cardiovascolare (fumo, HDL-C mg/dL, lipoproteina (a) > 50mg/dL, o LDL-C > 250mg/dL) o malattia cardiovascolare prematura nei progenitori o nei nonni.6 La ASCVD familiare prematura è stata definita come il verificarsi di un primo evento prima dei 55 anni di età negli uomini e prima dei 65 anni nelle donne.Classificazione della terapia ipolipemizzante
La dose massima di statina è stata definita come atorvastatina da 40 a 80mg/d o rosuvastatina da 20 a 40mg/d, considerate dosi di statina ad alta intensità. La massima terapia combinata è stata definita come la massima dose di statina più ezetimibe 10mg/d. La LLT massima è stata definita come qualsiasi LLT destinata a produrre almeno il 50% di riduzione dei livelli basali di LDL-C: simvastatina 20, 40, o 80mg/d più ezetimibe 10mg/d; pravastatina 40mg/d in combinazione con ezetimibe 10mg/d; fluvastatina 80mg/d più ezetimibe 10mg/d; atorvastatina 40 o 80mg/d con o senza ezetimibe 10mg/d; atorvastatina 10 o 20mg/d più ezetimibe 10mg/d; rosuvastatina 20 o 40mg/d con o senza ezetimibe 10mg/d; rosuvastatina 10mg/d più ezetimibe 10mg/d; e pitavastatina 4mg/d in combinazione con ezetimibe 10mg/d.12,13
Analisi genetica
Le mutazioni del recettore del colesterolo delle lipoproteine a bassa densità (LDLR) sono state classificate in base al loro effetto noto sulla funzione della proteina del recettore LDL come mutazioni nulle (recettore-negativo) e difettose (recettore-difettoso) come precedentemente descritto.14 Le varianti che portano alla completa assenza o troncatura della proteina (perdita di funzione) dimostrata da analisi funzionali in vitro o analisi di simulazione al computer sono state classificate come recettore-negativo. Queste varianti includevano le seguenti: a) mutazioni puntiformi che causano un codone di stop prematuro; b) mutazioni missenso che interessano la quinta ripetizione ricca di cisteina nel dominio di legame al ligando del gene del recettore LDL-C (mutazione di classe 2A); c) piccole delezioni o inserzioni che causano un frame shift e un codone di stop prematuro; e d) grandi riarrangiamenti. Le mutazioni difettose del recettore erano le rimanenti mutazioni puntiformi inframe e le piccole delezioni e inserzioni inframe. Tutte le mutazioni senza analisi di funzionalità nota tramite studi in vitro o analisi di simulazione al computer sono state classificate come “funzionalità sconosciuta” perché non potevamo essere certi se l’effetto sul recettore fosse negativo o difettoso; tuttavia, sono state considerate patogene perché tutti gli individui portatori di 1 di queste mutazioni avevano ipercolesterolemia, mentre i parenti senza la mutazione avevano livelli di colesterolo normali.14
Analisi statistica
Le analisi statistiche sono state effettuate utilizzando SPSS versione 18.0 (SPSS Inc, Chicago, Illinois, Stati Uniti). La normalità della distribuzione delle variabili è stata analizzata con il test di Kolmogorov-Smirnov. I dati quantitativi sono espressi come mediana e intervallo interquartile (IQR) e i dati qualitativi come numero assoluto e percentuale. Sono state definite due popolazioni: popolazione all’ingresso (n = 241) e popolazione al follow-up (altrimenti nota come coorte), che comprendeva quei pazienti che avevano un profilo lipidico plasmatico completo al follow-up (n = 217). Tutti i confronti tra l’ingresso e il follow-up sono stati eseguiti nello studio di coorte. I confronti di frequenze tra variabili qualitative sono stati eseguiti utilizzando il test del chi-quadrato. I cambiamenti nelle variabili binarie sono stati analizzati con il test di McNemar. I valori mediani delle variabili quantitative sono stati confrontati con il test non parametrico di Mann-Whitney o con il test di rango firmato di Wilcoxon a seconda dei casi. Un’analisi di regressione logistica binaria in avanti è stata condotta nello studio di coorte per determinare le variabili associate all’uso della statina. Abbiamo incluso le variabili che erano statisticamente significative nelle analisi univariate, così come i predittori e i confonditori a priori: età, sesso e follow-up in un ambiente primario/specializzato. Un’altra analisi di regressione logistica binaria in avanti è stata condotta nello studio di coorte, escludendo i pazienti che hanno raggiunto l’obiettivo all’ingresso, per determinare le variabili associate al raggiungimento di LDL-C
mg/dL. Abbiamo incluso le variabili che erano statisticamente significative nelle analisi univariate, così come i predittori e i confonditori a priori: età, sesso, tipo di mutazione (nullo o difettoso), uso di ezetimibe e follow-up in un ambiente primario/specializzato. Le differenze sono state considerate statisticamente significative a P RISULTATI
Ad oggi, 4141 partecipanti sono stati arruolati nel registro SAFEHEART; 392 hanno meno di 18 anni. Di questi, 241 hanno una conferma molecolare di FH, con 217 seguiti con un profilo lipidico completo (90,0%) (Figura 1). Ventiquattro pazienti sono stati omessi dall’analisi a causa della mancanza di un profilo lipidico completo al follow-up. Il follow-up è avvenuto in un ambiente di assistenza primaria per 40 pazienti (18,4%). Il tempo mediano di follow-up era 4.69 anni (IQR, 2.48-6.38 anni).
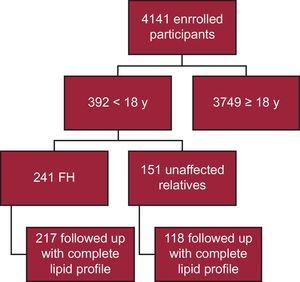
Schema di flusso schematico dello studio. FH, ipercolesterolemia familiare.
Al momento dell’arruolamento (la popolazione di ingresso), 129 pazienti FH (53,5%) erano maschi. L’età mediana era di 15,0 anni (IQR, 14,0-16,0 anni). I 2 pazienti più giovani avevano 8 anni. La storia di ASCVD non era presente in nessun paziente e ASCVD familiare precoce era presente in 40 (16.6%). Le caratteristiche di base sono rappresentate nella Tabella 1. Un confronto delle caratteristiche basali all’inclusione tra i pazienti della coorte e quelli che non sono stati seguiti è mostrato nella Tabella 1. Non sono state trovate differenze significative tra i 2 gruppi. Nessun paziente aveva una storia di ASCVD, pressione alta o diabete mellito. Una percentuale maggiore del gruppo senza follow-up è stata gestita nell’ambito delle cure primarie, anche se la differenza non era statisticamente significativa. Nella coorte, ci sono state riduzioni significative delle concentrazioni plasmatiche di colesterolo totale, LDL-C, trigliceridi e non-HDL-C; un aumento significativo di HDL-C è stato osservato anche al follow-up (Tabella 2).
Caratteristiche di base della popolazione all’ingresso
| Pazienti con IF con follow-up Mediano (IQR)/n. (%) |
Pazienti con IF senza follow-up Media (IQR)/n. (%) |
P | |
|---|---|---|---|
| No. | 217 | 24 | |
| Sesso (maschile) | 117 (53,9%) | 12 (50%) | .72 |
| Età, y | 15.0 (14.0-16.0) | 15.0 (13.0-15.8) | .06 |
| ASCVD familiare prematura | 36 (16.6%) | 4 (16.7%) | 1.00 |
| Fumatore attivo di tabacco | 13 (6,0%) | 2 (8,3%) | .65 |
| Xantomi | 1 (0,5%) | 0 (0,0%) | .99 |
| Arco corneale | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Circonferenza vita, cm | 72.0 (66.0-78.0) | 72.0 (66.0-75.8) | .94 |
| Colesterolo totale, mg/dL | 223.5 (194.0-262.3) | 217.5 (194.5-277.5) | .76 |
| LDL-C, mg/dL | 162.6 (133.0-195.8) | 153.9 (13.1-209.3) | .71 |
| HDL-C, mg/dL | 49.0 (42.8-55.0) | 48.5 (41.5-56.0) | .96 |
| TG, mg/dL | 62.0 (49.0-80.3) | 66.0 (42.1-82.3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145.8-210.9) | 167.0 (146.5-225.3) | .74 |
| Lp (a), mg/dL | 18.80 (7.00-48.50) | 13.45 (9.10-28.10) | .46 |
| Gestito nel setting delle cure primarie | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, malattia cardiovascolare aterosclerotica; BMI, indice di massa corporea; FH, ipercolesterolemia familiare; HDL-C, colesterolo lipoproteico ad alta densità; LDL-C, colesterolo lipoproteico a bassa densità; Lp (a), lipoproteina (a); IQR, intervallo interquartile; TG, trigliceridi.
Concentrazioni di lipidi e lipoproteine nel plasma (Coorte)
| Coorte all’ingresso | Coorte al follow-up | P | |
|---|---|---|---|
| Colesterolo totale, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157.7 (132.8-194.5) | 138.0 (116.5-165.4) | .001 |
| HDL-C, mg/dL | 49.0 (43.0-55.0) | 50.0 (44.0-58.0) | .002 |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 |
| Non-HDL-C, mg/dL | 171.0 (145.8-209.2) | 154.0 (132.0-182.5) | .001 |
HDL-C, colesterolo lipoproteico ad alta densità; LDL-C, colesterolo lipoproteico a bassa densità; TG, trigliceridi.
I valori sono mediani (intervallo interquartile).
Mutazioni funzionali
Abbiamo identificato 212 pazienti con una mutazione nei geni del recettore LDL-C (97,7%) e 5 pazienti con una mutazione nei geni dell’apolipoproteina B (2,3%). Delle mutazioni nei geni del recettore LDL-C, 95 (43,8%) sono state classificate come mutazioni nulle, 92 (42,4%) come mutazioni difettose, e 25 (11,5%) come mutazioni di funzionalità sconosciuta.
Terapia ipolipidica e raggiungimento dell’obiettivo
La tabella 3 mostra l’uso di diversi regimi LLT all’ingresso e al follow-up. I risultati mostrano un aumento significativo nell’uso di statine (44,2% all’ingresso e 68,2% al follow-up), ezetimibe (8,7% all’ingresso e 15,2% al follow-up), dose massima di statina (3,3% all’ingresso e 13,9% al follow-up), e LLT massima (7,9% all’ingresso e 23,6% al follow-up). La statina più ampiamente prescritta all’ingresso (25,3%) e al follow-up (30.5%) era atorvastatina. La prescrizione di rosuvastatina è aumentata (dal 6,0% all’inclusione al 20,3% al follow-up). La durata mediana della terapia con statine era di 7,0 anni (da 5,0 a 9,0 anni). L’età al menarca era di 12,0 anni (da 12,0 a 13,0 anni) per le ragazze in trattamento con statine e 12,0 anni (da 11,0 a 13,0 anni) per le ragazze non in trattamento con statine (P = .77). Non è stato osservato alcun aumento delle transaminasi epatiche o della creatina fosfochinasi. Fibrati e sequestranti degli acidi biliari sono stati utilizzati solo in 15 pazienti all’inclusione (7,0%) e in 3 pazienti al follow-up (1,5%). La monoterapia con ezetimibe senza una statina è stata utilizzata in 18 pazienti all’inclusione (8,3%) e in 24 pazienti al follow-up (11,1%). Per quanto riguarda l’aderenza al trattamento, 10 pazienti (4,6%) hanno riferito di non aver preso i farmaci almeno 1 giorno al mese durante il follow-up. All’analisi multivariabile, nessuna variabile era indipendentemente associata all’uso della statina.
Terapie ipocaloriche e raggiungimento dell’obiettivo LDL-C (Coorte)
| All’ingresso/follow-up- | All’ingresso/follow-up+ | All’ingresso+/follow-up- | All’ingresso+/follow-up+ | P | |
|---|---|---|---|---|---|
| Pazienti su statine | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Pazienti sulla dose massima di statina | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Pazienti su ezetimibe | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Pazienti in terapia combinata massima | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Pazienti su LLT massima | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12.9%) | .001 |
| LDL-C | 44 (20.3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, colesterolo delle lipoproteine a bassa densità; LLT, terapia di riduzione dei lipidi.
I valori sono n (%). – = non presente; + = presente.
Vedi testo per classificazione LLT.
La concentrazione plasmatica di LDL-C è diminuita in media del 12,5%, raggiungendo un valore mediano di 138,0mg/dL al follow-up. Gli obiettivi del colesterolo delle lipoproteine a bassa densità, come definiti dalle recenti raccomandazioni internazionali sull’IF, sono stati raggiunti nel 20,3% all’ingresso e nel 41,5% al follow-up (Tabella 3 e Figura 2). Quando un obiettivo alternativo di LDL-C
mg/dL è stato considerato per i pazienti più giovani di 14 anni, 8 su 48 pazienti (16,7%) e 1 su 6 pazienti (16,7%) hanno raggiunto l’obiettivo all’inclusione e al follow-up, rispettivamente. L’unica variabile indipendentemente associata al raggiungimento dell’obiettivo LDL-C nell’analisi multivariabile era l’uso di statine (odds ratio, 13,83; 95% intervallo di confidenza, 2,98-64,15). Il tipo di fornitore di assistenza sanitaria (specialista o medico di base), l’età, il sesso, il livello di lipoproteina (a) e il tipo di mutazione non erano associati al raggiungimento dell’obiettivo LDL-C.
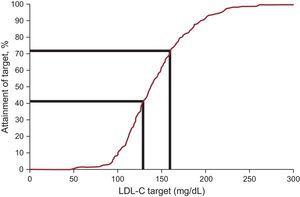
Obiettivi di trattamento nei pazienti con ipercolesterolemia familiare di età inferiore ai 18 anni: percentuale di pazienti che raggiungono l’obiettivo LDL-C. LDL-C, colesterolo delle lipoproteine a bassa densità.
DISCUSSIONE
In questo studio, riportiamo le caratteristiche, l’uso della LLT e il raggiungimento dell’obiettivo LDL-C in una coorte longitudinale di pazienti FH definiti molecolarmente più giovani di 18 anni iscritti nel registro SAFEHEART. Questo registro unico di pazienti con IF si basa su dati ottenuti dalla vita reale in Spagna in contesti di cure primarie e specialistiche. I nostri risultati mostrano che un obiettivo di trattamento delle LDL-C
mg/dL è stato raggiunto solo dal 20,3% dei pazienti all’inclusione e nel 41,5% al follow-up, con il 68,2% dei pazienti in trattamento con LLT. L’uso della statina era l’unico fattore indipendentemente associato al raggiungimento dell’obiettivo LDL-C. A nostra conoscenza, nessun altro lavoro ha mostrato il raggiungimento dell’obiettivo in pazienti con IF di età inferiore ai 18 anni e questo studio è il primo a riportarlo in una popolazione ampia.
Di recente, un registro del Regno Unito15 ha analizzato 207 bambini con IF, identificando mutazioni nel 64% dei bambini e scoprendo che il 48% era in trattamento con LLT; è stata raggiunta una riduzione del 35% della LDL-C. Tuttavia, gli autori non hanno riportato alcun risultato sul raggiungimento dell’obiettivo. Un altro rapporto, che ha analizzato un piccolo campione di soggetti (n = 89), ha mostrato una riduzione del 43% delle LDL-C al follow-up a lungo termine.16 Questa maggiore riduzione è probabilmente dovuta a un uso più frequente della terapia combinata (56%). Non è stato mostrato alcun risultato oggettivo. In un altro articolo retrospettivo su 207 pazienti nei Paesi Bassi, solo il 26% dei pazienti era sottoposto a LLT e, ancora una volta, non sono stati riportati risultati relativi al raggiungimento dell’obiettivo LDL-C.17
Questo studio longitudinale ha dimostrato che i livelli di LDL-C nei pazienti con IF di età inferiore ai 18 anni possono cambiare nel tempo grazie alla modifica della LLT e all’educazione del medico. La percentuale di pazienti che assumono statine, la dose massima di statine e la LLT massima sono aumentate significativamente durante il follow-up. È interessante notare che i nostri dati indicano che la nostra coorte non è distorta perché non ci sono state differenze statisticamente significative tra i pazienti che non sono stati seguiti e la coorte.
La diagnosi precoce e la gestione di FH è essenziale, soprattutto nei bambini e negli adolescenti, per prevenire lo sviluppo di ASCVD in età adulta. Lo screening per FH nei bambini è utile e deve essere effettuato prima degli 8 anni perché i bambini con ipercolesterolemia sono a maggior rischio di ASCVD prematura. Inoltre, lo screening può identificare i soggetti a più alto rischio e sollecitare l’inizio della LLT, che ha dimostrato di invertire efficacemente il processo aterosclerotico e ridurre il rischio di ASCVD. I bambini con IF non hanno di solito una ASCVD clinica. Tuttavia, l’esistenza di un rischio futuro supporta l’uso della LLT, con le statine come pietra angolare della gestione della FH.18
La sicurezza e la tollerabilità della LLT nella FH pediatrica sono sempre controverse, anche se sono riportate come simili a quelle degli adulti.5,19,20 Recentemente, Ramaswami et al.15 non hanno riportato problemi di sicurezza, simili ai nostri risultati. Tuttavia, si raccomanda una stretta supervisione, specialmente in quei pazienti che ricevono dosi più elevate di statine. Le ragazze adolescenti dovrebbero anche essere consigliate di sospendere la terapia con le statine quando contemplano una gravidanza. Tuttavia, sebbene siano necessari maggiori dati sui problemi di sicurezza per i bambini in trattamento a lungo termine con LLT, un recente lavoro di follow-up a lungo termine ha dimostrato un eccellente profilo di sicurezza.21 Questo risultato è indirettamente supportato dai nostri dati, perché un’alta percentuale di pazienti ha iniziato la LLT durante il follow-up e ci sono stati pochi abbandoni. I nostri risultati mostrano chiaramente un aumento della percentuale di pazienti che utilizzano le statine, una dose elevata di statine e la massima LLT, con una bassa percentuale di pazienti che abbandonano il farmaco. Questi dati confermano la sicurezza, l’aderenza e la tollerabilità delle statine, anche quando utilizzate a un dosaggio elevato, nei pazienti con IF di età inferiore ai 18 anni.22 Inoltre, i nostri risultati concordano con i rapporti precedenti che non mostrano effetti sulla maturazione sessuale.23 Tutti questi risultati riaffermano il concetto “più giovane è, meglio è” riguardo all’età ideale per iniziare le statine in questi giovani pazienti con IF.23
I nostri risultati mostrano un alto numero di pazienti con IF di età inferiore ai 18 anni e, in accordo con studi precedenti,15,16 suggeriscono la volontà dei pazienti adulti con IF di includere i loro familiari più prossimi nelle attività di screening e di registro. Questo fatto riflette la serietà con cui questi pazienti prendono il loro problema e l’impatto che i consigli dei loro medici possono avere sul cambiamento del loro stile di vita. Un tale atteggiamento nei pazienti adulti costituisce la base di uno stile di vita sano nei loro parenti.24
Anche se l’obiettivo più comune per i pazienti con IF di età inferiore ai 18 anni è un livello di LDL-C inferiore a 130mg/dL, un approccio alternativo consistente in LDL-C mg/dL può essere utilizzato in quei pazienti di età inferiore ai 14 anni, non fumatori, con HDL-C ≥ 40mg/dL, lipoproteina (a) mg/dL, LDL-C mg/dL, e senza malattie cardiovascolari premature nei progenitori o nei nonni.6 Altre linee guida recenti raccomandano una riduzione del 50% delle LDL-C rispetto ai livelli di pretrattamento ma, per i bambini di età ≥ 10 anni, soprattutto se sono presenti ulteriori fattori di rischio cardiovascolare, compresa la lipoproteina (a) elevata, l’obiettivo LDL-C dovrebbe essere mg/dL.11 I nostri risultati mostrano anche la difficoltà di questi pazienti a raggiungere gli obiettivi lipidici.25 Inoltre, il raggiungimento dell’obiettivo LDL-C era simile se i pazienti erano trattati da specialisti o da medici di base. Quindi, è possibile raggiungere un livello di cura per i pazienti pediatrici con IF in un contesto di cure primarie che è paragonabile a quello raggiunto dalle cure specialistiche. Per questo obiettivo, è importante sottolineare il supporto che i medici ricevono attraverso i registri e i programmi di formazione dedicati. I registri possono ottimizzare la gestione dei pazienti con IF di età inferiore ai 18 anni consentendo l’integrazione delle cure primarie e specialistiche e possono anche supportare le autorità sanitarie nel processo decisionale.8,26
Limitazioni e punti di forza
In questo ampio studio di follow-up su pazienti con IF di età inferiore ai 18 anni, l’intervento è stato invariato rispetto a quello fornito dal medico del paziente. Manca un profilo lipidico di base affidabile in questo registro perché alcuni pazienti erano già in trattamento quando sono stati arruolati. Inoltre, i risultati potrebbero essere stati alterati da diverse condizioni, come diversi stili di vita e un’associazione con diversi fattori di rischio cardiovascolare che avrebbero potuto modificare i risultati.
CONCLUSIONI
I dati del registro SAFEHEART mostrano che un’alta percentuale di pazienti FH di età inferiore ai 18 anni ha alti livelli di LDL-C e non riesce a raggiungere gli obiettivi LDL-C consigliati. Abbiamo trovato un aumento dell’intensità delle LLT e una diminuzione significativa dei livelli di LDL-C durante il follow-up. L’uso della statina era l’unico predittore indipendente del raggiungimento dell’obiettivo LDL-C. Inoltre, non sono stati rilevati problemi di sicurezza durante il follow-up. Questi risultati indicano che molti pazienti con IF non sono adeguatamente controllati e che c’è ancora spazio per migliorare il trattamento. Inoltre, il follow-up di questa popolazione FH può contribuire alle conoscenze sulla sicurezza della LLT per tutta la vita e sull’età ottimale per l’inizio della terapia per prevenire lo sviluppo di ASCVD in età adulta.
FINANZIAMENTO
Questo lavoro è stato supportato dalla sovvenzione G03/181 della Fundación Hipercolesterolemia Familiar, dal FIS PI12/01289 dell’Instituto de Salud Carlos III e dalla sovvenzione 08-2008 del Centro Nacional de Investigación Cardiovascular.
CONFLITTI DI INTERESSE
Nessuno dichiarato.
- –
I bambini con ipercolesterolemia familiare eterozigote non trattata sono a maggior rischio di ASCVD prematura dopo i 20 anni di età.
- –
Le statine e le altre terapie di riduzione dei lipidi abbassano efficacemente la LDL-C e sono sicure nei bambini e negli adolescenti.
- –
Si sa poco sulle caratteristiche dei pazienti con IF più giovani di 18 anni, sulle terapie di riduzione dei lipidi usate in questi pazienti e sugli obiettivi lipidici raggiunti nella vita reale.
- –
Questo deficit di informazioni è ancora maggiore per i dati di follow-up.
Che cosa aggiunge questo studio?
- –
Un’alta percentuale di pazienti con IF di età inferiore ai 18 anni non riesce a raggiungere gli obiettivi raccomandati di LDL-C.
- –
Abbiamo trovato un aumento dell’intensità della LLT e una diminuzione significativa dei livelli di LDL-C durante il follow-up.
- –
L’uso della statina era l’unico predittore indipendente del raggiungimento dell’obiettivo LDL-C e nessun problema di sicurezza è stato rilevato durante il follow-up.
- –
Questi risultati rafforzano il concetto “più giovane è, meglio è”.