Il sistema immunitario
Il sistema immunitario è composto da tessuti, cellule e molecole la cui funzione primaria è quella di rilevare, rispondere ed eliminare gli agenti patogeni e le cellule trasformate.
Risposta immunitaria innata e adattativa
Ci sono due componenti principali del sistema immunitario-1) il sistema immunitario innato e 2) il sistema immunitario adattativo. Il sistema immunitario innato agisce come prima linea di difesa e individua gli agenti patogeni attraverso i recettori di riconoscimento dei modelli codificati dalla linea germinale, non forma memoria e risponde rapidamente (in pochi minuti o ore). Il sistema immunitario adattativo risponde lentamente (per giorni), usa recettori specifici per l’antigene che passano attraverso riarrangiamenti genici multipli durante lo sviluppo, e forma una memoria immunologica – “imparando” dall’insulto iniziale e preparando il corpo a combattere l’esposizione futura a materiale nocivo simile. Entrambi i tipi di risposte immunitarie possono essere guidate da macromolecole nel fluido extracellulare o dall’attivazione di cellule immunitarie specifiche. Queste risposte sono note rispettivamente come immunità umorale e immunità mediata dalle cellule.
Sotto l’ombrello della risposta immunitaria cellulo-mediata, le cellule immunitarie si stratificano principalmente in base al fatto che la risposta sia innata o adattativa. Il sistema immunitario innato consiste principalmente di cellule fagocitanti, come neutrofili, macrofagi, cellule natural killer, basofili e altre che colpiscono gli organismi invasori pericolosi. Le cellule del sistema immunitario adattativo sono le cellule T e le cellule B. Le cellule T natural killer (NK) hanno caratteristiche sia delle cellule immunitarie innate che di quelle adattative. Inoltre, la maggior parte degli altri tipi di cellule, non specifici del sistema immunitario, possono ospitare funzioni immunitarie innate intrinseche sotto forma di recettori citoplasmatici e molecole di segnalazione ed effettrici come i membri delle famiglie RIG-I, STING e NLR. Come esamineremo più avanti, le cellule di entrambi i sistemi nascono da diversi lignaggi mieloidi e linfoidi di cellule staminali ematopoietiche.
Componenti del sistema immunitario
Le cellule immunitarie mature si differenziano dalle cosiddette cellule staminali ematopoietiche. Queste sono cellule progenitrici indifferenziate pluripotenti che si trovano nel midollo osseo, nel sangue periferico e nella placenta. Queste cellule staminali ematopoietiche possono differenziarsi in cellule progenitrici mieloidi comuni o in cellule progenitrici linfoidi comuni.
Cellule linfoidi
Le cellule progenitrici linfoidi comuni possono differenziarsi in quattro popolazioni principali di linfociti che possono essere distinte dall’espressione del recettore della superficie cellulare: Cellule T, cellule B, cellule natural killer (NK) e cellule NK-T.
Le cellule T
Le cellule T svolgono un ruolo critico nell’immunità cellulo-mediata. Queste cellule sono identificate dall’espressione delle catene di segnalazione delle cellule T CD3.
Le cellule T nascono da cellule progenitrici linfoidi che si sviluppano originariamente da cellule staminali ematopoietiche nel midollo osseo. Una volta che il progenitore linfoide si impegna a diventare una cellula T, migra dal midollo osseo al timo (da cui il nome di cellula T). Il timo fornisce il microambiente adeguato dove le cellule T possono svilupparsi nei loro vari sottotipi, definiti dai recettori specifici espressi sulla superficie cellulare. Le cellule T in maturazione nelle fasi iniziali, o timociti, mancano di recettori per entrambi i CD4 e CD8 e sono quindi chiamate cellule a doppia negatività (DN). Le cellule DN subiscono poi riarrangiamenti genetici e mutazioni nei geni che codificano per i recettori alfa e beta delle cellule T (TCR), il che le avvia lungo un percorso di impegno di lignaggio per cui il risultato finale è un recettore delle cellule T con affinità specifica per un antigene unico.
I timociti sono poi selezionati, sia positivamente che negativamente, per assicurare che riconoscano gli antigeni “stranieri” ma non quelli dell’ospite, che sono presentati come peptidi attraverso l’MHC sulla superficie cellulare. Solo le cellule che superano entrambi i test saranno poi attivate per esprimere CD4 e CD8, diventando cellule a doppia positività. Alla fine della maturazione, le cellule T esprimeranno CD4 o CD8 (e perderanno l’espressione dell’altro) e diventeranno così cellule mono-positive. Queste cellule T mature CD4 o CD8-positive sono poi rilasciate nel flusso sanguigno e sono inizialmente allo stato naïve, cioè non si sono ancora impegnate in un particolare sottotipo di cellule T.
Se il timocita in maturazione mostra una quantità intermedia di affinità per i peptidi MHC self durante la maturazione, allora può essere selezionato per diventare una cellula T regolatrice (Treg) per la sua capacità di riconoscere antigeni “self” dannosi. Le cellule T nel sangue o nei tessuti periferici possono anche essere indotte localmente a diventare Tregs. Il compito principale dei Tregs è quello di mantenere la tolleranza agli antigeni del sé, così come limitare la funzione e la proliferazione delle cellule T-effettrici.
Una volta arrivate nel sangue o nel tessuto periferico, le cellule T naïve possono essere indotte a diventare cellule T-helper. Le cellule presentanti l’antigene (APC), come macrofagi, cellule dendritiche e cellule B, mostreranno l’antigene alla cellula T, e se il suo recettore ha affinità la cellula T riconoscerà l’antigene. Tipicamente, le cellule T CD4+ sono adatte a riconoscere gli antigeni peptidici legati alle proteine MHC di classe II. Una volta riconosciuto il complesso peptide-MHC, la cellula T attiverà una serie di vie interne che permettono di verificare il riconoscimento dell’antigene. Solo allora la cellula T-helper prolifererà, espandendo il pool di cellule disponibili che sono specifiche per l’antigene dannoso, come diversi batteri e parassiti.
Una volta che le cellule T-helper hanno riconosciuto il loro antigene e si sono attivate, rilasceranno una varietà di citochine, che sono molecole che segnalano alle altre cellule immunitarie come rispondere adeguatamente alla molecola nociva. Ci sono diversi sottoinsiemi di cellule T helper, tra cui Th1, Th2 e Th17. Questi sottogruppi producono e secernono citochine distinte che aiutano a personalizzare la risposta immunitaria a seconda del tipo di patogeno. Per esempio, le cellule Th1 si affidano alla citochina effettrice IFN-γ per segnalare ai macrofagi di digerire e distruggere il materiale nocivo, mentre le cellule Th2 secernono una combinazione di IL-4, IL-5, IL-9, IL-10 e IL-13 per attivare basofili, eosinofili e altre cellule per attaccare l’infezione. La quantità e le varietà specifiche di citochine determinano la risposta appropriata all’infezione o alla cellula nociva. Le cellule T possono anche rispondere alle cellule del sé diventando cellule T citotossiche (o cellule T natural killer). Tipicamente queste sono cellule CD8+ che riconoscono le cellule infettate da virus o le cellule tumorali. Le cellule T natural killer (NKT) saranno discusse più in dettaglio in una sezione successiva. Questi e altri tipi di cellule T svolgono i loro vari compiti o funzioni effettrici in modi diversi per riconoscere il materiale nocivo e reclutare altre cellule immunitarie per distruggerlo, così come costruire una risposta immunitaria duratura allo stesso tipo di insulto.
Il percorso interattivo di segnalazione dei recettori delle cellule T è rivisto in dettaglio qui.
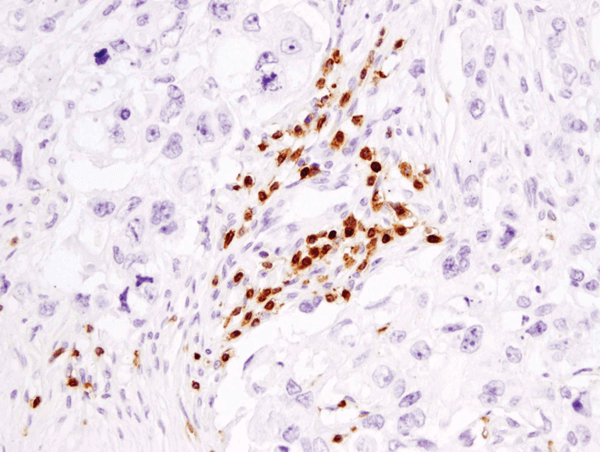
CD3ε (D7A6E™) XP® Rabbit mAb #85061: analisi IHC di carcinoma mammario umano incluso in paraffina utilizzando #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: analisi IHC di carcinoma mammario umano incluso in paraffina usando #85061.
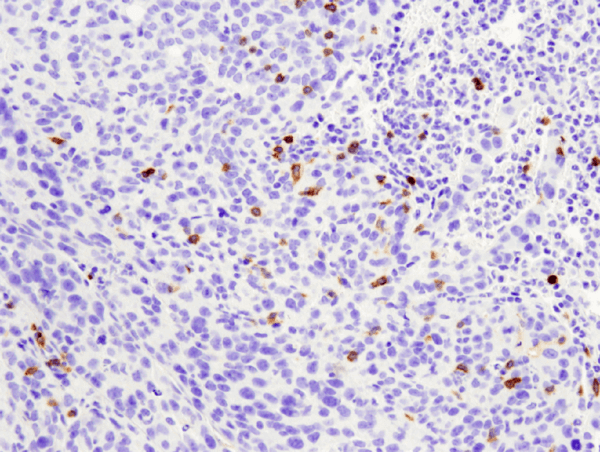
CD4 (D7D2Z) Rabbit mAb #25229: analisi IHC di un tumore metastatico 4T1 incluso in paraffina in un polmone di topo usando #25229.
CD4 (D7D2Z) Rabbit mAb #25229: analisi IHC di un tumore metastatico 4T1 incluso in paraffina in un polmone di topo usando #25229.
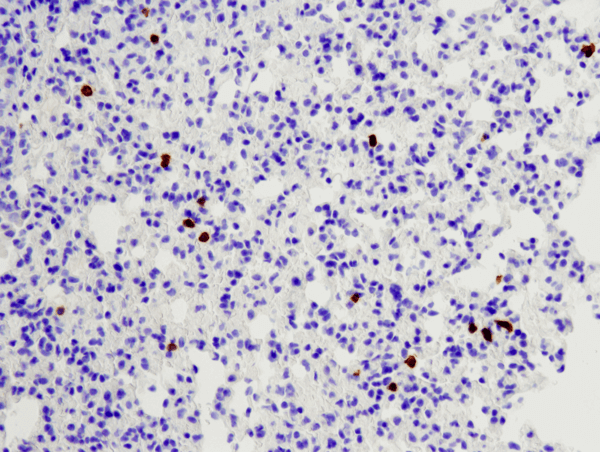
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Analisi IHC di polmone di topo incluso in paraffina usando #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Analisi IHC di un polmone di topo incluso in paraffina usando #98941.
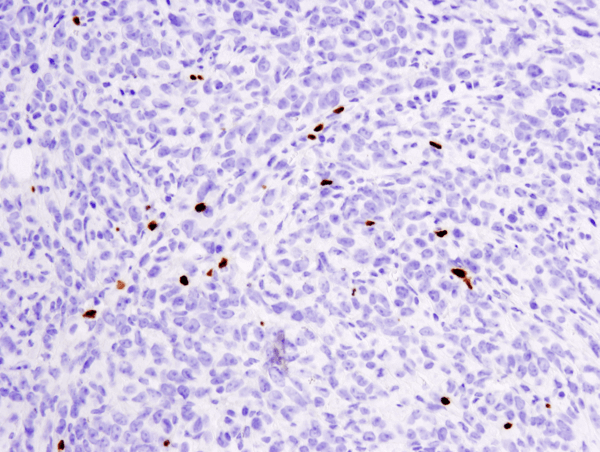
FoxP3 (D6O8R) Rabbit mAb #12653: analisi IHC di un tumore metastatico 4T1 incluso in paraffina in polmone di topo usando #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: analisi IHC di un tumore metastatico 4T1 incluso in paraffina in un polmone di topo usando #12653.
Cellule B
Le cellule B sono le cellule critiche nel sangue che mediano la produzione di anticorpi. Quando del materiale nocivo è presente nel flusso sanguigno, viene riconosciuto come antigene dai recettori specifici delle cellule B. Poi, dopo aver elaborato l’antigene e con l’aiuto delle cellule T, le cellule B maturano in plasmacellule che secernono anticorpi. Le cellule B possono anche svolgere un ruolo nella presentazione di antigeni e nella secrezione di citochine. Verranno discussi sia lo sviluppo che le varie funzioni delle cellule B.
Il 15% dei leucociti trovati nel sangue periferico sono cellule B. Le cellule B producono immunoglobuline (Ig), che sono proteine che legano l’antigene (note anche come anticorpi) composte da due catene pesanti e due catene leggere identiche. Queste immunoglobuline contengono siti specifici di legame dell’antigene che variano nella sequenza di aminoacidi da una molecola di anticorpo all’altra. Questi siti conferiscono la specificità di ogni anticorpo per il riconoscimento di un antigene distinto.
Come già detto, le cellule B si differenziano dalle cellule ematopoietiche che si trovano nel midollo osseo. È all’interno del midollo osseo che i recettori Ig di superficie (anticorpi) sono assemblati attraverso un processo di riarrangiamento genico. Le cellule B utilizzano l’unione somatica di diversi geni su una moltitudine di cromosomi che codificano le diverse parti delle catene pesanti e leggere che compongono le Ig. Le cellule B sono spinte verso la differenziazione attraverso la produzione di IL-7 da parte delle cellule stromali del midollo osseo. Queste cellule B in via di sviluppo seguono un programma di riarrangiamenti sequenziali delle catene pesanti e leggere mediato dall’espressione differenziale dei recettori sulla superficie cellulare. Per esempio, l’espressione di un recettore specifico delle cellule pre-B impedisce certi riarrangiamenti genici su cromosomi non correlati per assicurare che la cellula B matura possa esprimere un certo recettore di superficie Ig capace di riconoscere specificamente un singolo antigene. Questo processo è chiamato esclusione allelica. Un assemblaggio errato delle catene pesanti e leggere delle Ig può indurre un riarrangiamento secondario per l’editing del recettore.
Oltre all’espressione sulla superficie cellulare di un recettore Ig, le cellule B contengono anche proteine transmembrana che possono indurre segnali intracellulari dopo che un antigene si lega alla porzione extracellulare del recettore Ig. Le cellule B utilizzano cascate di segnalazione intracellulare simili a quelle delle cellule T che inducono cambiamenti trascrizionali che portano alla proliferazione e alla maturazione. In particolare, i domini intracellulari del recettore delle Ig possono essere fosforilati dalla famiglia src delle chinasi, dando inizio a una cascata che viene trasmessa dalla tirosin-chinasi Syk e da una proteina di collegamento nota come BLINK alla fosfolipasi C e ai fattori di scambio della guanina, attivando infine la proteina chinasi C, mobilitando il calcio e attivando la MAP chinasi in modo Ras/Rac dipendente.
Una caratteristica unica delle cellule B è la loro capacità di subire il cambio di isotipo. Questo si riferisce specificamente a un processo di riarrangiamento del DNA che può generare catene pesanti leggermente diverse. Inoltre, lo splicing alternativo degli esoni della catena pesante può permettere alle Ig di rimanere legate alla superficie cellulare o di diventare secrete se l’esone transmembrana è splicato. Lo splicing alternativo e la commutazione dell’isotipo sono indotti dalle citochine derivate dalle cellule T. Inoltre, le cellule T possono indurre mutazioni somatiche che portano a cambiamenti nei siti di legame all’antigene delle Ig delle cellule B. Una funzione autocorrettiva delle cellule B può rilevare se queste mutazioni apparentemente casuali portano a una perdita di affinità per l’antigene e avviare un programma di morte cellulare. Così, gli antigeni che attivano sia le cellule T che le cellule B innescano la maturazione delle cellule B mediata dalle cellule T attraverso la commutazione dell’isotipo e le mutazioni somatiche, che sono entrambe altamente associate alla memoria delle cellule B.
Le risposte di memoria sono caratterizzate da una rapida ed estesa produzione di Ig ad alta affinità a tali antigeni. Lo sviluppo di queste risposte di memoria è fondamentale per il successo della vaccinazione. Tuttavia, possono anche aumentare l’autoimmunità e le reazioni allergiche.
L’attivazione delle cellule B indipendenti dalle cellule T da parte di un antigene può anche avvenire; tuttavia, questo tipo di attivazione è legato a una debole memoria immunitaria. Inoltre, questi antigeni devono essere polimerici per attivare le cellule B.
NB: Le citochine, o interleuchine (IL), sono molecole secrete che agiscono su recettori transmembrana della superficie cellulare. Al momento del legame, queste citochine attivano vie di trasduzione del segnale intracellulare tipicamente dipendenti dalla segnalazione Jak-STAT.
Il percorso interattivo di segnalazione del recettore delle cellule B è rivisto in dettaglio qui.
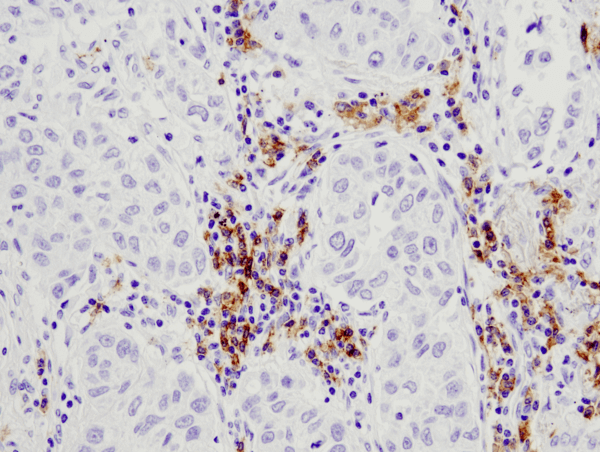
CD19 (D4V4B) XP® Rabbit mAb #90176: analisi IHC di carcinoma polmonare umano incluso in paraffina utilizzando #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: analisi IHC di un carcinoma polmonare umano incluso in paraffina usando #90176.
Cellule NK
Le cellule natural killer, o NK, sono un altro tipo di cellule derivate dalla linea linfoide. Simili alle cellule B, si sviluppano nel midollo osseo in un modo dipendente dalle citochine e dalle cellule stromali del midollo osseo. Rappresentano una piccola parte del sangue periferico e non hanno recettori specifici per l’antigene. Invece, le cellule NK fanno affidamento su un complesso insieme di recettori transmembrana. In particolare, contengono recettori inibitori sulla superficie cellulare che riconoscono le molecole HLA di classe I e sono quindi inibite dalle molecole self-MHC, uccidendo solo le cellule che hanno un’espressione HLA di classe I downregolata. Pertanto, servono l’importante scopo di colpire le cellule infettate dal virus e le cellule tumorali la cui espressione HLA di classe I è stata ridotta per evitare la morte da parte delle cellule T natural killer CD8+ (NK-T). Le cellule NK possono anche essere attivate in modo dipendente dagli anticorpi, dall’interferone o dalle citochine e, quindi, possono svolgere un ruolo importante nella lotta contro i tumori. Il meccanismo d’azione delle cellule NK si basa sul rilascio di piccoli granuli contenenti granzimi e perforina dal loro citoplasma. Al loro rilascio, queste proteine possono creare dei pori e rompere le proteine intracellulari per indurre l’apoptosi. Come tali, le cellule NK sono dette citotossiche.
Le cellule NK-T sono un sottotipo speciale di cellule T che esprimono certi recettori e marcatori tipicamente espressi dalle cellule NK in combinazione con un repertorio limitato di recettori di cellule T. Pertanto, questo sottotipo unico condivide proprietà sia delle cellule T che delle cellule NK. A differenza delle cellule NK, che si sviluppano nel midollo, le cellule NK-T si sviluppano nel timo.
Cellule mieloidi
Le cellule progenitrici mieloidi comuni, che discendono dalle cellule staminali ematopoietiche, danno origine a diversi tipi di cellule mieloidi, compresi i macrofagi, le cellule dendritiche, e diverse altre cellule immunitarie innate e cellule del sangue.
Macrofagi
I macrofagi possono essere attivati per riconoscere antigeni, come cellule danneggiate o materiale estraneo, per una distruzione su richiesta. I macrofagi sono presenti nella maggior parte dei tessuti e rispondono quando necessario alle infezioni e alle cellule morenti. Il materiale riconosciuto viene distrutto attraverso la fagocitosi nel macrofago, che dà alle cellule il loro nome (“grande mangiatore” in greco). I macrofagi assumono varie forme quando sono presenti in luoghi diversi e possono svolgere ulteriori funzioni oltre alla fagocitosi.
Al momento della lesione del tessuto o dell’infezione dell’agente patogeno, i monociti nel sangue vengono reclutati nel tessuto colpito e si differenziano per diventare macrofagi. A seconda della localizzazione del tessuto, esistono diversi tipi di macrofagi, come le cellule di Kupffer nel fegato, i macrofagi alveolari nel polmone, la microglia nel cervello, ecc. Questi diversi tipi di macrofagi derivano tutti dai monociti ma specializzano la loro funzione al tessuto residente. La maggior parte della funzione generale di fagocitosi è svolta dai macrofagi dei tessuti residenti. Oltre a fagocitare cellule morte e materiale estraneo, i macrofagi possono anche segnalare ad altre cellule immunitarie attraverso le citochine. In una certa misura, i macrofagi svolgono la funzione critica della presentazione dell’antigene, lavorando di conseguenza insieme alle cellule T per sostenere l’immunità adattativa. Inoltre, i macrofagi possono secernere citochine come IL-12 e giocare un ruolo nelle risposte immunitarie locali, mentre altri secernono elevate quantità di IL-10, che media il loro ruolo nella riparazione dei tessuti. Così i “grandi mangiatori” svolgono una varietà di ruoli nel sistema immunitario oltre al lavoro principale di fagocitosi.
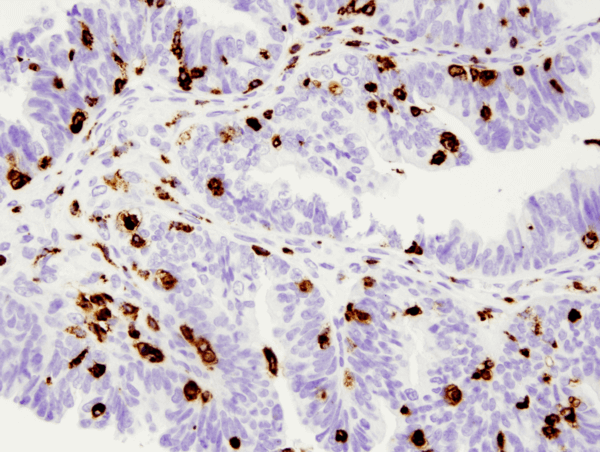
CD68 (D4B9C) XP® Rabbit mAb #76437: analisi IHC di un carcinoma papillare sieroso umano dell’ovaio incluso in paraffina utilizzando #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: analisi IHC di un carcinoma papillare sieroso umano dell’ovaio incluso in paraffina usando #76437.
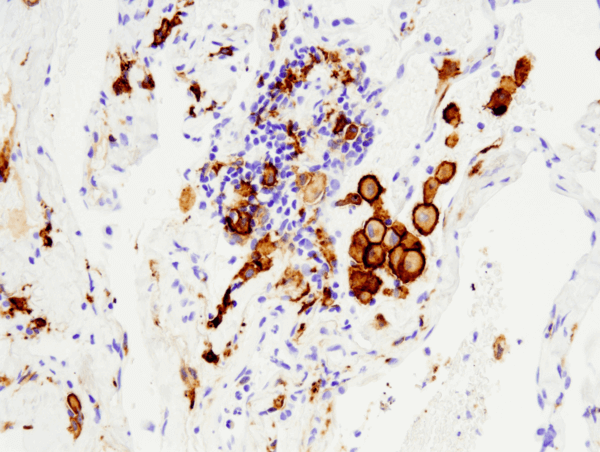
CD163 (D6U1J) Rabbit mAb #93498: analisi IHC di un carcinoma polmonare umano non a piccole cellule incluso in paraffina con #93498 eseguita sul Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: analisi IHC di un carcinoma polmonare umano non a piccole cellule incluso in paraffina usando #93498 eseguita con Leica® Bond™ Rx.
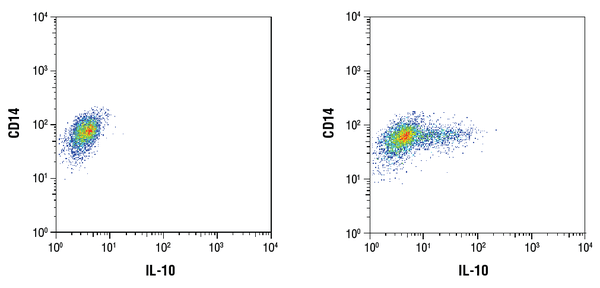
IL-10 (D13A11) XP® Rabbit mAb #12163: Analisi citometrica a flusso di cellule mononucleari di sangue periferico umano purificate CD14+ non trattate (sinistra) o trattate con LPS (100ng/mL, 16 ore; destra) usando un anticorpo CD14 e #12163. Brefeldin A #9972 (300ng/mL) è stato aggiunto alle cellule non trattate e trattate dopo 1 ora di stimolazione LPS. Anti-rabbit IgG (H+L), frammento F(ab’)2 (Alexa Fluor® 647 coniugato) #4414 è stato usato come anticorpo secondario.
IL-10 (D13A11) XP® Rabbit mAb #12163: Analisi citometrica a flusso di cellule mononucleari di sangue periferico umano purificate CD14+ non trattate (sinistra) o trattate con LPS (100ng/mL, 16 ore; destra) usando un anticorpo CD14 e #12163. Brefeldin A #9972 (300ng/mL) è stato aggiunto alle cellule non trattate e trattate dopo 1 ora di stimolazione LPS. Anti-rabbit IgG (H+L), frammento F(ab’)2 (Alexa Fluor® 647 coniugato) #4414 è stato usato come anticorpo secondario.
Cellule dendritiche
Simili ai macrofagi, le cellule dendritiche hanno la capacità di fagocitare materiale cellulare ed estraneo, ma invece di digerirlo per la rimozione, le cellule dendritiche elaborano il materiale e lo presentano come antigeni alle cellule T. Come tali, le cellule dendritiche servono come cellule presentanti l’antigene, o cellule accessorie, e quindi trasmettono informazioni sugli agenti patogeni tra il sistema immunitario innato e quello adattativo. Le cellule dendritiche prendono il loro nome dalle loro distinte proiezioni cellulari che raggiungono e afferrano il materiale nocivo per essere digerito.
Nascendo dai progenitori ematopoietici del midollo osseo, le cellule dendritiche inizialmente immature passano attraverso una fase di “apprendimento” in cui campionano la loro area locale per materiale estraneo e iniziano una risposta di riconoscimento attraverso recettori di riconoscimento del modello (una serie comune di questi recettori sono i recettori toll-like). Queste cellule dendritiche immature possono risiedere in diversi luoghi con accesso all’ambiente esterno, come il rivestimento del naso, dello stomaco, dei polmoni e anche della pelle. Dopo il riconoscimento dell’antigene, le cellule dendritiche migrano verso il linfonodo dove addestrano le cellule T a riconoscere l’antigene e a rispondere di conseguenza. Le cellule dendritiche sono le uniche cellule che presentano l’antigene ad attivare sia le cellule T di memoria che quelle ingenue. I recettori Toll-like sono una classe ben studiata di recettori presenti sui macrofagi e sulle cellule dendritiche, che mediano il riconoscimento e la risposta agli agenti patogeni stranieri. Oltre a interagire direttamente con le cellule T, le cellule dendritiche possono anche segnalare attraverso citochine come l’IL-12, che agisce per preparare il sistema immunitario per il successivo attacco al materiale nocivo. Altri tipi di cellule dendritiche possono secernere citochine che segnalano di reclutare più macrofagi per pulire un sovraccarico di materiale di scarto. Come principali mediatori cellulari per la presentazione dell’antigene, le cellule dendritiche giocano quindi un ruolo indispensabile nel crosstalk tra il sistema immunitario innato e quello adattativo.
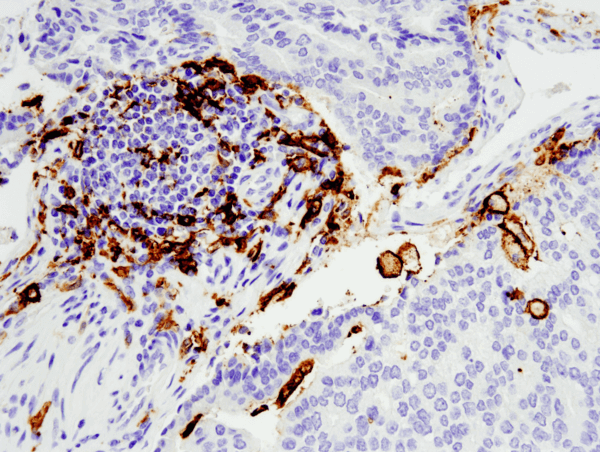
CD11c (D3V1E) XP® Rabbit mAb #45581: Analisi IHC di adenocarcinoma prostatico umano incluso in paraffina utilizzando #455812 eseguita sul Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: Analisi IHC di adenocarcinoma prostatico umano incluso in paraffina utilizzando #455812 eseguita sul Leica® Bond™ Rx.
Altre cellule immunitarie innate e segnalazione
Altre cellule del sistema immunitario innato includono i mastociti, che funzionano nella guarigione delle ferite e aiutano a fornire una protezione contro gli agenti patogeni. Quando vengono innescati da un patogeno, i mastociti possono secernere citochine e granuli contenenti istamina ed eparina, che mediano un’ulteriore risposta immunitaria come il reclutamento di macrofagi e la dilatazione dei vasi sanguigni. I neutrofili, gli eosinofili e i basofili sono chiamati collettivamente granulociti a causa dei caratteristici granuli nel loro citoplasma. Nei neutrofili, i granuli agiscono per rilasciare composti tossici che colpiscono gli agenti patogeni come funghi e batteri.
Immunologia in salute e malattia
Immunologia del cancro
Sfruttare le cellule immunitarie per combattere il cancro è diventato un argomento di ricerca molto caldo grazie al successo nella clinica. Una recente attenzione dell’attuale immunoterapia coinvolge il targeting delle proteine checkpoint di segnalazione, come PD-1, che normalmente impediscono l’attivazione e la risposta delle cellule T. La terapia cellulare adottiva è un altro approccio eccitante che comporta l’immunoediting delle cellule T raccolte dal paziente. Le cellule T sono ingegnerizzate per esprimere un recettore chimerico dell’antigene specifico per le cellule tumorali del paziente. Le cellule T vengono poi reinfuse nel paziente e sono ora programmate per cercare le cellule tumorali e ucciderle, secondo la normale funzione delle cellule T. Questi e altri approcci per manipolare il sistema immunitario per attaccare le cellule cancerose dannose del paziente rappresentano una classe innovativa di terapie per trattare il cancro.