Introduzione
ß amiloide e proteine tau fosforilate sono segni distintivi patologici della malattia di Alzheimer (AD) che si accumulano e si diffondono prevedibilmente attraverso le reti neurali distribuite, causando progressive anomalie metaboliche, lesioni neuronali e morte cellulare. Il neuroimaging facilita una valutazione dettagliata di questi cambiamenti patologici nei pazienti sottoposti a workup per il declino cognitivo. In precedenza, una diagnosi definitiva di AD era possibile solo attraverso l’osservazione post mortem e la stadiazione neuroanatomica di questi aggregati proteici. I recenti progressi nell’imaging molecolare, tuttavia, consentono la visualizzazione dei depositi di amiloide e tau nel cervello umano vivente e ci hanno portato più vicino a una diagnosi definitiva in vivo di AD.
Immagine strutturale
Le linee guida dell’American Academy of Neurology (AAN) per il workup diagnostico delle persone con disturbi cognitivi1 raccomandano l’imaging cerebrale strutturale con TC o RM non a contrasto in qualsiasi persona con una storia clinica positiva e cambiamenti cognitivi oggettivi. In questo contesto, il ruolo primario dell’imaging cerebrale è quello di escludere lesioni strutturali non degenerative, il 5% delle quali può non essere evidente dalla storia clinica o dall’esame fisico2 e sono potenzialmente trattabili. L’AAN raccomanda anche di escludere clinicamente la demenza vascolare (VaD), la demenza a corpi di Lewy (DLB) e la demenza frontotemporale (FTD). L’imaging strutturale può migliorare la certezza diagnostica e cambia la diagnosi clinica nel 19% – 28% così come la gestione del 15% dei casi clinici.2
Le modalità di imaging di scelta quando si valuta l’atrofia strutturale sono CT e MRI. Modelli di atrofia specifici della malattia sono stati accuratamente descritti e convalidati utilizzando queste modalità. Anche se l’atrofia è osservabile su CT, la risoluzione spaziale intrinsecamente inferiore e il contrasto materia grigia/bianca inferiore portano alla perdita di osservazioni sottili potenzialmente utili per quanto riguarda i cambiamenti neurodegenerativi. Pertanto, i medici spesso si affidano alla risonanza magnetica per valutare il modello e la gravità dei cambiamenti strutturali, per escludere cause non neurodegenerative del declino cognitivo, e per valutare la gravità e l’estensione dei cambiamenti della materia bianca, come discusso in maggior dettaglio di seguito.
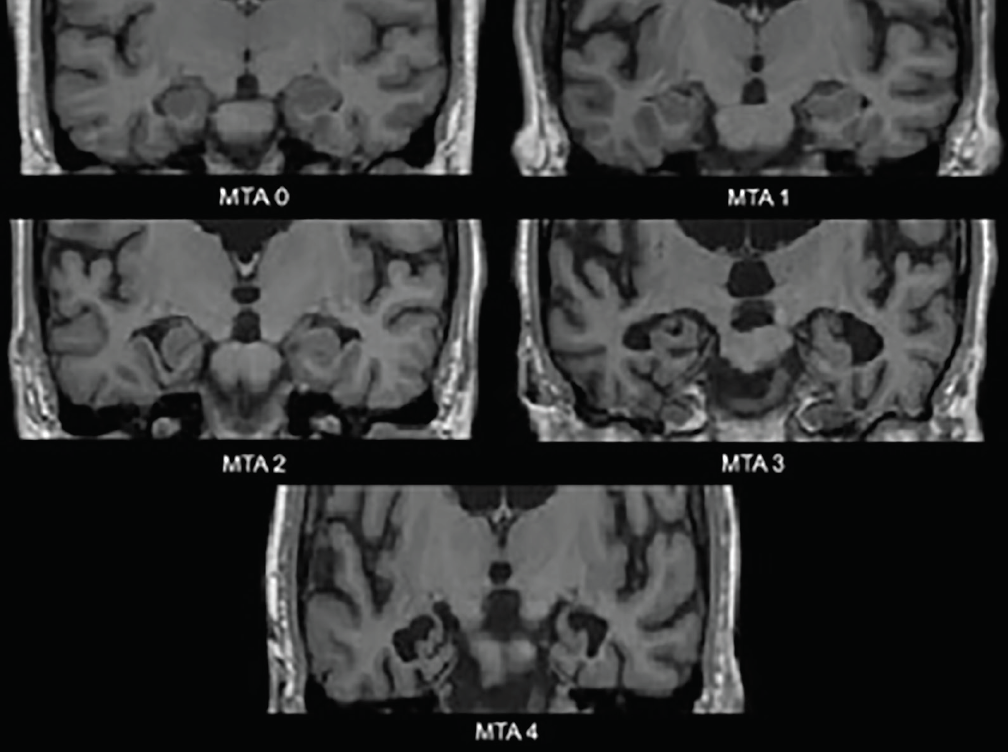
I primi cambiamenti neurodegenerativi nel MA si verificano nei lobi temporali mediali: ippocampo, corteccia entorinale e giro paraippocampale. Con l’inizio dell’atrofia, la fessura coroidea e il corno temporale del ventricolo laterale si dilatano; questi cambiamenti sono meglio valutati sul piano coronale. Una scala di valutazione visiva comunemente usata basata su queste strutture – la scala di atrofia temporale mediale (MTA) (Figura 1) – è stata validata clinicamente3 e neuropatologicamente4. Diversi studi che utilizzano questa scala o le strutture che valuta hanno dimostrato una significativa capacità di discriminare le persone con AD dai controlli di pari età4 o da quelli con DLB4 o deterioramento cognitivo vascolare (VCI).5 L’atrofia temporale mediale è anche predittiva della conversione da deterioramento cognitivo lieve amnestico (MCI) a demenza di Alzheimer.3
Clicca per ingrandire
Figura 1. Valutazioni della scala di atrofia temporale mediale (MTA). MTA 0-nessuno o minimo gapping della fessura coroidea; MTA 1-allargamento sottile della fessura coroidea; MTA 2-allargamento ulteriore della fessura coroidea che si fonde con il corno temporale del ventricolo laterale, lieve diminuzione dell’altezza della formazione ippocampale; MTA 3-moderata diminuzione dell’altezza della formazione dell’ippocampo, prominente allargamento del corno temporale del ventricolo laterale; MTA 4-grave diminuzione dell’altezza della formazione dell’ippocampo, prominente allargamento del corno temporale del ventricolo laterale.
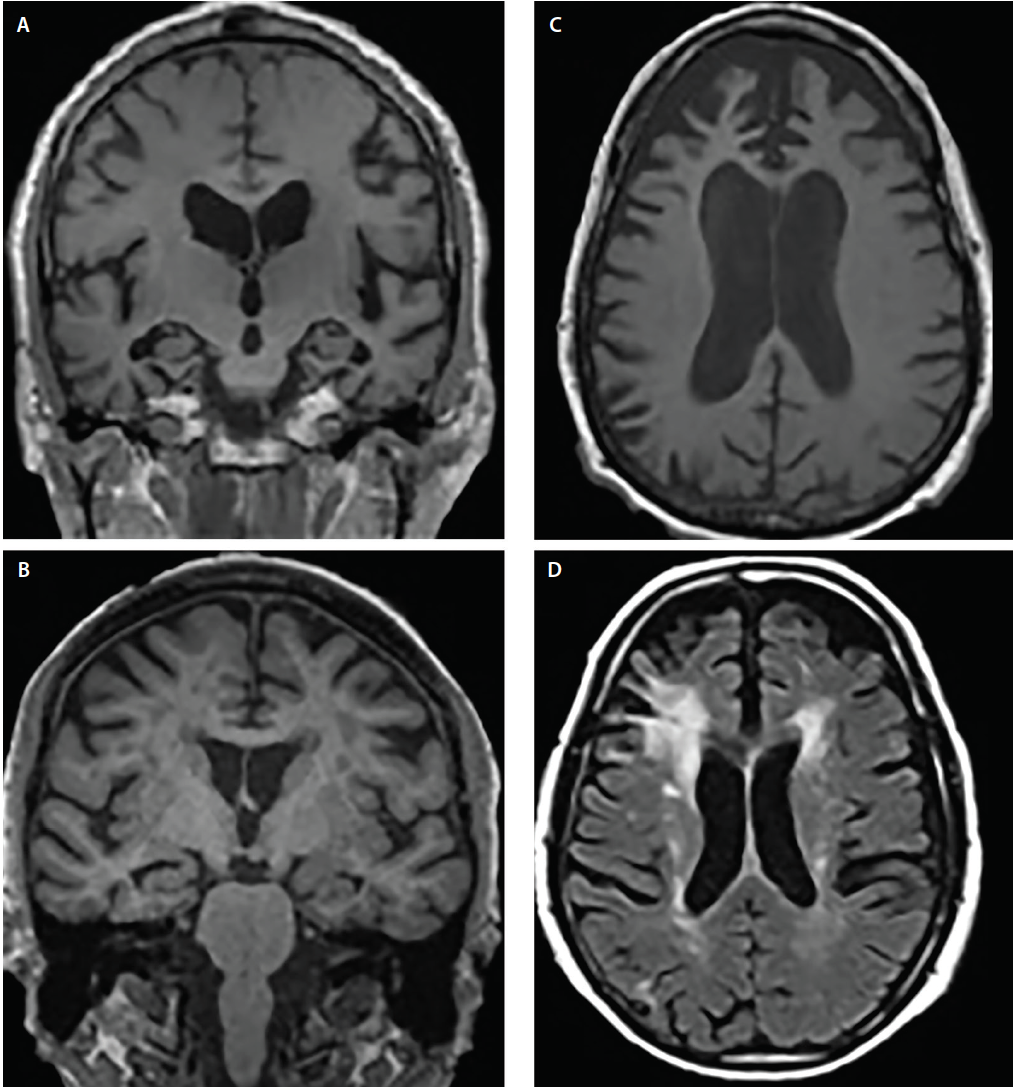
Le sindromi di demenza mostrano tipicamente modelli canonici di atrofia6 che corrispondono a sintomi cognitivi e comportamentali; tuttavia, le strutture coinvolte possono sovrapporsi. Per esempio, AD e DLB mostrano entrambi il coinvolgimento del lobo temporale mediale, ma diversi studi di imaging e neuropatologici hanno dimostrato che, rispetto ad AD, DLB ha una predilezione significativamente minore per le strutture temporali mediali4,5 (Figura 2).
Clicca per ingrandire
Figura 2. Modelli di atrofia strutturale nella malattia di Alzheimer (AD) (A), demenza a corpi di Lewy (DLB) (B), demenza frontotemporale (FTD) (C) e demenza vascolare (VaD) (D). La risonanza magnetica coronale T1 pesata dimostra un’atrofia corticale generalizzata ma diversi gradi di atrofia ippocampale in AD (A) e DLB (B). La risonanza magnetica assiale T1 pesata dimostra atrofia bvFTD con una predilezione focale per la corteccia prefrontale mediale e laterale (C). La risonanza magnetica assiale T2 pesata dimostra un tappo periventricolare confluente e ipointensità della materia bianca dell’alone (WMHs) che coinvolge la corona radiata e si estende nella neocorteccia prefrontale laterale, lievi WMHs sparsi e WMHs del rivestimento ventricolare subependimale e septum pellucidum in VaD (D).
All’AD e alla degenerazione lobare frontotemporale (FTLD) si sovrappongono regioni di atrofia, comprese aree di cortecce prefrontali, orbitofrontali e insulari anteriori, così come i lobi temporali anteriori e mediali.6 Rispetto all’altro, tuttavia, AD mostra significativamente più atrofia nelle cortecce parietali laterali e occipitali, mentre FTLD mostra più atrofia nei lobi frontali (Figura 2).6
È importante valutare sistematicamente tutte le aree cerebrali, notando le regioni sia di atrofia strutturale che di risparmio anatomico per fare il massimo uso di imaging diagnostico. Un grande studio multicentrico ha recentemente valutato la capacità di 6 scale di valutazione visiva di classificare correttamente 186 casi patologicamente confermati di AD, DLB e FTLD.6 Questo studio ha dimostrato che la valutazione simultanea di più regioni specifiche della malattia ha fornito una discriminazione significativamente migliore che concentrarsi su una singola area.4
I danni vascolari sono una considerazione importante quando si valutano gli individui con deterioramento cognitivo. Il cambiamento ischemico è comune nel normale invecchiamento ed è accelerato da comuni comorbidità (ad esempio, ipertensione, diabete e ipercolesterolemia). Contributi vascolari al deterioramento cognitivo sono spesso dedotti quando significative iperintensità della materia bianca (WMH), colpi corticali, o strategicamente situato lacune vengono rilevati su T2-pesato o fluido attenuato inversione recupero (FLAIR) sequenze. Colpi lacunari dei gangli della base e WMH nel centrum semiovale e corona radiata sono indicatori di danno ischemico cronico dei piccoli vasi (Figura 2). Al contrario, i tappi periventricolari sono spesso di origine nonischemica e riflettono la gliosi subependimale.7 Ci sono diverse scale di gravità WMH (ad esempio, la scala Fazekas)7 che possono essere utilizzati in ambito clinico. Tali algoritmi di punteggio sono tutti d’accordo che la diffusa WMH confluente e gli infarti lacunari sottocorticali sono, almeno in parte, probabilmente fattori che contribuiscono al declino cognitivo.7
Diffusion tensor imaging (DTI) è una nuova sequenza MRI sensibile alla diffusione dell’acqua attraverso il tessuto che valuta l’integrità della materia bianca perché l’architettura degli assoni limita il flusso di acqua. Le misure di diffusività media e di anisotropia frazionale sono spesso usate per caratterizzare i cambiamenti neurodegenerativi sulla DTI. La prima misura la grandezza della diffusione e la seconda misura se l’acqua scorre preferenzialmente in una sola direzione, come ci si aspetta negli assoni sani. La diminuzione della diffusività media e la riduzione dell’anisotropia frazionale sono state segnalate in modo consistente nelle popolazioni di MCI e di demenza AD.8 Diversi studi hanno anche identificato cambiamenti DTI in individui asintomatici a rischio di sviluppare AD9 , indicando che questi cambiamenti si verificano all’inizio del decorso della malattia. Oltre a valutare l’integrità della materia bianca, DTI può essere utilizzato per modellare la connettività strutturale lordo tra le regioni corticali utilizzando algoritmi di trattografia. Questo ha guadagnato trazione nel campo di AD come l’evidenza suggerisce che l’amiloide e la patologia tau può propagarsi attraverso connessioni cerebrali.10 Anche se DTI mostra il potenziale come una misura di integrità della materia bianca, la sua sensibilità al movimento e altri vincoli tecnici, limitare, almeno per il momento, la sua applicazione clinica.
Functional Imaging
Ipometabolismo cerebrale è facilmente osservato in disturbi neurodegenerativi e può aiutare nella diagnosi differenziale. La funzione dei neuroni dipende dall’ossigeno e dal glucosio del sangue, la cui consegna è facilitata dalla vasodilatazione regionale. 18F-fluorodeossiglucosio tomografia a emissione di positroni (FDG-PET) riflette indirettamente il grado di attività corticale e può essere facilmente utilizzato per visualizzare i cambiamenti neurodegenerativi sfruttando questa dipendenza metabolica sul glucosio.
La caratteristica firma corticale ipometabolica di AD consiste di cambiamenti precoci nel cingolato posteriore (PCC); precuneo; temporale, parietale e, in fasi successive, cortecce frontali. Questo modello si manifesta precocemente, anche presintomatico,11 ed è clinicamente utile nel distinguere AD da FTD.12 A differenza di AD, la firma metabolica di FTD rivela frontale, temporale anteriore, gangliari basali, e ipometabolismo talamico con relativo risparmio di cortecce associazione posteriore.13 In situazioni clinicamente incerte, i medici possono usare queste firme metaboliche per disambiguare l’AD dalla FTD.12 Allo stesso modo, anche se la firma metabolica neocorticale della DLB può avere una sovrapposizione confondente con quella dell’AD, i casi di DLB possono anche mostrare ipometabolismo occipitale.14
Il Center for Medicare & Medicaid Services ritiene la FDG-PET “ragionevole e necessaria” solo per coloro che soddisfano i criteri sia per AD che per FTD, nei quali il workup diagnostico completo secondo le linee guida AAN1 non ha stabilito definitivamente un’eziologia.15
La risonanza magnetica funzionale (fMRI) può anche misurare l’attività cerebrale utilizzando sequenze che sono sensibili ai cambiamenti temporali dell’emoglobina ossigenata/deossigenata dovuti all’attività cerebrale. In questo modo, la fMRI è legata alla FDG-PET perché i cambiamenti nell’emoglobina sono guidati dal metabolismo del glucosio necessario per l’attività cerebrale. Le dipendenze temporali tra le regioni possono essere utilizzate per dedurre la connettività funzionale (cioè, quali regioni stanno comunicando attivamente). Rispetto alla FDG-PET, la fMRI offre una migliore risoluzione spaziale, permettendo una mappatura più accurata della connettività. Un altro vantaggio della fMRI è che può essere acquisita durante l’esecuzione di un compito o a riposo. Il primo identifica i modelli di connettività guidati da specifici stati attivi, mentre il secondo identifica i modelli di connettività presenti a riposo conosciuti come la rete di modalità predefinita (DMN). La DMN è definita da hub funzionali, il PCC e precuneus, che si collegano a un sottosistema mediale dorsale e un sottosistema temporale mediale.16 Deposito di amiloide è pensato per iniziare negli hub funzionali della DMN. La DMN è nota per essere colpita nell’AD.16 Al contrario, la DMN è risparmiata nella FTD mentre le reti della salienza o dell’attenzione sono colpite.17 Attualmente, la tecnologia fMRI è limitata alle applicazioni di ricerca, ma si stanno attivamente esplorando strade per sviluppare algoritmi rilevanti applicabili clinicamente.
Molecular Imaging
Lo standard di criterio per una diagnosi definitiva di AD è l’esame neuropatologico postmortem del cervello. Anche nelle mani di esperti di demenza, la diagnosi clinica di AD raggiunge solo l’inquietante sensibilità di 70,9% a 87,3% e la specificità di 44,3% a 70,8%.18 Più pertinente per migliorare l’accuratezza diagnostica clinica di AD è stato lo sviluppo di traccianti di imaging PET radiomarcati con affinità specifica per gli aggregati di ß amiloide e tau fosforilati correlati a AD (Figura 3), che consentono la dimostrazione in vivo della neuropatologia sottostante (Tabella), una volta possibile solo post mortem.
Clicca per ingrandire
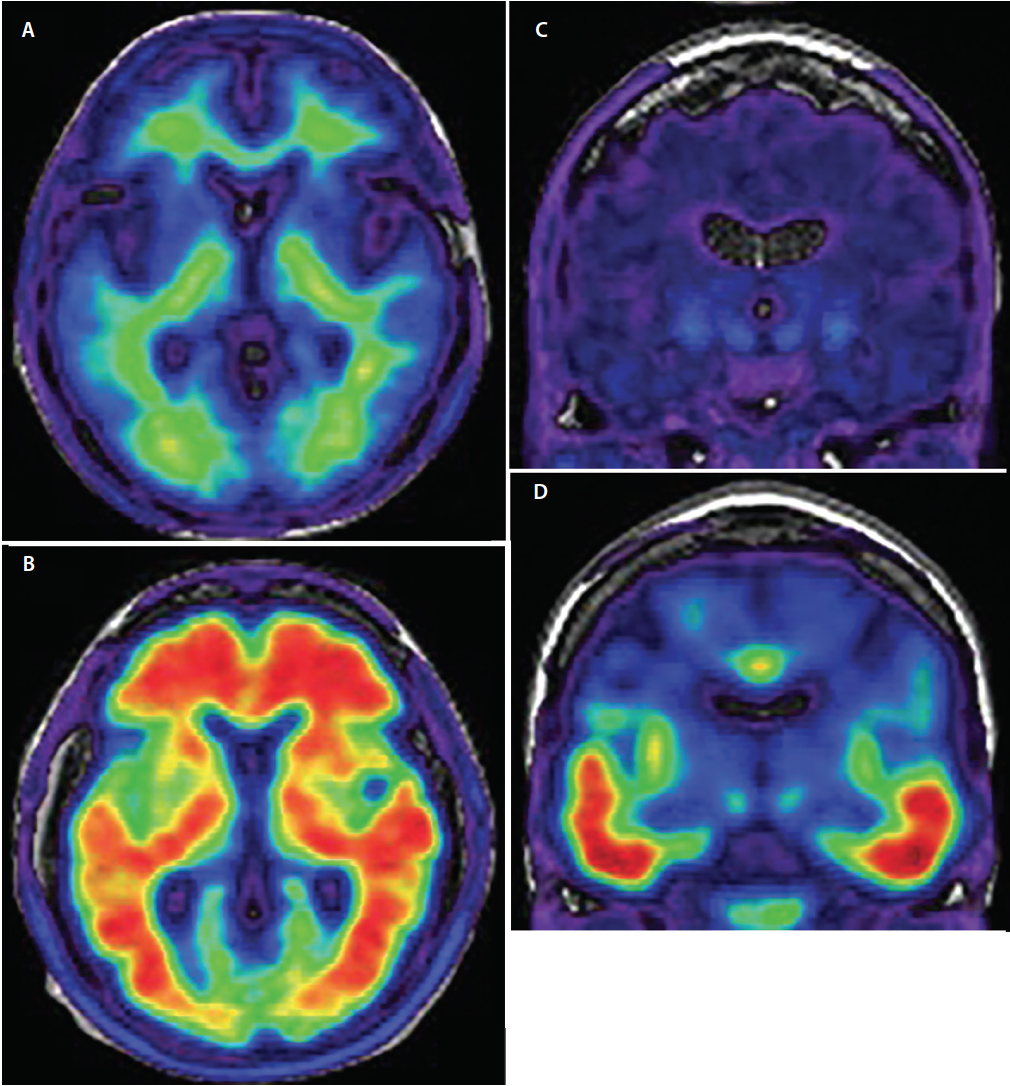
Figura 3. Axial amiloide-PET dimostrando amiloide negativo (A) e amiloide positivo scansioni (B). Nelle immagini negative all’amiloide (A) il segnale del radiotracciante mostra bassa intensità ed è limitato al legame aspecifico della materia bianca. La giunzione materia grigia/bianca è conservata. Nelle immagini positive all’amiloide (B) il segnale del radiotracciante è di alta intensità e si estende diffusamente nelle regioni corticali della materia grigia oscurando la giunzione grigio / bianco. Coronale tau-PET dimostrando tau negativo (C) e tau positivo (D) scansioni. In tau negativo scansioni c’è minimo, non specifico segnale radiotracciante bassa intensità nelle regioni temporale mediale, basale del proencefalo, e gangli della base. Nelle scansioni tau-positive (D) il segnale del radiotracciante è di maggiore intensità e coinvolge le cortecce temporali inferiori e laterali seguendo la nota traiettoria di progressione dei grovigli neurofibrillari.
Tomografia ad emissione di positroni dell’amiloide
L’amiloide, e più recentemente, l’imaging della tau hanno rivoluzionato la nostra capacità di visualizzare la patologia di AD anche nelle fasi presintomatiche.19 I traccianti di imaging PET dell’amiloide sono validi e affidabili per rilevare la patologia di AD in vivo in vari stadi della malattia. Questi traccianti di imaging legano specifici motivi conformazionali della proteina amiloide e determinano un assorbimento del tracciante che è strettamente correlato con la deposizione di amiloide postmortem.20
Rispetto alla tau, la patologia amiloide inizia in un modello regionale più diffusamente distribuito che si diffonde dalle porzioni basali dei lobi frontali, temporali e occipitali alle aree di associazione neocorticale dorsale con un coinvolgimento solo nella fase finale delle cortecce primarie sensoriali e motorie.21 Le aree più notevoli di assorbimento del tracciante sono le cortecce frontale, parietale e temporale laterale (Figura 3), con un assorbimento da 1,5 a 2 volte maggiore nelle persone con AD rispetto ai gruppi di controllo22 o con altre demenze.23
Le immagini PET dell’amiloide sono valutate per l’assorbimento del tracciante corticale nelle aree caratteristiche della distribuzione dell’amiloide di AD. Le scansioni positive mostrano la perdita di distinzione della materia grigia/bianca mentre l’assorbimento del tracciante si estende nella neocorteccia. Le scansioni negative mantengono la distinzione tra materia grigia e bianca, mostrando solo la materia bianca fuori bersaglio vincolante.24 I modelli di imaging PET dell’amiloide possono prevedere in modo affidabile il declino cognitivo sia nelle persone sane che in quelle con MCI.20
18F-florbetapir, 18F-florbetaben, e 18F-flutemetamol sono approvati dalla Food and Drug Administration (FDA) per l’uso clinico.20 Le compagnie di assicurazione, tuttavia, non hanno abbracciato la tecnologia, a causa della spesa e del rischio di sovrautilizzo clinico in assenza di terapie modificanti la malattia e di costi benefici stabiliti. Una meta-analisi ha riportato il 95% di sensibilità e il 57% di specificità di una PET amiloide positiva per prevedere la conversione da MCI a AD.25
L’incerto rapporto tra costi, rischi e benefici ha portato allo sviluppo di criteri di utilizzo appropriato per l’imaging dell’amiloide, attribuendo la necessità della valutazione della PET amiloide a persone con MCI inspiegabile, presentazioni atipiche di AD e demenza ad esordio precoce.26 Gli esperti hanno anche identificato indicazioni inappropriate per l’imaging dell’amiloide che includono la valutazione autonoma per problemi cognitivi prima di un approfondito workup clinico, cognitivo, di laboratorio e di neuroimaging strutturale; in assenza di deterioramento cognitivo oggettivo; in alta probabilità di AD (cioè, in assenza di un equipoise clinico; e per la stadiazione della gravità della demenza.
Lo studio IDEAS (imaging dementia-evidence for amyloid scanning) – uno studio in corso del Center for Medicare and Medicaid Services – sta attualmente convalidando i criteri di utilizzo appropriati e valutando l’impatto dello stato di amiloide determinato dalla PET sulla gestione della malattia e sugli esiti a lungo termine per i beneficiari Medicare con MCI o presentazioni atipiche. L’analisi provvisoria ha rivelato che l’integrazione della PET sull’amiloide nel workup clinico ha portato a cambiamenti nella gestione della malattia nel 60,2% delle persone con MCI e nel 63,5% di quelle con demenza.27 Gli esiti a lungo termine sono ancora in fase di determinazione.
Tomografia a emissione di positroni Tau
Tau è la seconda proteina che si deposita nel cervello delle persone con AD. I traccianti di imaging Tau PET sono attualmente in fase di sviluppo e mostrano già promesse. Simile all’amiloide PET, i traccianti tau PET mirano a particolari motivi conformazionali della tau fosforilata. La specificità dei traccianti tau è stata convalidata post mortem,28 e il segnale PET tau osservato corrisponde da vicino alla distribuzione anatomica dei grovigli neurofibrillari attualmente utilizzati per una diagnosi neuropatologica di AD.29 Le prime fasi della patologia tau che possono essere visualizzate con l’imaging PET tau sono i depositi di grovigli neurofibrillari nella corteccia entorinale e nell’ippocampo. Successivamente, i depositi di tau diventano rilevabili nel temporale inferiore e laterale (Figura 3), seguito dal parietale e occipitale, e infine le cortecce frontali seguendo la ben stabilita stadiazione patologica di Braak e Braak di deposizione tau attraverso il cervello.21 Traccianti tau non sono senza limiti diagnostici e sono in fase di ulteriore sviluppo per definire meglio il loro ruolo clinico. Tuttavia, dato che il legame del tracciante tau cambia dinamicamente durante l’intero corso clinico di AD, questa modalità di imaging probabilmente avrà un ruolo significativo nella stadiazione della gravità della malattia in vivo.30
Direzioni future
Dato che la patologia dell’AD può essere facilmente individuata fino a 20 anni prima della diagnosi di demenza19 e segue una distribuzione prevedibile a stadi, la ricerca è ora concentrata sulla rilevazione precoce presintomatica e sul miglioramento dell’accuratezza diagnostica attraverso l’uso di biomarcatori (Tabella).31 Una proposta di quadro di ricerca amiloide-tau-neurodegenerazione (ATN) incentrata sul rilevamento di 3 cambiamenti di biomarcatori nel cervello prevede la rilevanza clinica dell’imaging multimodale.31 Il sistema di classificazione ATN è agnostico rispetto alle sindromi cliniche e cattura l’intero spettro delle malattie neurodegenerative attraverso una lente di biomarcatore AD. Dopo un ulteriore sviluppo e perfezionamento, l’ATN, attraverso la categorizzazione oggettiva dei biomarcatori in vivo, dovrebbe migliorare notevolmente l’accuratezza diagnostica clinica e migliorare la qualità delle cure.
Conclusione
L’neuroimaging offre informazioni uniche sull’eziologia sottostante al deterioramento cognitivo e facilita la guida dei pazienti e delle famiglie attraverso un’esperienza paurosa e incerta. Tutte le malattie neurodegenerative mostrano una significativa eterogeneità clinica, e prima dei più recenti progressi dell’imaging molecolare, nessuna poteva essere diagnosticata definitivamente prima della morte. La moderna tecnologia di imaging cerebrale è in grado di rilevare una moltitudine di epifenomeni che riflettono la neuropatologia sottostante, alcuni dei quali sono molto vicini alla fonte della malattia. La diagnosi clinica più sicura è attualmente basata su un’integrazione di storia clinica, osservazioni del medico, esame fisico, workup medico, test neuropsicologici e interpretazione informata delle neuroimmagini diagnostiche. Come i biomarcatori ATN sono ulteriormente raffinati, le diagnosi cliniche saranno fatte prima e più definitivamente in pazienti viventi, si basano meno sulla classificazione dei sintomi e forniscono opportunità per un intervento terapeutico più precoce che può modificare la traiettoria della malattia neurodegenerativa.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Parametro di pratica: diagnosi di demenza (una revisione basata sull’evidenza). Rapporto del sottocomitato per gli standard di qualità dell’Accademia Americana di Neurologia. Neurologia. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Valutazione della demenza: uno studio sistematico dell’utilità dei parametri di pratica dell’American Academy of Neurologia. Neurologia. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. Scale di valutazione visiva MRI nella diagnosi di demenza: valutazione in 184 casi confermati post-mortem. Cervello. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Atrofia del lobo temporale mediale su MRI differenzia la malattia di Alzheimer da demenza con corpi di Lewy e deterioramento cognitivo vascolare: uno studio prospettico con verifica patologica della diagnosi. Cervello. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Modelli di atrofia nelle demenze confermate patologicamente: un’analisi voxelwise. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Correlati patologici delle iperintensità di segnale della materia bianca incidentali MRI. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion tensor imaging della materia bianca di aspetto normale nel decadimento cognitivo lieve e malattia di Alzheimer precoce: prove preliminari di degenerazione assonale nel lobo temporale. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Cambiamenti di imaging della materia bianca nel deterioramento cognitivo soggettivo e lieve. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Alterazioni strutturali del tratto predire l’accumulo di tau a valle in individui anziani positivi all’amiloide. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping dei cambiamenti metabolici cerebrali in anziani cognitivamente normali e lievemente compromessi. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET migliora la precisione nel distinguere la demenza frontotemporale e la malattia di Alzheimer. Cervello. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Metabolismo cerebrale del glucosio in pazienti con demenza frontotemporale. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardizzato 18F-FDG PET diagnosi di decadimento cognitivo lieve, malattia di Alzheimer e altre demenze. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Memo decisionale per la tomografia a emissione di positroni (FDG) e altri dispositivi di neuroimaging per la demenza sospetta (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Accessed May 4, 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Hub corticali rivelati dalla connettività funzionale intrinseca: mappatura, valutazione della stabilità e relazione con la malattia di Alzheimer. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Malattie neurodegenerative bersaglio su larga scala reti cerebrali umane. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuratezza della diagnosi clinica della malattia di Alzheimer al National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging l’evoluzione e la fisiopatologia della malattia di Alzheimer. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. Il valore diagnostico di FDG e amiloide PET nella malattia di Alzheimer: una revisione sistematica. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Stabilizzazione neuropatologica dei cambiamenti legati all’Alzheimer. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging amiloide cervello nella malattia di Alzheimer con Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalenza di positività PET amiloide in sindromi di demenza: una meta-analisi. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedura standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Accuratezza predittiva dell’imaging amiloide per la progressione dal decadimento cognitivo lieve alla malattia di Alzheimer con diverse lunghezze di follow-up: una meta-analisi. . Medicina (Baltimora). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Criteri di utilizzo appropriato per l’amiloide PET: un rapporto della Amyloid Imaging Task Force, la società di medicina nucleare e imaging molecolare, e l’Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Associazione di tomografia a emissione di positroni amiloide con successivo cambiamento nella gestione clinica tra i beneficiari di medicare con decadimento cognitivo lieve o demenza. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Convalida autoradiografica del nuovo tracciante PET tau -MK-6240 su tessuto cerebrale umano postmortem. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Primi risultati di imaging PET clinico con il nuovo radioligando PHF-tau -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Valutazione di imaging tau nella stadiazione della malattia di Alzheimer e rivelando le interazioni tra beta-amiloide e tauopatia. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Verso una definizione biologica della malattia di Alzheimer. Alzheimers Dement. 2018;14(4):535-562.
MRA e DS non riportano alcuna divulgazione.
LGA ha servito come membro del comitato consultivo per Eli Lilly.