- Introduzione
- Metodi
- Soggetti e disegno
- Acquisizione RM e valutazione del volume standard
- Image Preprocessing
- Segmentazione tissutale con clustering discriminativo
- Stima del volume parziale
- Valutazione neuropsicologica
- Analisi statistica
- Risultati
- Caratteristiche dei soggetti
- Volumi parziali WML e altri risultati MRI
- Volumi parziali WML come predittori di prestazioni cognitive
- Discussione
- Contributi degli autori
- Conflict of Interest Statement
- Acknowledgments
- Materiale supplementare
- Abbreviazioni
- Note
Introduzione
La malattia dei piccoli vasi cerebrali (SVD) è la causa più comune di deterioramento cognitivo vascolare e demenza. Le lesioni della materia bianca (WML) sono il marker principale della SVD sull’imaging cerebrale, insieme agli infarti lacunari, ai microbleed e all’atrofia cerebrale. Tutti questi risultati hanno dimostrato di influenzare l’esito clinico e cognitivo (Jokinen et al., 2011, 2012; Muller et al., 2011; Poels et al., 2012). Lo studio Leukoaraiosis and Disability (LADIS), tra gli altri studi, ha dimostrato che la WML è correlata al declino cognitivo, alla compromissione delle capacità funzionali, alla depressione e ai disturbi dell’andatura e dell’equilibrio (LADIS Study Group, 2011).
La risonanza magnetica (MRI) è stato il metodo standard nella valutazione della WML. Nonostante i significativi miglioramenti recenti nelle tecniche di analisi quantitativa delle immagini, uno dei maggiori ostacoli nella risonanza magnetica è ancora la sua risoluzione spaziale finita, che porta a effetti di volume parziale. Insieme al rumore e alla disomogeneità, pone difficoltà alle tecniche di segmentazione del cervello. Spesso, un’attenta analisi dei confini tra tessuti sani e patologici è necessaria per delineare l’estensione e la gravità delle lesioni, applicando una “soglia decisionale” implicita per la segmentazione delle lesioni. Inoltre, le iperintensità nella risonanza magnetica sembrano rappresentare solo la fase finale del processo patologico. Un danno tissutale più diffuso può essere associato alla WML, non visibile alla RM di routine (Schmidt et al., 2011). Non esiste uno standard per valutare tali stadi iniziali di danno tissutale, poiché i loro valori di intensità non sono sufficientemente distinti da quelli dei tessuti normali.
La maggior parte dei moderni metodi di segmentazione si basano su informazioni precedenti, come atlanti cerebrali medi (Smith et al., 2004; Ashburner e Friston, 2005; Goebel et al., 2006) o etichettatura manuale (Wismüller et al., 2004; Lee et al., 2009; Cruz-Barbosa e Vellido, 2011). Recentemente, è stato proposto un nuovo metodo data-driven per la segmentazione dei tessuti, basato su una strategia di clustering discriminativo (DC), in un approccio di apprendimento automatico auto-supervisionato (Gonçalves et al., 2014). Questo metodo riduce al minimo l’uso di informazioni preliminari e utilizza dati MRI multispettrali. A differenza di altri metodi, che mirano solo ai tessuti sani (Pham e Prince, 1998; Van Leemput et al., 1999; Zhang et al., 2001; Manjón et al., 2010) o a specifici tipi di lesioni (Van Leemput et al., 2001; Zijdenbos et al., 2002; Styner et al., 2008; Cruz-Barbosa e Vellido, 2011), DC permette lo studio di una vasta gamma di tipi di tessuto normale e anormale. Un altro grande vantaggio del metodo proposto è la sua capacità di stimare le probabilità di tessuto per ogni voxel, necessario per una caratterizzazione adeguata dell’evoluzione WML. I voxel possono essere classificati come contenenti una piccola (ancora troppo debole per essere chiaramente visibile), intermedia o alta proporzione di WML. Quelli che contengono una piccola proporzione di lesione sono di solito al di fuori della “soglia di decisione” della segmentazione convenzionale, e indicano una WML allo stadio iniziale.
L’obiettivo del presente studio è quello di osservare come i diversi stadi di lesioni sono legati alle prestazioni cognitive in un campione di soggetti anziani con WML da lieve a moderata. I dati utilizzati consistevano in misurazioni MRI raccolte in un periodo di follow-up di 3 anni, e valutazioni neuropsicologiche annuali in quel periodo. In particolare, eravamo interessati a determinare se anche i volumi di WML parziali piccoli di primo stadio, nel tessuto cerebrale dall’aspetto normale, sono in grado di prevedere in modo indipendente il futuro declino cognitivo, incrementale al carico WML convenzionalmente valutato.
Metodi
Soggetti e disegno
I soggetti erano un sottogruppo di partecipanti (n = 78) da tre centri (Amsterdam n = 21, Graz n = 18, Helsinki n = 39) dello studio LADIS, uno studio multicentrico europeo che indaga l’impatto della WML legata all’età nella transizione dall’indipendenza funzionale alla disabilità. Il protocollo LADIS e le caratteristiche del campione sono state riportate in dettaglio altrove (Pantoni et al., 2005). In breve, 639 soggetti sono stati arruolati in 11 centri secondo i seguenti criteri di inclusione: (a) età 65-84 anni, (b) WML da lieve a grave secondo la scala Fazekas rivista (Pantoni et al., 2005), (c) nessuna o minima compromissione nella scala Instrumental Activities of Daily Living (≤ 1 degli 8 item compromessi) (Lawton e Brody, 1969), e (d) presenza di un informatore regolarmente contattabile. I criteri di esclusione erano: (a) grave malattia suscettibile di abbandono del follow-up (insufficienza cardiaca, epatica o renale, neoplastica o altra malattia sistemica rilevante), (b) grave malattia neurologica non correlata o disturbo psichiatrico, (c) leucoencefalopatie di origine non vascolare (immunologico-demielinizzanti, metaboliche, tossiche, infettive), e (d) incapacità o rifiuto di sottoporsi a risonanza magnetica.
La valutazione di base comprendeva la risonanza magnetica cerebrale e approfondite valutazioni mediche, funzionali e neuropsicologiche. Le valutazioni cliniche sono state ripetute a intervalli di 12 mesi in tre successive valutazioni di follow-up.
Per consentire un confronto valido tra soggetti/centri, le sequenze di RM ottenute in ogni centro dovevano essere le stesse, e ogni paziente doveva avere tre sequenze disponibili, senza artefatti importanti. I 78 soggetti inclusi in questo studio non differivano dalla coorte completa LADIS in età, sesso, punteggio basale Mini-Mental State Examination (MMSE), o volume WML, ma avevano un’istruzione significativamente più alta (9.3 vs 11.7 anni; t = -4.6, p < 0.001).
Lo studio è stato approvato dai comitati etici di ogni centro partecipante allo studio LADIS (LADIS Study Group, 2011). Tutti i soggetti hanno ricevuto e firmato un consenso informato scritto. I collaboratori dello studio LADIS sono elencati nell’Appendice II.
Acquisizione RM e valutazione del volume standard
Tutte le scansioni di RM assiale utilizzate sono state acquisite con apparecchiature 1.5T, seguendo lo stesso protocollo in ogni centro, comprese le immagini di trasferimento di magnetizzazione (TE = 10-14 ms, TR = 740-780 ms), le immagini T2-weighted fast spin echo (TE = 100-120 ms, TR = 4000-6000 ms), e le immagini FLAIR (fluid attenuated inversion recovery) (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Tutte le sequenze avevano una dimensione del voxel di 1 × 1 × 5-7.5 mm3, FOV = 250 e uno spazio interslice di 0.5 mm.
L’estensione delle iperintensità sulle regioni della materia bianca compresa la regione infratentoriale è stata valutata su immagini assiali FLAIR con un’analisi volumetrica semi-automatica (VFLAIR) utilizzando una workstation Sparc 5 (SUN) (van Straaten et al., 2006). Le lesioni sono state contrassegnate e i confini sono stati impostati su ogni fetta utilizzando la soglia locale (software sviluppato in casa Show_Images, versione 3.6.1). Non è stata fatta alcuna distinzione tra iperintensità sottocorticali e periventricolari. Le aree di iperintensità sulle immagini T2 pesate intorno agli infarti e alle lacune non sono state prese in considerazione. Il numero di lacune è stato registrato nella materia bianca e nella materia grigia profonda usando una combinazione di immagini FLAIR, magnetizzazione preparata ad acquisizione rapida gradient-echo, e T2 per distinguere le lacune dagli spazi perivascolari e dai microbleeds (Gouw et al., 2008). Inoltre, l’atrofia cerebrale è stata valutata secondo una scala di valutazione basata su un modello su immagini FLAIR separatamente sulle regioni corticali e subcorticali (Jokinen et al., 2012).
Image Preprocessing
Per garantire che le informazioni multispettrali contenute in ogni voxel provenissero esattamente dalla stessa posizione in ogni soggetto, la registrazione intra-paziente è stata applicata per tutte le sequenze disponibili, utilizzando il toolbox SPM5 (Friston, 2003), e applicando una trasformazione affine con l’immagine a più bassa risoluzione, tipicamente FLAIR, come modello. Inoltre, i voxel di tessuto extra-meningeo sono stati mascherati, utilizzando un metodo automatico standard (BET2) (Smith et al., 2004).
Segmentazione tissutale con clustering discriminativo
I recenti progressi nelle tecniche di apprendimento automatico hanno mostrato risultati competitivi nella segmentazione dei tessuti, spesso superando le accuratezze raggiunte dai classici metodi basati sulla crescita delle regioni o sulla soglia (Styner et al., 2008). In particolare, rispetto alla delineazione manuale, sono più robusti e meno soggettivi. Il metodo di segmentazione dei tessuti utilizzato in questo studio era una tecnica di apprendimento automatico, basata su una metodologia auto-supervisionata guidata dai dati, radicata su una strategia DC (Gonçalves et al., 2014). Simile agli algoritmi di clustering non supervisionato, come k-nearest neighbors, DC raggruppa i dati di input secondo le loro informazioni distributive multidimensionali a livello di grigio. Nello studio attuale, queste distribuzioni erano tridimensionali, che corrispondono al numero totale di sequenze utilizzate. Il vantaggio principale di DC è la sua capacità di utilizzare un piccolo insieme di informazioni etichettate per sostenere l’assegnazione del clustering. Questa caratteristica porta a un chiaro miglioramento dei risultati di segmentazione, al di là delle tecniche di clustering tradizionali (Gonçalves et al., 2014).
L’obiettivo generale di DC può quindi essere riassunto come partizionare lo spazio dei dati in regioni clusterizzate con distribuzioni piuttosto uniformi in tutto, e informazioni di etichetta coerente per tutti i voxel appartenenti a ciascun cluster. Una spiegazione più dettagliata è data nell’Appendice I, con la descrizione matematica completa presentata in Gonçalves et al. (2014).
Stima del volume parziale
DC dà la probabilità di appartenenza di ogni voxel a tutte le classi di tessuto, consentendo la stima delle informazioni sul volume parziale. Dato che intendevamo concentrare il nostro studio sui voxel lesionati, abbiamo analizzato solo quelli in cui la proporzione di tessuto lesionale presente è rilevante.
In questo studio, sono state identificate tre diverse categorie di lesioni, che portano a una quantità corrispondente di stima del volume: il volume dei voxel che hanno una probabilità ALTA (VDC100), INTERMEDIA (VDC66), o PICCOLA (VDC33) di essere lesioni. VDC100 e VDC66 sono i volumi in cui il tessuto principale nei voxel in essi presenti, ha una probabilità di essere lesione di >66% e < 66%, rispettivamente. Poiché entrambi i volumi VDC100 e VDC66 contengono una maggioranza di tessuto lesionale, VFLAIR1 può essere approssimato dalla somma: VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. Quindi, usando la DC, la migliore stima possibile del volume della lesione visibile è ottenuta da VDCHARD. L’ultima categoria, VDC33 corrisponde al volume dei voxel in cui la lesione è il secondo tipo di tessuto più probabile, con probabilità ≥ 33%. Si noti che, questo volume non è considerato come lesione in metodi di segmentazione normale, come quello che stima VFLAIR, poiché la lesione non è mai il tipo di tessuto principale in esso.
La capacità del presente metodo di segmentazione per rilevare lesioni in fase iniziale è stato verificato in un sottogruppo di pazienti (n = 19) con dati di follow-up MRI, c.f. Materiali supplementari: Appendice I). Lì dimostriamo che i piccoli volumi parziali WML indicano possibili localizzazioni future di lesioni completamente sviluppate.
Valutazione neuropsicologica
La batteria di test cognitivi dello studio LADIS includeva il MMSE (Folstein et al., 1975), la Vascular Dementia Assessment Scale-Cognitive Subscale (VADAS) (Ferris, 2003), il test Stroop (MacLeod, 1991), e il Trail making test (Reitan, 1958). Per i presenti scopi, abbiamo usato i punteggi totali MMSE e VADAS come misure globali della funzione cognitiva. Inoltre, tre misure composte psicometricamente robuste sono state costituite per la valutazione di specifici domini cognitivi utilizzando i punteggi standard medi dei singoli subtest come descritto in precedenza (Moleiro et al., 2013): (1) velocità e controllo motorio = punteggi z (Trail making A + labirinto + cancellazione cifre)/3; (2) funzioni esecutive = punteggi z di /4; e (3) memoria = punteggi z (richiamo immediato di parole + richiamo ritardato + riconoscimento di parole + digit span)/4.
La percentuale di valori mancanti nelle variabili dei test neuropsicologici variava tra 0 e 6,4% al basale, e tra 24,4 e 32,1% all’ultima valutazione di follow-up. Questa perdita di dati era dovuta alla morte dei soggetti (n = 2), all’abbandono delle valutazioni neuropsicologiche di follow-up (visita dell’ultimo anno, n = 17), o all’incapacità di completare l’intera batteria di test (n = 6).
Analisi statistica
I predittori delle prestazioni cognitive longitudinali sono stati analizzati utilizzando modelli misti lineari (stima di massima verosimiglianza ristretta), che sono in grado di trattare con valori mancanti e strutture di covarianza complesse. L’anno di valutazione (basale, 1°, 2° e 3°) è stato utilizzato come variabile all’interno del soggetto, ed è stata adottata una struttura di covarianza non strutturata. I punteggi dei test cognitivi sono stati impostati come variabili dipendenti. I volumi delle lesioni parziali (VDC33, VDC66, e VDC100) sono stati testati come predittori, uno per uno. In tutti i modelli, l’età, il sesso e gli anni di istruzione sono stati utilizzati come covariate. I modelli sono stati ripetuti aggiungendo la VFLAIR come un’altra covariata, per scoprire il valore predittivo delle misure di volume parziale incrementale a quello del volume WML convenzionalmente valutato. Allo stesso modo, il centro di studio è stato aggiunto come potenziale confondente, ma poiché non ha avuto alcun effetto essenziale sui risultati, è stato lasciato fuori dalle analisi finali. A causa delle distribuzioni asimmetriche che potrebbero compromettere l’ipotesi di linearità dei modelli di miscela, la trasformazione logaritmica è stata applicata a tutte e tre le misure di volume parziale e alla VFLAIR. I risultati sono stati analizzati con il modulo misto IBM SPSS Statistics 22. La significatività statistica è stata fissata a p < 0,05 per tutte le analisi.
Risultati
Caratteristiche dei soggetti
Le caratteristiche dei soggetti al basale sono riportate nella tabella 1. Secondo la scala Fazekas rivista, 28 (35,9%) soggetti avevano WML lieve, 26 (33,3%) moderata, e 24 (30,8%) grave.

Tabella 1. Caratteristiche di base dei soggetti, n = 78.
Volumi parziali WML e altri risultati MRI
Tabella 1 mostra i volumi ottenuti con il metodo di segmentazione convenzionale, i volumi di lesioni parziali stimati da DC, e il coefficiente di similarità Dice che confronta entrambi i metodi di segmentazione. La Figura 1 presenta un confronto tra l’immagine FLAIR originale (1A), il volume di iperintensità stimato convenzionalmente, VFLAIR (1B), e i risultati ottenuti per i volumi parziali WML VDC100 (1C), VDC66 (1D), e VDC33 (1E). Frames 1F-1J mostra le immagini corrispondenti nella zona ingrandita denotata dal rettangolo bianco del frame 1A. L’evoluzione intorno ai focolai di lesione, da completamente soffiato nel centro alla fase intermedia e piccola proporzione di lesione ai bordi, può essere visto in cornici 1H-J. Si noti che i voxel classificati come VDC33 non sono inclusi nel VFLAIR, ma sono indicativi di possibili sedi di future lesioni. La Figura 2 mostra risultati simili su un livello più alto, il centrum semiovale. La procedura di segmentazione DC ha utilizzato tre diverse sequenze (FLAIR, T2, T1). Qui, solo FLAIR è mostrato a scopo illustrativo.
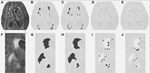
Figura 1. Lesioni della materia bianca (WML) ad un’altezza media. (A) Immagine FLAIR per un dato soggetto. (B) WML stimato convenzionalmente. (C-E) WML stimato, utilizzando l’algoritmo di segmentazione proposto, per pieno, intermedio, e piccola proporzione di lesione. (F-J) Immagini simili per la porzione ingrandita rappresentata dal riquadro bianco in (A).
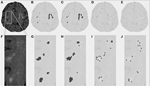
Figura 2. Lesioni della materia bianca (WML) nel centrum semiovale. (A) Immagine FLAIR per un dato soggetto. (B) WML stimato convenzionalmente. (C-E) WML stimato utilizzando l’algoritmo di segmentazione proposto, per pieno, intermedio, e piccola proporzione di lesione. (F-J) Immagini simili per la porzione ingrandita raffigurata dal riquadro bianco in (A).
Per l’intero set di dati utilizzato, le tre misure di volume WML parziale erano significativamente correlate tra loro: VDC33*VDC66 r = 0,87; VDC33*VDC100 r = 0,47; VDC66*VDC100 r = 0,47 (p < 0,001). Essi hanno anche correlato significativamente con VFLAIR: VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023), e VDC100 r = 0,87 (p < 0,001), rispettivamente. Tuttavia, le misure non erano significativamente associate con la presenza di infarti lacunari (no / pochi / molti) o punteggio di atrofia cerebrale globale (corticale e sottocorticale) (p > 0,05).
Figura 3 identifica le segmentazioni condivise e disparate tra la segmentazione convenzionale (VFLAIR), e DC (VDCHARD) per il soggetto della Figura 1. C’è una chiara sovrapposizione tra le due segmentazioni, come mostrato dal gran numero di pixel verdi. Per il soggetto mostrato in quella figura, c’è una piccola differenza tra VFLAIR e VDCHARD.
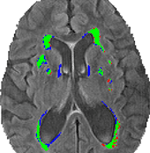
Figura 3. Confronto dei metodi di segmentazione. Questa immagine mostra la segmentazione ottenuta usando l’analisi volumetrica semi-automatica (VFLAIR) e il clustering discriminativo (VDCHARD) per il soggetto della Figura 1. Le regioni rappresentate in verde corrispondono alla segmentazione sovrapposta tra i due approcci. In rosso sono mostrate le regioni classificate come lesione solo dal metodo convenzionale, mentre il blu corrisponde al voxel classificato come lesione solo da DC.
La stima della classificazione completa del tessuto di un soggetto, utilizzando DC su un PC con CPU Intel® Core™ i5-4590@ 3.30 GHz con 16 GB di RAM, ha richiesto circa 25 min. La stima delle etichette, su detto computer, ha richiesto circa 70 minuti. Un miglioramento di quest’ultima stima dovrebbe snellire significativamente la procedura.
Volumi parziali WML come predittori di prestazioni cognitive
Le relazioni tra i volumi parziali WML e le prestazioni cognitive longitudinali sono riassunte nella tabella 2. I modelli misti lineari aggiustati per età, sesso e istruzione hanno mostrato associazioni negative significative tra VDC33 e il punteggio composto per le funzioni esecutive. In primo luogo, VDC33 è stato associato a un effetto principale significativo sul livello complessivo delle prestazioni esecutive (punteggi in media su tutte e quattro le valutazioni temporali). In secondo luogo, l’interazione tra VDC33 e il tempo (anno di valutazione) ha indicato un significativo valore predittivo di VDC33 sul cambiamento delle prestazioni esecutive nel corso dei 3 anni di follow-up. In particolare, un carico più elevato di VDC33 si riferiva a prestazioni più scarse al basale e a un declino più ripido nelle funzioni esecutive in ogni anno di valutazione successivo. Dopo un ulteriore aggiustamento per VFLAIR, questi risultati sono rimasti invariati. Inoltre, c’era una debole associazione al basale tra VDC33 e il punteggio totale VADAS, ma questo risultato non era più significativo dopo aver controllato per VFLAIR.VDC33 non aveva effetti principali significativi o interazioni con il tempo in MMSE, VADAS, velocità di elaborazione, o funzioni di memoria.
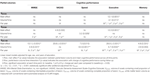
Tabella 2. Relazione tra i volumi delle lesioni parziali della materia bianca e le prestazioni cognitive nel follow-up di 3 anni.
Il VDC66 era legato a effetti principali significativi che indicavano un livello generale più povero di prestazioni nel VADAS e nelle funzioni esecutive. L’interazione tra VDC66 e il tempo era significativa solo per la velocità di elaborazione. L’ispezione dei risultati nei singoli punti temporali ha mostrato un’associazione significativa al basale (VADAS, funzioni esecutive) così come il cambiamento longitudinale al primo (VADAS, funzioni esecutive), secondo (MMSE, funzioni esecutive), e terzo (funzioni esecutive) anno di follow-up. Il controllo della VFLAIR ha avuto un effetto minimo su questi risultati (tabella 2).
Infine, il VDC100 era associato a effetti principali significativi in tutti i punteggi neuropsicologici. Le interazioni VDC100* tempo hanno indicato una relazione significativa con il cambiamento durante il follow-up in quattro delle cinque misure cognitive. In questa fase, le lesioni erano sistematicamente associate alle prestazioni cognitive già al basale. Inoltre, un declino più ripido delle prestazioni era evidente dalla prima all’ultima valutazione di follow-up con alcune variazioni nelle diverse misure cognitive. La maggior parte di questi risultati sono rimasti anche dopo il controllo aggiuntivo per VFLAIR nonostante la sua alta correlazione con VDC100 (Tabella 2).
Nonostante VDC33 e VDC66, VFLAIR è rimasto un predittore significativo sulle prestazioni complessive durante il periodo di follow-up in VADAS e funzioni esecutive. Tuttavia, VFLAIR non aveva alcun valore predittivo indipendente incrementale a quello di VDC100 su una qualsiasi delle misure cognitive.
Discussione
Questo studio ha esaminato l’impatto cognitivo longitudinale di WML parziale, dai più deboli cambiamenti nella materia bianca di aspetto normale alle lesioni completamente sviluppate. L’indagine ha utilizzato un nuovo metodo di segmentazione del tessuto MRI multispettrale auto-supervisionato basato su DC (Gonçalves et al., 2014) e valutazioni neuropsicologiche ripetute annualmente in 3 anni di follow-up. Diversi tipi di tessuto sono stati identificati utilizzando tutte le sequenze MRI disponibili simultaneamente. WML è stato poi classificato secondo i volumi parziali come piccola, intermedia e completa lesione.
A differenza della segmentazione manuale convenzionale del tessuto, dove la decisione si basa su una soglia implicita del livello di grigio, il metodo proposto dà accesso alle informazioni “sotto la soglia” per quanto riguarda le lesioni. Questo permette una migliore valutazione della progressione della lesione (informazione qualitativa), così come la volumetria sub-voxel (informazione quantitativa). Esistono altri metodi che forniscono informazioni sulle proporzioni dei tessuti (Van Leemput et al., 2003; Manjón et al., 2010). Tuttavia, essi utilizzano alcuni priori che li rendono inadatti per la rilevazione WML, come l’ipotesi che un voxel non può contenere più di due tipi di tessuto.
Il risultato principale del presente studio è stato che anche il più piccolo volume parziale WML, VDC33, è stato significativamente associato con prestazioni esecutive più poveri già al basale e previsto futuro declino delle funzioni esecutive nel corso del follow-up 3 anni. Questo effetto era indipendente dai fattori demografici e, in particolare, anche dal volume di iperintensità convenzionalmente valutato sulle immagini FLAIR. In un sottogruppo di soggetti, abbiamo inoltre dimostrato che VDC33 probabilmente rappresentano i primi cambiamenti nella materia bianca di aspetto normale, come la loro individuazione, al basale, ha indicato le posizioni future delle lesioni completamente sviluppate dopo il follow-up (Appendice I).
Le lesioni di stadio intermedio, VDC66, sono stati indipendentemente associati con più ampio declino cognitivo, compresi i cambiamenti nella velocità di elaborazione e funzioni esecutive, così come le funzioni cognitive globali. Inoltre, le lesioni complete, VDC100, erano legate a effetti ancora più pronunciati che si estendevano a tutti i domini cognitivi valutati, sia al basale che nel follow-up. Non è sorprendente che VDC100 sia un forte predittore di declino cognitivo. Poiché VDC100 era altamente correlato con VFLAIR, che ha precedentemente mostrato una forte associazione con il cambiamento cognitivo (Jokinen et al., 2011; Kooistra et al., 2014), dovrebbe tenere piuttosto simile potere predittivo.
Il risultato nuovo e più importante della presente ricerca è che il volume delle lesioni rilevate sotto la soglia di decisione già consentire la previsione di particolari punteggi cognitivi. I primi segni di declino cognitivo sono stati trovati specificamente nelle funzioni esecutive, che si presume si basino essenzialmente sull’integrità delle connessioni prefrontali-sottocorticali della materia bianca (O’sullivan et al., 2001), Le funzioni esecutive includono processi di controllo cognitivo come la flessibilità mentale, l’inibizione e la pianificazione relativa al comportamento complesso diretto all’obiettivo. Queste funzioni sono cruciali per le capacità funzionali di un individuo nella vita quotidiana (Tomaszewski Farias et al., 2009).
I risultati presentati in questo articolo supportano l’ipotesi che le iperintensità WML rappresentano solo “una punta dell’iceberg”, mentre in realtà il danno della materia bianca nella SVD si evolve come un processo graduale che colpisce aree più ampie del cervello (Schmidt et al., 2011; Maillard et al., 2013). Studi di imaging di diffusione hanno dimostrato che sottili cambiamenti microstrutturali, anche nel tessuto cerebrale dall’aspetto normale, sono correlati al deterioramento cognitivo e predicono un cattivo esito cognitivo e clinico nel follow-up (Schmidt et al., 2010; Jokinen et al., 2013). L’integrità microstrutturale è particolarmente ridotta in prossimità di WML, come dimostrato dall’anisotropia frazionale (Maillard et al., 2011). Questo fenomeno chiamato “WMH penumbra” può essere collegato ai volumi di WML parziale in fase iniziale osservati nel nostro studio. Tuttavia, i primi inizi di lesione possono anche verificarsi a una certa distanza dalla WML completamente sviluppata, come illustrato in dettaglio nell’Appendice I. A nostra conoscenza, la relazione di questi cambiamenti focali subliminali con il risultato cognitivo non è stato dimostrato prima.
Il presente campione è costituito da un gruppo misto di soggetti anziani, equamente stratificato a tutti i gradi di gravità WML, da lieve a grave. I partecipanti sono stati reclutati in ambienti diversi, sulla base di vari motivi di rinvio, che rappresentano la diversità dei pazienti con WML incontrati nella pratica clinica (LADIS Study Group, 2011). Questa eterogeneità dei soggetti può, tuttavia, oscurare gli effetti più sottili tra i risultati di imaging e declino cognitivo. Tipicamente agli studi longitudinali sull’invecchiamento e la malattia cerebrovascolare, alcuni dati sono stati persi a causa di abbandono dei soggetti dal follow-up o incapacità di completare le valutazioni intere.
Come una limitazione, il protocollo di imaging LADIS non è stato inizialmente progettato per il presente metodo di segmentazione quantitativa, quindi solo una parte dei dati di imaging originale potrebbe essere utilizzato. Inoltre, il rumore dell’immagine, la risoluzione e gli artefatti di movimento sono tutti fattori che possono influenzare il risultato di uno studio multicentrico come quello presentato qui. Questo è particolarmente vero quando si tratta di effetti parziali di volume. Nonostante queste limitazioni, e dopo aver corretto per alcuni dei fattori di confondimento di cui sopra, siamo stati in grado di rilevare indicazioni sottili di progressione della lesione, basato su voxel con una piccola probabilità di essere lesione.
Per migliorare l’affidabilità dei risultati mostrati in questo manoscritto, si sarebbe potuto prendere in considerazione un gruppo più grande. A causa delle preoccupazioni riguardanti la coerenza tra i centri, e i cambiamenti nelle impostazioni di imaging in tempi diversi, una politica più rigorosa dovrebbe essere utilizzata per quanto riguarda le sequenze di risonanza magnetica impiegate.
I punti di forza di questo studio includono un metodo di analisi delle immagini nuovo, robusto, auto-supervisionato e guidato dai dati che consente l’identificazione dei tipi di tessuto, e la quantificazione dei cambiamenti patologici del cervello, in una fase molto precoce, dove la valutazione convenzionale MRI non sarebbe utile. Lo studio beneficia anche di valutazioni neuropsicologiche dettagliate, effettuate a intervalli annuali in 3 anni di follow-up.
In conclusione, i cambiamenti precoci nella materia bianca di aspetto normale danno già un indizio di deterioramento progressivo e scarso risultato cognitivo. In questa fase, le funzioni esecutive sono principalmente colpite, ma l’effetto dannoso sulla cognizione diventa più globale quando i cambiamenti si sviluppano gradualmente in WML completo, alla fine rilevabile anche sulla segmentazione del tessuto MRI convenzionale. Questi risultati affermano il metodo di segmentazione del tessuto MRI multispettrale proposto come uno strumento promettente che ha valore aggiunto nel riconoscere il rischio di SVD e declino cognitivo progressivo clinicamente significativo.
Contributi degli autori
Tutti gli autori hanno fatto revisioni critiche del manoscritto per importanti contenuti intellettuali. Inoltre, il lavoro più centrale di ogni autore per lo studio è stato il seguente: HJ; ricercatore responsabile e autore corrispondente, progettazione e concettualizzazione dello studio, acquisizione di dati neuropsicologici e clinici, analisi statistica e interpretazione, redazione e rifinitura del manoscritto. NG; ricercatore responsabile, progettazione e concettualizzazione dello studio, sviluppo del metodo di segmentazione MRI, analisi dei dati MRI, redazione e rifinitura del manoscritto. RV; Sviluppo del metodo di segmentazione MRI, analisi dei dati MRI, progettazione e concettualizzazione dello studio. JL; Competenza nell’analisi e nell’interpretazione statistica. FF; Progettazione dello studio LADIS, responsabile dei metodi di risonanza magnetica. RS; Progettazione dello studio LADIS, responsabile dei metodi di risonanza magnetica. FB; Progettazione dello studio LADIS, responsabile dei metodi di risonanza magnetica. SM; Costruzione della batteria di test neuropsicologici, acquisizione dei dati neuropsicologici e clinici. AV; Acquisizione dei dati neuropsicologici e clinici. DI; Coordinatore dello studio, membro del comitato direttivo LADIS, progettazione dello studio LADIS. LP; Coordinamento e progettazione dello studio LADIS. TE; Membro del comitato direttivo di LADIS, progettazione dello studio LADIS, concettualizzazione dello studio e design. HJ e NG hanno contribuito in egual misura a questo lavoro.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Acknowledgments
Il Leukoaraiosis and Disability Study è stato sostenuto dall’Unione Europea (grant QLRT-2000-00446). Il lavoro di HJ è stato sostenuto da sovvenzioni del Clinical Research Institute e del Medical Research Fund dell’Helsinki University Central Hospital, e dalla Ella and Georg Ehrnrooth Foundation. NG è stato finanziato dalla sovvenzione numero SFRH/BD/36178/2007 della Fundação para a Ciência e Tecnologia.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Abbreviazioni
DC, discriminative clustering; FLAIR, fluid-attenuated inversion recovery; LADIS, Leukoaraiosis and Disability Study; MMSE, Mini-Mental State Examination; MRI, magnetic resonance imaging; SVD, small vessel disease; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale; VDC33, volume dei voxel che contengono una piccola parte della lesione; VDC66, volume dei voxel che contengono una parte intermedia della lesione; VDC100, volume dei voxel che contengono una parte completa della lesione; VDCHARD = VDC100 + VDC66; VFLAIR, volume WML misurato con l’analisi semi-automatica convenzionale su immagini FLAIR; WML, lesione della materia bianca.
Note
1. ^VFLAIR, volume WML misurato con analisi convenzionale semi-automatica su immagini FLAIR.
2. ^VDCHARD, volume corrispondente ai voxel in cui la maggior parte del tessuto è lesione.
Ashburner, J., and Friston, K. J. (2005). Segmentazione unificata. Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., e Vellido, A. (2011). Analisi semi-supervisionata del tumore cerebrale umano da informazioni MRS parzialmente etichettati utilizzando modelli di apprendimento manifold. Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). Misure generali della cognizione. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini stato mentale. un metodo pratico per classificare lo stato cognitivo dei pazienti per il clinico. J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). “Statistical parameter mapping. a practical guide,” in Neuroscience Databases, ed R. Kötter (New York, NY: Springer), 237-250. Disponibile online a: http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., e Formisano, E. (2006). Analisi dei dati del concorso di analisi delle immagini funzionali con brainvoyager QX: dal singolo soggetto all’analisi del modello lineare generale di gruppo corticamente allineato e all’analisi a componenti indipendenti di gruppo auto-organizzante. Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., e Vigário, R. (2014). Self-supervised MRI segmentazione del tessuto da discriminazione clustering. Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. Progressione di iperintensità della materia bianca e l’incidenza di nuove lacune in un periodo di 3 anni: il Leukoaraiosis e studio di disabilità. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. Lacune incidente influenzare il declino cognitivo: lo studio LADIS. Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. L’atrofia cerebrale accelera il declino cognitivo nella malattia dei piccoli vasi cerebrali: lo studio LADIS. Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. Cambiamenti di diffusione predire il risultato cognitivo e funzionale: lo studio LADIS. Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Lesioni cerebrali vascolari, atrofia cerebrale e declino cognitivo. le seconde manifestazioni della malattia arteriosa-risonanza magnetica (SMART-MR) studio. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011: un decennio dello studio LADIS (Leukoaraiosis And DISability): cosa abbiamo imparato sui cambiamenti della materia bianca e la malattia dei piccoli vasi? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., e Brody, E. M. (1969). Valutazione delle persone anziane: attività di auto-mantenimento e strumentali della vita quotidiana. Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). Segmentazione dell’immagine MR utilizzando un approccio di trasformazione della potenza. IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Mezzo secolo di ricerca sull’effetto stroop: una revisione integrativa. Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. FLAIR e diffusione segnali MRI sono predittori indipendenti di iperintensità della materia bianca. Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. Materia bianca iperintensità penombra. Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., e Robles, M. (2010). Stime migliorate di coefficienti di volume parziale da MRI cervello rumoroso utilizzando il contesto spaziale. Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. Analisi fattoriale confermativa della batteria di valutazione neuropsicologica dello studio LADIS: un’analisi longitudinale. J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., and Geerlings, M. I. (2011). Atrofia cerebrale e cognizione: interazione con patologia cerebrovascolare? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., and Markus, H. S. (2001). Prove per la “disconnessione” corticale come un meccanismo di declino cognitivo legato all’età. Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. Impatto dei cambiamenti della materia bianca cerebrale legati all’età sulla transizione alla disabilità – lo studio LADIS: logica, disegno e metodologia. Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., e Prince, J. L. (1998). Stima del volume parziale e l’algoritmo fuzzy C-means. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Microbleeds cerebrali sono associati con peggiore funzione cognitiva: lo studio di scansione di Rotterdam. Neurology 78, 326-333. doi: 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). Validità del test di trail making come indicatore di danno cerebrale organico. Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. Diffusion-weighted imaging e cognizione nel leukoariosis e disabilità nello studio degli anziani. Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. Eterogeneità nei cambiamenti della materia bianca legati all’età. Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. Progressi nell’analisi funzionale e strutturale delle immagini MR e l’attuazione come FSL. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. “3D segmentation in the clinic: a grand challenge II: MS lesion segmentation,” MIDAS Journal, MICCAI 2008 Workshop. Disponibile online all’indirizzo: http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). I cambiamenti longitudinali nella memoria e nel funzionamento esecutivo sono associati al cambiamento longitudinale nelle attività strumentali della vita quotidiana negli adulti più anziani. Clin. Neuropsychol. 23, 446-461. doi: 10.1080/13854040802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., e Suetens, P. (1999). Classificazione automatica del tessuto basata su modelli di immagini MR del cervello. IEEE Trans. Med. Imaging 18, 897-908. doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., and Suetens, P. (2001). Segmentazione automatizzata delle lesioni da sclerosi multipla tramite il rilevamento di outlier del modello. IEEE Trans. Med. Imaging 20, 677-688. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). Un quadro unificante per la segmentazione parziale del volume delle immagini RM del cervello. IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). Impatto del metodo di punteggio delle iperintensità della materia bianca sulle correlazioni con i dati clinici: lo studio LADIS. Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., e Ritter, H. (2004). Segmentazione dell’immagine biomedica completamente automatizzata mediante adattamento del modello auto-organizzato. Neural Netw. 17, 1327. doi: 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., and Smith, S. (2001). Segmentazione di immagini RM del cervello attraverso un modello di campo casuale di Markov nascosto e l’algoritmo di massimizzazione delle aspettative. IEEE Trans. Med. Imaging 20, 45-57. doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002). Analisi automatica della pipeline di dati RM 3-D per studi clinici: applicazione alla sclerosi multipla. IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar