- Introduzione
- Materiali e metodi
- Partecipanti
- Procedimenti di studio, acquisizione di dati EEG e analisi
- Risultati
- Partecipanti
- Resting State EEG
- Confronto delle densità spettrali di potenza (PSD) del canale Fp1
- Fp1 Canale EEG a riposo Confronto Test/Retest
- Discussione
- Contributi degli autori
- Finanziamento
- Dichiarazione di conflitto di interessi
- Riconoscimenti
Introduzione
I disturbi neurodegenerativi rappresentano un enorme bisogno medico globale insoddisfatto e richiedono lo sviluppo di nuove terapie che modifichino la malattia. Data la natura insidiosa di questi disturbi e l’alto costo di molti test diagnostici, c’è un bisogno significativo di biomarcatori ampiamente disponibili, affidabili e poco costosi per tracciare la progressione dei processi neurodegenerativi in tempi adatti allo sviluppo di farmaci. In questo contesto, l’EEG può avere un notevole potenziale. Anche se l’EEG è suscettibile di fattori noti dello stile di vita e dei farmaci, ha molti vantaggi considerevoli. L’EEG riflette l’attività sinaptica, che è un denominatore comune per l’impatto funzionale dei processi neurodegenerativi. L’EEG è una tecnologia non invasiva, portatile, sicura e poco costosa che è ampiamente accettata e richiede un tempo di acquisizione relativamente breve. L’EEG qualitativo è utilizzato abitualmente nella pratica clinica per la diagnosi dell’epilessia. Più recentemente, un’integrazione di un biomarcatore EEG quantitativo (qEEG) e la valutazione del clinico sono stati proposti per la valutazione del disturbo da deficit di attenzione/iperattività (ADHD) ed è stato concesso dalla FDA (Food and Drug Administration) classe II designazione per sostenere la valutazione clinica di ADHD (Lenartowicz e Loo, 2014; Snyder et al., 2015). qEEG è in fase sperimentale per l’uso come endpoint in malattie neurodegenerative in studi clinici. Tuttavia, i recenti progressi nelle analisi dei dati, interpretazione e migliore risoluzione spaziale hanno aumentato il potenziale di EEG come un biomarcatore affidabile e preciso per la progressione della malattia neurodegenerativa. Molte analisi qEEG allo stato di riposo riportate supportano il suo valore potenziale come biomarcatore per il rilevamento di firme neurali di neurodegenerazione che si verificano nella malattia di Alzheimer (Babiloni et al, 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), nella malattia di Parkinson (Sarnthein e Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) e demenza frontotemporale (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
Nel corso degli anni, anche la tecnologia hardware EEG si è evoluta e sono emersi diversi sistemi wireless multicanale che forniscono segnali EEG e fisiologici di alta qualità in un design più semplice, conveniente e confortevole rispetto ai sistemi tradizionali, ingombranti. I sistemi EEG tradizionali richiedono lunghi tempi di montaggio e di applicazione, che in genere comportano l’abrasione del cuoio capelluto del paziente. Il tempo di applicazione e il disagio rendono questi sistemi tradizionali difficili da usare nelle popolazioni affette da demenza, dove la cooperazione con lunghe procedure cliniche è spesso difficile. Tuttavia, diversi sistemi wireless attualmente disponibili possono essere applicati in 20 minuti o meno con nessun disagio durante l’applicazione e con una vestibilità confortevole durante le acquisizioni. Combinato con i progressi nel rilevamento del segnale e tecniche di analisi quantitativa, sistemi wireless sono candidati ideali per relativamente rapido, tollerabile valutazione clinica di popolazioni di demenza potenzialmente impegnativo, come la demenza frontotemporale variante comportamentale, caratterizzata da prominenti cambiamenti comportamentali e di personalità.
Più recentemente, c’è stato anche un crescente mercato per le tecnologie indossabili consumatore portando a sistemi a canale limitato disponibili per uso personale, come la meditazione e rilassamento di formazione. È ipotizzabile che questi sistemi, nonostante la loro copertura limitata, possano essere utilizzati anche in studi clinici selezionati. L’applicazione di questi sistemi di consumo nella ricerca di studi clinici non è stata tuttavia esplorata in modo estensivo e l’accuratezza e l’affidabilità di questi sistemi per misurazioni ripetute non sono state ben stabilite. Inoltre, non è chiaro se l’acquisizione a canale limitato può fornire dati sufficienti e copertura anatomica per valutare le firme neurali in pazienti affetti da malattie neurodegenerative.
Lo studio attuale è stato progettato per fornire una valutazione iniziale del potenziale dei sistemi EEG di consumo per studi clinici, confrontando la facilità d’uso, precisione e affidabilità di due grado medico, sistemi EEG wireless multicanale, B-Alert X24 e Enobio 20, con due consumatori, sistemi a canale limitato, Muse e Mindwave.
Materiali e metodi
Partecipanti
La popolazione dello studio comprendeva cinque partecipanti sani che soddisfacevano i requisiti per lo studio (Tabella 1). I soggetti sono stati esclusi se, dopo aver esaminato la loro storia medica, i farmaci concomitanti e lo stile di vita (consumo di alcol e caffeina e stato di fumatore), non sono stati considerati sani. In particolare, sono stati esclusi dallo studio se avevano una storia di epilessia, o altri disturbi del sonno, neurologici o psichiatrici o stavano assumendo farmaci o avevano uno stile di vita noto per influenzare il segnale EEG come il fumo e il consumo considerevole di alcol e caffeina.

Tabella 1. Tabella 1. Demografia della popolazione di studio e caratteristiche di base.
Il consenso informato scritto è stato ottenuto da tutti i partecipanti allo studio seguendo le linee guida per le indagini sperimentali con soggetti umani richieste dal Chesapeake Institutional Review Board.
Procedimenti di studio, acquisizione di dati EEG e analisi
Per evitare la potenziale variabilità del segnale EEG associata all’assunzione di cibo e alle variazioni circadiane, tutte le visite si sono svolte al mattino dopo una colazione standard a basso contenuto di carboidrati e proteine (per minimizzare la sonnolenza postprandiale) presso il sito di studio dei laboratori di ricerca Advanced Brain Monitoring (ABM). Inoltre, ai partecipanti è stato chiesto di evitare le bevande alcoliche la sera prima della visita di studio, nonché di digiunare ed evitare la caffeina la mattina della visita.
I dati EEG sono stati acquisiti durante due visite separate ~1 settimana di distanza da due sistemi EEG medici multicanale (20 canali), B-Alert (Advanced Brain Monitoring, ABM) e Enobio (Neuroelectrics) (Figura 1, Tabella 2) e due sistemi consumer a canale limitato, Muse (Interaxon, 2 canali) e Mindwave (Neurosky, un canale) (Figura 1, Tabella 2) nel seguente ordine: Muse, Mindwave, B-Alert, Enobio. Il sistema B-Alert X24 EEG e Enobio sono entrambi sistemi wireless a 20 canali certificati CE, applicati nel montaggio standard internazionale 10-20 e acquisiscono il segnale EEG a una frequenza di campionamento di 256 Hz. Inoltre, B-Alert è stato autorizzato dalla FDA per l’uso come dispositivo medico.
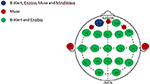
Figura 1. Distribuzione anatomica dei canali dei sistemi EEG a canali multipli e limitati. Rappresentazione dei canali condivisi e unici tra i quattro sistemi EEG valutati. Il canale comune a tutti e quattro i sistemi EEG, Fp1 (blu); canali unici al sistema Muse (rosso); canali condivisi tra i sistemi multicanale, B-Alert e Enobio (verde).

Tabella 2. Confronti di sistemi EEG.
B-Alert usa le mastoidi come canale di riferimento. Enobio può essere utilizzato con un riferimento mastoideo, un ear-clip o utilizzando altre posizioni del cuoio capelluto. Mindwave ha anche un riferimento sul labbro dell’orecchio e Muse ha tre canali di riferimento sulla fronte. Tutti i sistemi includono il controllo della qualità del segnale, tuttavia, a differenza dei sistemi EEG medici, entrambi i sistemi consumer hanno elettrodi asciutti e nessun controllo dell’impedenza.
Queste tecnologie sono state selezionate in base alla loro capacità di fornire agli utenti finali output EEG grezzi attraverso un accesso pratico e non proibitivo in termini di costi.
Dieci minuti di EEG a riposo sono stati acquisiti durante gli occhi aperti (EO) con fissazione visiva su un simbolo a croce presentato sullo schermo del computer (5 min) e mentre gli occhi chiusi (EC) per 5 min.
Siccome tutti e quattro i sistemi condividono solo il canale FP1 (Figura 1), i modelli EEG (grezzi e decontaminati), le densità spettrali di potenza (PSD) e i confronti di affidabilità test/retest tra i quattro sistemi EEG valutati nello studio sono stati eseguiti concentrandosi sull’elettrodo Fp1 in entrambe le condizioni EO e EC.
I dati EEG di ciascun sistema sono stati caricati in MATLAB (Mathworks) utilizzando funzioni personalizzate. I dati EEG registrati durante le pause e le istruzioni sono stati scartati prima dell’analisi. La densità spettrale di potenza dell’EEG per ogni epoca 1 s è stata calcolata utilizzando il metodo del periodogramma modificato di Welch con una conicità della finestra di Hamming di lunghezza 1 s. PSD sono stati calcolati su EEG a riposo durante entrambi gli occhi aperti e gli occhi chiusi periodi. Per consentire unità uguali (μV), è stato applicato un fattore di correzione di 1,25 (Muse), 0,25 (MindWave), o 1.000 (Enobio 20). Tutti i dati PSD del canale Fp1 sono stati mediati per i cinque soggetti per ogni visita. Il test-retest è stato eseguito calcolando e tracciando Vist1/Visit2.
Risultati
Partecipanti
I partecipanti erano tutti volontari sani con un’età media di 27 anni, erano tutti destri e non fumatori, e prevalentemente maschi (60%). I loro dati demografici e le caratteristiche di base sono riassunti nella tabella 1.
Resting State EEG
I dati EEG sono stati raccolti con successo da tutti e quattro i sistemi testati. Come previsto, a causa degli elettrodi asciutti e il numero limitato di canali, il tempo di configurazione è stato notevolmente inferiore per i sistemi EEG consumer. Tuttavia, non è stata osservata alcuna differenza nella tolleranza e nell’accettazione dei soggetti tra i quattro sistemi.
I modelli di dati EEG grezzi in condizioni EO (Figura 2) e EC (Figura 3) sono stati raccolti e valutati da ciascun sistema. Muse e Mindwave erano più inclini a artefatti a causa di battiti di ciglia e movimento muscolare nella regione frontale con apertura degli occhi (Figura 2).
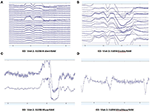
Figura 2. Estratti di dati grezzi EO da B-Alert (A) e Enobio (B) Muse (C) e MindWave (D) nello stesso partecipante durante la stessa visita.
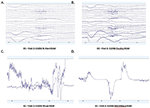
Figura 3. Estratti di dati grezzi CE da B-Alert (A) e Enobio (B) Muse (C) e MindWave (D) all’interno dello stesso partecipante durante la stessa visita.
Confronto delle densità spettrali di potenza (PSD) del canale Fp1
Sono state calcolate le PSD medie nel canale Fp1 comune a tutti e quattro i sistemi EEG per la Visita 1 e la Visita 2 e sono state tracciate per entrambe le condizioni EO (Figure 4A,B) e CE (Figure 4C,D). Nella condizione EO, gli spettri B-alert e Enobio erano approssimativamente uguali, mentre Mindwave era leggermente aumentato ma seguiva una curva simile. Un aumento di potenza a banda larga è stato osservato per i PSD acquisiti con il sistema Muse. Allo stesso modo, nella condizione EC (Figure 4C,D), B-Alert, Enobio, e Mindwave PSDs erano simili tuttavia un aumento di potenza a banda larga è stato osservato per gli spettri Muse, che sembrava anche avere una maggiore variazione rispetto agli altri sistemi. I picchi a 8-12 Hz (banda alfa) erano visibili negli spettri acquisiti con i sistemi B-Alert, Enobio e Mindwave ad ogni visita. Mentre c’era un chiaro picco alfa per gli spettri di potenza Muse alla Visita 2, nessun picco è stato osservato negli spettri della Visita 1.
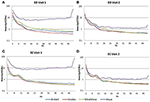
Figura 4. Densità spettrali di potenza Fp1 (PSD) da tutti e quattro i sistemi EEG nella condizione EO alla Visita 1 (A) e Visita 2 (B) e condizione EC alla Visita 1 (C) e Visita 2 (D).
Fp1 Canale EEG a riposo Confronto Test/Retest
Nella condizione EC, il rapporto spettrale di potenza era tra 0,975 e 1,025 per B-Alert, Enobio, e Mindwave (Figura 5A). I rapporti PSD del sistema Muse hanno avuto più variazione rispetto agli altri tre sistemi con rapporti tra 1,125 e 1,225. Nella condizione EO, sembrava esserci una variazione leggermente maggiore per Enobio nelle onde lente Delta (1-3 Hz), Theta (3-7 Hz) e alfa lente (8-10) e per B-Alert e Mindwave nelle onde più veloci Beta (13-30 Hz) e Gamma (25-40 Hz). Tuttavia, i rapporti erano ancora tra 0.975 e 1.05. Similmente alla condizione EC, il test/retest per Muse ha avuto una variazione maggiore, con rapporti fino a 1,2 (Figura 5B).
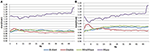
Figura 5. Rapporti test-retest per la condizione EC (A) e EO (B).
Discussione
Questo studio ha confrontato il segnale EEG quantitativo e l’affidabilità test-retest dei sistemi EEG medici e di consumo al fine di valutare la loro potenziale applicazione nella ricerca clinica e negli studi clinici. I sistemi EEG di consumo di recente diffusione sono stati valutati per il loro basso costo, l’ampia accessibilità e il potenziale per studi a domicilio in popolazioni difficili. Tra le applicazioni popolari dei sistemi EEG di consumo ci sono la meditazione e l’addestramento al rilassamento, così come la gestione dell’ansia o del dolore. Recenti indagini hanno esplorato la loro utilità oltre il gioco: NeuroSky ha dimostrato di essere in grado di rilevare l’inizio della fase 1 del sonno (Van Hal et al., 2014) e c’è stato anche interesse nella valutazione dell’EEG del consumatore all’interno di interfacce computer cervello (Bialas e Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). L’applicazione di sistemi EEG più semplici (6 canali, per esempio) è anche in fase di esplorazione per le impostazioni di emergenza (Jakab et al., 2014). Una valutazione precedente, anche se utilizzando un auricolare più complesso, ha dimostrato che i sistemi EEG di consumo multi-lead disponibili in commercio, come la cuffia a 16 elettrodi Emotiv EPOC, possono anche avere valore nella valutazione delle condizioni cliniche (Schiff et al., 2016).
Questo studio ha fornito la prova che dati EEG di qualità abbastanza buona possono essere raccolti con successo dagli EEG di consumo. Tuttavia, ci sono state distinzioni nell’aumento di potenza, test retest e forma del picco alfa osservato a 8-13 Hz. Mindwave ha mostrato spettri di potenza Fp1 complessivamente simili ai sistemi medici con un leggero aumento a banda larga rispetto a B-Alert e Enobio. Muse ha mostrato un aumento a banda larga negli spettri di potenza, che può riflettere artefatto nei dati acquisiti da un elettrodo asciutto.
I sistemi EEG consumatori hanno mostrato un set up significativamente più conveniente e veloce, che è ottimale per il loro uso previsto in applicazioni di intrattenimento e di auto-aiuto. Tuttavia, la loro qualità dei dati è stata complessivamente influenzata negativamente dalla suscettibilità agli artefatti associata all’elettrodo asciutto. Come previsto, la qualità dei dati era particolarmente diminuita durante l’EO. La mancanza di capacità di test dell’impedenza e l’applicazione alla regione frontale, che è particolarmente incline agli ammiccamenti degli occhi e al movimento muscolare con l’apertura degli occhi, hanno probabilmente contribuito a questo artefatto relativo. Inoltre, la valutazione eseguita da sistemi EEG consumatore è, per loro natura, limitata e confinata alla sola regione anatomica del cervello coperto dai pochi canali, precludendo valutazioni multi-network.
Gli elettrodi asciutti possono anche essere più inclini a provocare disagio nel tempo e presentare un rischio maggiore di posizionamento errato sulla fronte, portando a un’acquisizione del segnale e a test/retest imprecisi. Rispetto alle apparecchiature di grado medico, l’affidabilità del test/retest è risultata inferiore nei sistemi EEG di consumo. L’affidabilità è stata misurata con un’acquisizione test-retest per tutti i sistemi (Figura 5). Mentre B-Alert, Enobio e Mindwave si sono comportati ragionevolmente bene, Muse ha avuto un’affidabilità relativamente bassa. Inoltre, mentre un chiaro picco alfa è stato dimostrato per Muse sulla visita 2 (Figura 4), l’assenza di un picco alfa sulla visita 1 suggerisce una mancanza di coerenza che può essere dovuta ad artefatti. Misure coerenti e affidabili dell’attività cerebrale sono cruciali negli studi clinici per monitorare la progressione della malattia e valutare l’efficacia di una terapia sperimentale. Mentre i sistemi di consumo possono essere utili per una valutazione rapida quando il tempo è limitato, queste limitazioni di EEG consumatore potrebbe ostacolare le loro applicazioni nelle impostazioni di ricerca e studi clinici e un sistema di grado medico con alta affidabilità test-retest è raccomandato per l’uso come endpoint farmacodinamico nelle valutazioni cliniche.
In definitiva, il confronto dei sistemi EEG medico e consumatore in condizioni sperimentali evidenziato differenziazione nelle prestazioni e, in particolare, limitazioni specifiche di utilizzo che potrebbero ostacolare le applicazioni dei sistemi di consumo nelle impostazioni di ricerca e studi clinici. D’altra parte, i sistemi medici a più derivazioni sono meno ideali per scopi di intrattenimento che richiedono una rapida configurazione ed elaborazione dei dati da un numero minimo di elettrodi. La principale limitazione di questo studio risiede nelle piccole dimensioni della popolazione di studio e nella mancanza di randomizzazione dell’ordine dei sistemi utilizzati per l’acquisizione. I dati sono stati acquisiti nello stesso ordine di sistemi al fine di evitare gli effetti del tempo di acquisizione che può influenzare EEG a causa di ritmi circadiani. Tuttavia, la metrica della potenza EEG ha dimostrato di essere molto affidabile e ripetibile per gli individui quando si utilizzano sistemi EEG standard. Per questo motivo, la dimensione del campione selezionata è stata considerata informativa.
In conclusione, i dati EEG possono essere raccolti con successo da tutti e quattro i sistemi testati, compresi i sistemi EEG consumer, con diverse limitazioni sull’usabilità, qualità dei dati e affidabilità che guidano le loro applicazioni ottimali anche nelle impostazioni di sperimentazione clinica. La suscettibilità agli artefatti e la variabilità nell’affidabilità di test/retest associata agli attuali sistemi EEG di consumo suggeriscono l’uso di un sistema EEG di grado medico per robuste raccolte di dati EEG clinici trasversali e longitudinali.
Contributi degli autori
ER e AV: hanno partecipato alla concezione e al disegno del progetto, all’analisi, all’interpretazione dei dati e alla preparazione del manoscritto. SW, CB e GR: hanno partecipato all’ideazione e al disegno del progetto, alla sua esecuzione, all’analisi e all’interpretazione dei dati e alla preparazione del manoscritto. Tutti gli autori sono stati coinvolti nella stesura, scrittura e revisione del manoscritto e tutti hanno letto e approvato la versione finale del manoscritto.
Finanziamento
Questo studio è stato sostenuto da Biogen.
Dichiarazione di conflitto di interessi
ER e AV: dipendente Biogen. SW e CB: dipendente Advanced Brain Monitoring, Inc. GR: dipendente di Neuroelectrics.
Riconoscimenti
Vorremmo riconoscere i partecipanti allo studio per il loro tempo e i loro contributi a questo studio. Il team di Biogen ha partecipato al disegno dello studio, all’analisi e all’interpretazione dei dati, alla stesura del rapporto e alla decisione di presentare l’articolo per la pubblicazione.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Sorgenti corticali dei ritmi elettroencefalografici allo stato di riposo nella demenza legata alla malattia di Parkinson e nella malattia di Alzheimer. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). “Sviluppo di biomarcatori EEG per la malattia di Alzheimer”, in GTC Biomarkers Summit (San Diego, CA).
Bialas, P., e Milanowski, P. (2014). Un potenziale evocato visivamente ad alta frequenza steady-state basato sull’interfaccia del computer del cervello utilizzando le cuffie EEG di grado consumer. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). EEG quantitativo e LORETA: strumenti preziosi nel discernere FTD da AD? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., e ChiehLee, T. (2015). Potenza di frequenza e coerenza dell’elettroencefalogramma sono correlati con la gravità della malattia di Alzheimer: un’analisi multicentrica in Taiwan. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). I marcatori EEG quantitativi si riferiscono alla gravità della malattia di Alzheimer nel registro di demenza prospettico Austria (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). Picco di frequenza dominante EEG differenzia tra la malattia di Alzheimer e la degenerazione lobare frontotemporale. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Nuovo sistema di elettroencefalografia wireless con un tempo di preparazione minimo per l’uso nelle emergenze e nelle cure preospedaliere. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., e Jo, S. (2015). Valutazione quantitativa di un’interfaccia ibrida non invasiva a basso costo basata su EEG e movimento degli occhi. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). “Deep networks using auto-encoders for PD prodromal analysis”, in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Uso di EEG per diagnosticare ADHD. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., e Zanetti, O. (2011). Substrato anatomico e marcatori EEG del cuoio capelluto sono correlati in soggetti con deterioramento cognitivo e malattia di Alzheimer. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. Differenze in EEG quantitativo tra demenza frontotemporale e malattia di Alzheimer come rivelato da LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Indagine sulla connettività funzionale EEG a riposo nella degenerazione lobare frontotemporale. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., e Soria-Frisch, A. (2016). “EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients”, in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). Alta coerenza theta talamocorticale in pazienti con malattia di Parkinson. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Un sistema di registrazione elettroencefalografica a basso costo e di facile utilizzo per la valutazione dell’encefalopatia epatica. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., e Johnson, R. (2015). “A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Integrazione di un biomarcatore EEG con la valutazione ADHD di un clinico. Cervello Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). “Machine Learning per un sistema di prognosi e diagnosi di Parkinsons basato su EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017). Siamo già arrivati? Valutare l’interfaccia cervello-computer di grado commerciale per il controllo delle applicazioni informatiche da parte di individui con paralisi cerebrale. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., e Bossemeyer, R. (2014). Low-cost EEG-based rilevamento del sonno. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., e Verma, A. (2016). “Identificazione di biomarcatori neurofisiologici di MCI utilizzando stato di riposo, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar