- Background and Introduction
- Presentazione del caso
- Discussione
- Patofisiologia dell’ADI
- Ricerca della letteratura
- Cause di ADI
- Presentazione clinica dell’ADI
- Complicazioni associate all’ADI
- Approcci di gestione dell’ADI
- Conclusione
- Data Availability
- Ethics Statement
- Consenso a partecipare
- Contributi degli autori
- Finanziamento
- Conflict of Interest Statement
- Acknowledgments
Background and Introduction
Hypothalamic Adipsic Diabetes Insipidus (ADI), una sindrome rara con presentazione clinica eterogenea, è caratterizzata da una congregazione di difetti nei meccanismi omeostatici per il bilancio idrico. Questi includono l’osmoregolazione del meccanismo della sete, la secrezione di arginina vasopressina e la capacità renale di concentrare l’urina. Meno di un centinaio di casi gravi sono stati segnalati in tutto il mondo negli ultimi quattro decenni (1).
La gestione di tali pazienti è estremamente impegnativa in quanto questi pazienti tendono a soffrire di ampie oscillazioni del sodio plasmatico anche quando la DI è ben controllata (2).
Segnaliamo un caso di ADI grave che si è verificato post-operatoriamente dopo un intervento di malformazione arterovenosa cerebrale (AVM). Descriviamo la possibile patogenesi in questo caso e rivedere la letteratura per tutti i casi simili segnalati e descrivere i potenziali meccanismi coinvolti, presentazione clinica, gestione acuta e cronica e prognosi.
Presentazione del caso
Una signora di 27 anni ha presentato un’emorragia intracerebrale frontale sinistra con estensione intraventricolare secondaria a un grande complesso dei gangli della base (AVM) con alimentatori arteriosi complessi dalle arterie cerebrali medie di sinistra (MCA), e arterie cerebrali anteriori (ACA) con Spetzler Martin Grading Scale di 3 (3).
Dopo il recupero iniziale dalla craniotomia decompressiva e dall’intervento di evacuazione del coagulo, è stata sottoposta a un intervento elettivo di escissione della MAV ~2 settimane dopo. Durante l’intervento chirurgico AVM, i chirurghi segnalato sanguinamento vivace dai vasi alimentatori (il MCA, ACA, ei vasi coroideali) con grave emorragia intracerebrale e intra-ventricolare emorragia che richiedono trasfusione massiccia di sangue fino a 32 unità intraoperatoria. È stata messa in coma indotto da barbiturici e ipotensione indotta per minimizzare l’edema cerebrale (4).
Ha iniziato ad avere poliuria con grandi volumi di urina intra-operatoria subito dopo l’episodio di profusa emorragia intraoperatoria. Anche se prima dell’intervento le sue concentrazioni di sodio erano normali, le concentrazioni di sodio erano più alte immediatamente (entro la prima ora) dopo l’intervento nell’intervallo di 151-160 mmol/L in tandem con una bassa osmolalità delle urine <130 mosm/L. La DI transitoria è stata considerata e lei è stata iniziata con la desmopressina endovenosa (desmopressina IV) 1 mcg che è stata data ogni giorno insieme a 3,5-4 L di infusione salina a mezza forza per 3 giorni consecutivi.
Tuttavia, poiché ha sviluppato un edema polmonare (probabilmente una conseguenza della trasfusione massiccia di sangue intraoperatoria, dei liquidi ipotonici endovenosi e della desmopressina IV concomitante) il giorno 4 postoperatorio, la desmopressina IV è stata interrotta e sono stati somministrati plasma fresco congelato e diuretici (furosemide 40 mg endovena) per ridurre l’edema extravascolare. Nell’ora successiva, ha iniziato a sviluppare nuovamente la poliuria con una produzione di urina di 800 mL in una sola ora e le sue concentrazioni di sodio sono salite fino a 172 mmol/L. In considerazione del concomitante edema cerebrale postoperatorio, si è deciso di abbassare le concentrazioni di sodio in modo mirato, in modo che il tasso di diminuzione del sodio rimanesse entro 5-10 mmol/L/giorno, con un livello target di 155 mmol/L. Fu somministrata una bassa dose di desmopressina IV 0,25 mcg e fu suggerito un regime di titolazione per mantenere una produzione oraria di urina inferiore a 100 mL/h. Ha richiesto la desmopressina 0,75 mcg per via endovenosa il giorno 5 postoperatorio, e poi 0,25 mcg per via endovenosa due volte al giorno il giorno 6, quando ha raggiunto un livello target di 155 mmol/L. Questa concentrazione di sodio poteva essere mantenuta con il dosaggio di desmopressina per altri 2 giorni.
Il giorno 9, postoperatorio, la desmopressina è stata interrotta poiché era in grado di mantenere una bassa produzione di urina senza desmopressina, e le concentrazioni di sodio erano stabili. A questo punto, si è ritenuto che avesse sviluppato una sindrome da inappropriata secrezione di ormone antidiuretico (SIADH) e i liquidi sono stati limitati a 1 L/giorno. Le sue concentrazioni di sodio sono rimaste stabili a 134-138 mmol/L durante questa settimana.
Il giorno 14 postoperatorio, ha sviluppato nuovamente la poliuria con aumento delle concentrazioni di sodio e dell’osmolalità del siero. A questo punto la desmopressina IV è stata ripresa a 0,25 mcg due volte al giorno. Le concentrazioni di sodio potevano essere mantenute a 138-150 mmol/L con desmopressina IV (0,25 mcg due volte al giorno) e liquidi. Aveva attraversato una fase trifasica con un periodo di DI transitoria, seguita da SIADH, e successiva DI permanente (vedi Figura 1). Il cortisolo sierico, l’ormone della crescita, l’insulina come fattore di crescita-1, la funzione tiroidea e i livelli di prolattina erano tutti nella norma.

Figura 1. Grafico che mostra tutte le misurazioni seriali nella nostra paziente durante l’ospedalizzazione.
Dopo l’inserimento di uno shunt ventricoloperitoneale (fatto per mantenere la pressione intracranica) 6 settimane dopo l’asportazione della MAV, è stata trasferita in reparti di riabilitazione e il regime di desmopressina endovenosa convertito in un regime sottocutaneo (SC) (vedi Figura 1). Quando l’alimentazione tramite sondino nasogastrico è stata interrotta, abbiamo cercato di regolare i fluidi tramite la sete. Gli esami del sangue hanno mostrato un aumento dei livelli di sodio fino a 165 mmol/L e lei non ha sentito la sete durante questo periodo di ipernatriemia nonostante un’osmolalità sierica di 350 mosm/kg. È rimasta adiposa nonostante il recupero dell’afasia. Non è stata usata una scala della sete perché, interrogandola, ha verbalizzato che non sentiva affatto la sete e una scala della sete non poteva essere applicata. Quindi, i liquidi dovevano essere regolati per mantenere l’equilibrio del sodio. La sua produzione di urina era fissa e il suo equilibrio di sodio ben regolato con un regime SC di desmopressina 0,5 mcg al mattino e 0,375 mcg alla sera, con liquidi regolati di 1,5-2 L al giorno. Non ha avuto alcuna prova di disturbi termoregolatori. La cranioplastica in polietereterchetone (PEEK) è stata eseguita ~4 mesi dopo l’intervento iniziale.
Dopo 5 mesi di intensa riabilitazione multidisciplinare, aveva ancora una mano destra dominante non funzionale e significativi deficit cognitivi residui, e il dosaggio sicuro e l’autosomministrazione di desmopressina sottocutanea non era possibile a lungo termine.
Una prova di desmopressina nasale e di desmopressina orale ha mostrato un assorbimento variabile significativo che ha portato a maggiori fluttuazioni nelle concentrazioni di sodio. In seguito, abbiamo deciso di utilizzare la desmopressina sublinguale disponibile come desmopressina Melt. Dopo diverse prove di diversi regimi di dosaggio, siamo riusciti a fissare la produzione di urina a circa 2 L/giorno utilizzando desmopressina Melt liofilizzata orale 120 mcg (2 compresse) al mattino e 60 mcg (1 compressa) alla sera. Tuttavia, a questa dose aveva un’iponatriemia in certi momenti della giornata. Abbiamo eseguito un’ulteriore titolazione della dose tagliando le compresse di desmopressina usando una pinzetta/forza per sollevare le compresse dal blister e tagliare le compresse in quarti esatti (ogni 15 mcg) con l’aiuto di un tagliapillole. Con un regime di 90 mcg (1,5 compresse) al mattino e 75 mcg (1,25 compresse) la sera, siamo riusciti ad ottenere risultati simili a quelli del regime sottocutaneo. Con questo regime, e un apporto di liquidi regolato di 2 L/giorno, le sue concentrazioni di sodio sono state mantenute entro il range di 135-150 mmol/L senza grandi fluttuazioni o sintomi cognitivi. Questo dosaggio le ha anche permesso di avere una maggiore attività durante il giorno per la riabilitazione ed è stata in grado di dormire bene indisturbata dalla poliuria notturna.
Vedi la Figura 1 per le misurazioni seriali del sodio in questa paziente durante il periodo di ricovero con gli eventi sopra descritti.
In considerazione della storia clinica e del fatto che la sua ipofisi e l’ipotalamo sono per lo più intatti, è improbabile che avesse difetti significativi nella baroregolazione.
Discussione
Patofisiologia dell’ADI
In condizioni fisiologiche, il sodio plasmatico, l’osmolalità e l’equilibrio idrico sono mantenuti entro intervalli ristretti, secondari a un’attenta interazione tra sete e assunzione di acqua, secrezione di vasopressina neuroipofisaria e antidiuresi a livello dei tubuli collettori distali renali.
I segnali periferici (orofaringei, osmosensori intestinali, osmolalità del sangue) codificano in tempo reale le informazioni sullo stato attuale di idratazione e queste sono integrate a livello centrale (5). Uno stato di disidratazione porterà a segnali stimolatori all’organo subfornico (SFO) che gerarchicamente invia segnali all’organum-vasculosum della lamina terminalis (OVLT), e al nucleo preottico mediano (MnPO) (6). Il MnPO, che può servire da “rivelatore centrale”, invia segnali stimolatori ai nuclei ipotalamici per aumentare il rilascio di vasopressina e invia anche un segnale di sete aumentato attraverso l’OFS e l’OVLT (7, 8). Le vie neurali legate alla sete che collegano l’OFS e l’OVLT alla corteccia cingolata e insulare portano alla percezione cosciente della sete (7, 8). Al contrario, nello stato di adeguata idratazione, i segnali provenienti dai sensori periferici, portano a un’inibizione di queste aree, e a un feedback negativo dal MnPO che porta alla soppressione della sete e a una minore secrezione e rilascio di vasopressina (circuito rosso). In effetti, i neuroni nel MnPO, OVLT, e SFO sono ampiamente e reciprocamente interconnessi in quanto l’attivazione optogenetica e chemiogenetica dei neuroni in una qualsiasi di queste aree può stimolare la sete (9). Quindi, l’interruzione dell’apporto di sangue con conseguente danno cellulare porterà all’adipsia. Sono stati pubblicati anche casi di ADI dovuti all’autoimmunità delle cellule neuronali dell’OFS e dell’OVLT che indicano l’importanza funzionale di questi sensori neuronali nel controllo della sete (10).
I neuroni AVP mostrano un’attività “fasica” dei potenziali d’azione con intervalli in cui l’AVP viene rilasciato ai terminali dell’assone. Il rilascio di vasopressina è regolato dagli input osmosensoriali dal MnPO, attraverso i barocettori e c’è anche una regolazione anticipatoria dove il rilascio di vasopressina è stimolato prima dei pasti (prandiale), sull’ipertermia e in un modello circadiano (11). C’è un modello circadiano giornaliero di secrezione di vasopressina nella circolazione con un aumento dei livelli tra le 24:00 e le 02:00 h e i livelli cadono progressivamente durante il giorno con il nadir tra le 16:00 e le 20:00 h (12). Questo aumento circadiano di mezzanotte causato da un aumento del rilascio di vasopressina deriva in parte da una maggiore eccitazione sinaptica dei neuroni neurosecretori magnocellulari del nucleo soprachiasmatico che è noto per regolare il ritmo circadiano (11). Nell’ADI la regolazione osmotica della secrezione di vasopressina è più colpita e altri effetti possono essere variabili a seconda del sito e dell’estensione della lesione, mentre la risposta dei barocettori è nota per essere conservata in molti pazienti con lesioni limitate, come dimostrato in uno studio (13).
AVP agisce sui dotti collettori renali attraverso i recettori della vasopressina-2 (V2) per aumentare la permeabilità all’acqua che porta alla diminuzione della formazione di urina. Il riassorbimento dell’acqua è controllato attraverso la regolazione del canale dell’acqua, aquaporin-2 (AQP2). L’AVP induce, a breve termine, la traslocazione intracellulare di vescicole contenenti AQP2 verso la membrana plasmatica apicale, regolando così il traffico di AQP2. A lungo termine con adeguate concentrazioni di AVP, regola la trascrizione del gene AQP2 per aumentare l’abbondanza della proteina AQP2 nel dotto collettore (14). Nell’ADI, postuliamo che è probabile che la risposta osmotica acuta sia influenzata più della risposta cronica. Quindi ci sarà un’abbondanza relativa di acquaporina ma il traffico acuto verso la membrana apicale sarà influenzato.
Vedi la Figura 2 per un’illustrazione dettagliata dei meccanismi.
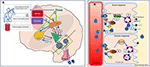
Figura 2. Rappresentazione schematica della regolazione dell’equilibrio dei fluidi nell’uomo. (A) Il controllo e la regolazione della secrezione di vasopressina nel cervello. (A) I segnali periferici (orofaringei, osmosensori intestinali, osmolalità del sangue) codificano informazioni sullo stato attuale di idratazione in tempo reale (1) e integrate a livello centrale (2). Uno stato di disidratazione porta segnali stimolatori all’OFS che gerarchicamente invia segnali all’OVLT e al MnPO (3). Il MnPO, che può servire da “rivelatore centrale”, invia segnali stimolatori ai nuclei ipotalamici per aumentare il rilascio di vasopressina (4), e invia anche un segnale di sete aumentato attraverso l’OFS e l’OVLT (5, circuito blu nel diagramma). Al contrario, nello stato di adeguata idratazione segnali dai sensori periferici, vi è una inibizione di queste aree e feedback negativo da MnPO che porta alla soppressione della sete e minore secrezione e rilascio di vasopressina (circuito rosso 6). Le vie neurali legate alla sete che collegano l’OFS e l’OVLT alla corteccia cingolata e insulare portano alla percezione cosciente della sete (7). Nella DI adipsica, in assenza di stimoli osmosensoriali i circuiti neurali associati a causa del danno cellulare, il rilascio stimolatorio o l’inibizione della vasopressina e la percezione cosciente della sete sono entrambi interrotti. (B) Il meccanismo d’azione della vasopressina sui tubuli collettori renali. (B) La vasopressina nella circolazione sanguigna si attacca al recettore 2 della vasopressina sulla superficie luminale delle cellule principali del tubulo collettore distale nei reni (1). Nella fase acuta, tramite la sintesi di cAMP dall’ATP attraverso l’AC (adenilato ciclasi) forma la protein chinasi A (2) che stimola la traslocazione dell’acquaporina dalla vescicola di stoccaggio alla membrana apicale e alla superficie luminale del sangue (3). Questo fa sì che l’acqua venga trasportata nella cellula (4) e successivamente assorbita nella circolazione (5). Nella fase cronica, attraverso il controllo trascrizionale mediato da cAMP del gene dell’aquaporina (6), si possono trovare nelle cellule principali livelli aumentati del canale dell’acqua aquaporina (7). Nella DI adipsica, è probabile che la risposta acuta sia più colpita di quella cronica, in quanto la secrezione di vasopressina legata all’osmosi è colpita.
Ricerca della letteratura
Abbiamo eseguito una ricerca sistematica della letteratura tra cui Pubmed, Scopus ed Embase per casi riportati come case report o serie di casi di DI dal 1980 al 2018. Abbiamo usato il termine di ricerca: Adipsia, Adipsic disorder, e Adipsic DI e abbiamo limitato la ricerca alla lingua inglese e a Humans. Abbiamo anche cercato qualsiasi altro riferimento identificato durante la lettura di ogni rapporto/serie di casi. Abbiamo trovato 25 riferimenti (10, 13, 15-39) con un totale di 45 casi riportati in letteratura. Abbiamo riassunto tutti i casi riportati nella tabella 1.
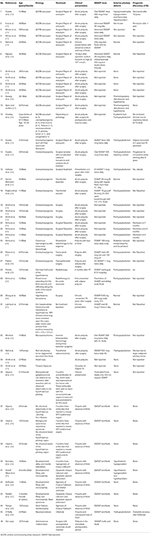
Tabella 1. Demografia, eziologia, presentazione clinica, gestione e prognosi dei pazienti con diabete insipido adiposo riportati in letteratura.
Cause di ADI
Il 40% (17/46) dei casi di ADI descritti in letteratura si sono verificati secondari alla rottura dell’arteria comunicante anteriore (ACOM) e al clipping post-chirurgico con un approccio di craniectomia frontale. In un caso è stata descritta la doppia patologia di craniofaringioma e aneurisma ACOM (15). Il rifornimento arterioso dell’OVLT è stato descritto come proveniente da quattro fonti (40): (1) una fonte mediana superiore che si dirama dall’arteria comunicante anteriore, (2) e (3) due fonti laterali provenienti da arterie che si diramano da ciascuna arteria cerebrale anteriore sotto l’arteria comunicante anteriore, e (4) una fonte mediana inferiore che sale da sotto il chiasma ottico. Caratteristicamente i capillari che rivestono questo organo si trovano al di fuori della barriera emato-encefalica e quindi un cambiamento di osmolalità può essere facilmente percepito da questi organi (41). Va notato che i miglioramenti nelle tecniche chirurgiche e l’uso di coiling invece di clipping può ridurre queste complicazioni. Per i pazienti in buone condizioni cliniche con aneurismi rotti della circolazione anteriore che sono adatti per coiling, i dati di una meta-analisi mostrano che coiling è associato con un risultato migliore (42). Rispetto al clipping in cui entrambe le estremità dell’ACA sono tagliate con interruzione dell’apporto di sangue all’ipotalamo, la procedura di inserimento di una bobina nell’aneurisma è in grado di preservare le alimentazioni all’ipotalamo nella maggior parte dei casi.
La seconda causa di ADI è stata descritta come craniofaringioma soprasellare (17/46). Questi casi spesso comportano un’escissione trans-frontale e il recupero dopo l’intervento è stato descritto in alcuni casi. È stato descritto anche un caso di emangioma cavernoso con manifestazione simile dopo un episodio di sanguinamento (26).
I tumori ipotalamici che comprendono l’amartoma, il tumore della ghiandola pineale e il tumore a cellule germinali possono presentare un ADI (26, 29, 30). È stato riportato un caso di carcinoma epatocellulare con metastasi all’ipotalamo e conseguente ADI (31).
Interessante che siano stati descritti solo due casi di tumori pituitari con ADI (18, 32). Entrambi questi casi avevano un tumore aggressivo con resezione trans-frontale multipla ed emorragia intracranica intra-operatoria. Un caso ciascuno è stato descritto in relazione al trauma cranico e all’esposizione al toluene (13).
Quattro casi sono stati descritti con presentazione acuta improvvisa di poliuria e ipernatremia. Questi pazienti non avevano alcuna anomalia strutturale nell’ipotalamo e indagini dettagliate hanno rivelato prove di anticorpi contro gli organi OVLT. Questi casi sono stati postulati per avere una patologia autoimmune sottostante (10, 33).
Sono stati descritti anche casi congeniali o della prima infanzia in pazienti con problemi di sviluppo del corpo calloso con manifestazione di ADI (34-38). È stato descritto anche un caso di neurosarcoidosi che colpisce estesamente l’ipofisi anteriore, l’ipofisi posteriore e l’ipotalamo con ADI (39).
Presentazione clinica dell’ADI
La presentazione clinica nella maggior parte dei casi descritti è la poliuria nella settimana immediata dopo il taglio chirurgico per AVM o dopo la craniotomia. La presentazione biochimica è ipernatremia con aumento dell’osmolalità del siero in presenza di urine inappropriatamente diluite in grandi volumi. Se la sensazione di sete viene valutata utilizzando una scala della sete, questi pazienti ADI riferiscono una sete bassa o minima nonostante l’ipernatremia. È interessante notare che questi pazienti hanno una risposta normale all’ipotensione e il loro meccanismo barorecettore è intatto (13).
Il nostro paziente è passato attraverso una fase trifasica di DI iniziale, seguita da SIADH e poi DI permanente. Questo modello descritto come risposta trifasica è stato descritto dopo interventi chirurgici all’ipofisi e al craniofaringioma. La fisiopatologia della risposta trifasica sembra essere spiegata da una disfunzione ipotalamica precoce (caratterizzata da poliuria e ipernatremia), dal successivo rilascio di vasopressina preformata dalle vescicole di stoccaggio nell’ipofisi posteriore (non legata ad alcuno stimolo) (caratterizzata da SIADH) e, infine, dall’esaurimento delle riserve di vasopressina (DI permanente) (43). Nel nostro paziente, è probabile che nella terza fase, la carenza nella risposta all’osmolalità nel rilascio di vasopressina sia smascherata dopo la risoluzione della SIADH, piuttosto che una deplezione assoluta di vasopressina.
Complicazioni associate all’ADI
Poche casistiche hanno descritto disturbi termoregolatori. Il panipopituitarismo è stato riportato solo in casi di craniofaringioma e in casi di tumore ipofisario e non era presente nel nostro paziente.
Anche se non costantemente riportato, altre complicazioni importanti dell’ipernatremia includono la trombosi venosa profonda; quindi l’eparina a basso peso molecolare può essere indicata durante la malattia acuta e l’immobilizzazione (18).
Anche l’obesità ipotalamica e l’apnea notturna sono state comunemente riportate (18). In una serie di casi (13), in cui hanno valutato la risposta AVP all’ipotensione, hanno trovato che i pazienti con craniofaringiomi avevano anche una perdita di risposta AVP regolata dal baro. Questi pazienti avevano prove di panipopituitarismo, indicando che l’intervento chirurgico ai loro tumori aveva lasciato danni più diffusi all’ipofisi, compresa l’ipofisi posteriore che è la via finale comune per la secrezione di AVP.
Approcci di gestione dell’ADI
La gestione di questi casi è stata descritta (15, 18). L’educazione del paziente e della famiglia sui principi dell’equilibrio idrico e della gestione è fondamentale. L’assunzione di acqua può essere fissata a 1,5-2 L al giorno e poi la titolazione della desmopressina eseguita. Il monitoraggio quotidiano del peso è utile per rilevare la disidratazione o il sovraccarico di liquidi. Si raccomanda di fare settimanalmente le concentrazioni di sodio nel plasma per monitorare le fluttuazioni. Nonostante il monitoraggio rigoroso, è difficile riprodurre un controllo continuo delle concentrazioni plasmatiche di sodio che imiti l’osmoregolazione fisiologica. In considerazione del rischio di rapide oscillazioni delle concentrazioni di sodio e dei sintomi di iponatriemia osservati al basso intervallo di riferimento, è consigliabile mantenere le concentrazioni di sodio entro l’intervallo di riferimento più alto.
La desmopressina, analogo sintetico dell’AVP, è stata introdotta per la prima volta nel 1972 per il trattamento della DI (44). La maggior parte dei pazienti sta bene con basse dosi di desmopressina somministrate due volte al giorno. C’è un sottile equilibrio e i livelli di sodio possono oscillare a livelli molto bassi con minime variazioni di dose.
Il nostro paziente ha fatto molto bene con dosi molto basse di somministrazioni parenterali che è noto per avere la più bassa variabilità nella biodisponibilità (45). L’assorbimento delle formulazioni intranasali è molto variabile, soprattutto nei bambini o negli adulti con problemi cognitivi, perché potrebbero non inalare la soluzione in modo coerente (46, 47). Le formulazioni orali sono una buona opzione in quanto l’aumento della dose porta a una durata d’azione più lunga, ma non ha un effetto di picco (48-50). Abbiamo provato questa forma in dosi variabili di 50-100 mcg, ma abbiamo trovato variazioni significative da giorno a giorno negli effetti con questa formulazione. La desmopressina sublinguale (Minirin Melt) è disponibile dal 2005. Gli studi farmacologici hanno dimostrato che la via sublinguale porta a una biodisponibilità più alta di ~60% rispetto alla via orale (49, 50). Dosi raffinate di desmopressina sublinguale potrebbero essere ottenute tagliando ogni compressa da 60 mcg, permettendo aggiustamenti della dose da 65 a 90 mcg sublinguale. È stato descritto un profilo farmacocinetico simile di tali compresse divise (51). L’assunzione concomitante di cibo è noto per diminuire il tasso e la portata dell’assorbimento del 40%, quindi, è meglio evitare qualsiasi consumo di cibo entro un’ora prima e dopo la somministrazione delle compresse sublinguali desmopressina. Recentemente è stato descritto un dettagliato protocollo di somministrazione di fluidi con monitoraggio giornaliero del sodio con desmopressina sottocutanea a dose fissa (28) che dimostra la difficoltà del monitoraggio giornaliero. Un altro recente case report (27) ha anche riportato l’uso della forma di desmopressina sublinguale per l’ADI alla dose di 60 e 120 mcg al giorno. L’uso della desmopressina sublinguale può essere un’alternativa utile nei casi in cui gli effetti ottimali non possono essere raggiunti con altre formulazioni. Questi pazienti richiedono uno stretto monitoraggio del peso giornaliero, del volume delle urine e dell’assunzione di liquidi 24 ore su 24. In considerazione dei difetti cognitivi e di memoria, questi pazienti tendono ad avere, di solito hanno bisogno di un caregiver per monitorare l’assunzione di liquidi per garantire che stanno bevendo il volume richiesto.
Nella nostra revisione dei casi, 6 pazienti hanno avuto una remissione di ADI di cui 2 erano legati all’aneurisma ACOM (15, 16) e 4 erano legati al craniofaringioma (15, 26). Un paziente con neurosarcoidosi ha avuto una remissione con la terapia Infliximab (39). Tali osservazioni possono suggerire che sia gli osmorecettori che regolano la sete che le loro vie efferenti dimostrano più neuroplasticità di quelli che regolano la produzione di AVP (26).
Conclusione
L’ADI è una complicazione estremamente rara dei disturbi ipotalamici che risulta in una perdita di funzione del centro della sete. A causa del controllo gerarchico del centro della sete, l’assenza di sete è anche associata alla perdita di regolazione della vasopressina e alla poliuria. I soggetti che soffrono di ADI devono essere gestiti delicatamente con basse dosi di desmopressina e bilanciamento dei fluidi. Con l’attuale monitoraggio e gli approcci di cura personalizzati, non è ancora possibile imitare l’osmoregolazione quasi fisiologica round the clock.
Data Availability
Tutti i set di dati generati per questo studio sono inclusi nel manoscritto/file supplementari.
Ethics Statement
Il consenso informato scritto è stato ottenuto dalla/e persona/e per la pubblicazione di qualsiasi immagine o dato potenzialmente identificabile incluso in questo articolo.
Consenso a partecipare
Abbiamo ottenuto il permesso scritto dal parente più prossimo del paziente per scrivere e pubblicare questo manoscritto.
Contributi degli autori
RD è stato il primo endocrinologo che ha gestito il bilancio dei fluidi del paziente, ha concettualizzato l’idea, ha scritto il manoscritto, ha fatto la revisione della letteratura, ha acquisito i dati, ha scritto e rivisto il manoscritto finale. HC, AC e JH erano specializzandi coinvolti nella gestione di questo paziente e hanno rivisto il manoscritto finale. HT era l’anestesista responsabile di questo paziente durante la fase di terapia intensiva, ha concettualizzato l’idea e ha valutato criticamente il manoscritto finale. KC era il principale specialista in riabilitazione responsabile del paziente, ha concettualizzato l’idea e ha valutato criticamente il manoscritto finale. BB ha concettualizzato l’idea e ha valutato criticamente il manoscritto finale.
Finanziamento
RD è stato sostenuto in parte dal Center Grant del National Medical Research Council (NMRC/CG/017/2013) e dal National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Acknowledgments
Ringraziamo la paziente e i suoi genitori per averci permesso di scrivere e pubblicare questo manoscritto.
1. Eisenberg Y, Frohman LA. Adipsic diabete insipido: una revisione. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Anomalie di regolazione della sete. Rene Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Un sistema di classificazione proposto per le malformazioni arterovenose. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. L’uso del coma indotto da barbiturici durante le procedure di neurochirurgia cerebrovascolare: una revisione della letteratura. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. Un segnale gut-to-brain di osmolarità fluido controlla la sete. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Agostino V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Architettura neurale gerarchica sottostante la regolazione della sete. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regolazione della sete e il rilascio di vasopressina. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Dagli organi sensoriali circumventricolari alla corteccia cerebrale: percorsi neurali che controllano la sete e la fame. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Il nucleo preottico mediano: davanti e al centro per la regolazione del fluido corporeo, sodio, temperatura, sonno e omeostasi cardiovascolare. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunità al sensore di livello di sodio nel cervello causa ipernatremia essenziale. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregolazione della secrezione di vasopressina e sete in salute e malattia. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. La base neurale della sete omeostatica e anticipatoria. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregolazione del rilascio di vasopressina nel diabete insipido adipsico. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Meccanismi molecolari che regolano aquaporin-2 nel condotto di raccolta del rene. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Modelli eterogenei di recupero della sete in pazienti adulti con diabete insipido adipsico. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renal adattamento compensatorio per la gestione dell’acqua in un paziente con diabete insipido adipsico dopo clipping di un aneurisma rotto dell’arteria comunicante anteriore. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus dopo clipping of anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Sindrome adipsica ipotalamica: diagnosi e gestione. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Ipernatremia ipodipsica e diabete insipido dopo il clipping dell’aneurisma dell’arteria comunicante anteriore: sfide diagnostiche e terapeutiche nel paziente amnestico in riabilitazione. Lesioni cerebrali. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Ipernatremia cronica e ipotermia dopo l’emorragia subaracnoidea. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia e ipotermia dopo l’emorragia subaracnoidea. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Approfondimenti clinici nel diabete insipido adipsico: una grande serie di casi. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Obesità ipotalamica complicata da diabete insipido centrale adipsico dopo resezione chirurgica di un craniofaringioma. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Grave rabdomiolisi dovuta a ipernatremia adipsica dopo un intervento chirurgico di craniofaringioma. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. Da spreco di sale cerebrale al diabete insipido con adipsia: case report di un bambino con craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Valutazione obiettiva del recupero della sete in pazienti con diabete insipido adipsico. Pituitario. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Diabete insipido adiposo secondario alla resezione del craniofaringioma. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Protocollo di monitoraggio quotidiano del sodio e assunzione di liquidi: prevenire l’ospedalizzazione ricorrente nel diabete insipido adipico. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia in un paziente con diabete insipido. Caso Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Gotta a insorgenza giovanile e diabete insipido adipico: un case report e una revisione della letteratura. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Grave iperosmolarità e ipernatremia in una giovane donna adipsica. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Insipido diabete adiposo dopo la chirurgia ipofisaria per un macroprolattinoma. Pituitaria. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia senza lesioni ipotalamiche accompagnato da autoanticorpi per organo subfornico. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Ipoplasia del corpo calloso associato con ipernatremia adipsica e ipogonadotropinismo ipotalamico: un case report e revisione della letteratura. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Ipernatremia cronica da un difetto congenito nell’osmoregolazione della sete e della vasopressina. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Ipernatremia essenziale, ormone antidiuretico e secrezione di neuroipofisina: risposta alla clorpropamide. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Ipernatremia adipica in due sorelle. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Un caso di ipernatremia cronica con agenesia del corpo calloso. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Remissione radiologica e recupero dell’apprezzamento della sete dopo la terapia con infliximab nel diabete insipido adipico secondario a neurosarcoidosi. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Gli organi circumventricolari: un atlante di anatomia comparata e vascolarizzazione. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Coiling endovascolare contro clipping neurochirurgico per persone con emorragia subaracnoidea aneurismatica. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Disturbi dell’equilibrio idrico dopo la neurochirurgia: la risposta trifasica rivisitata. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effetti di DDAVP, un analogo sintetico della vasopressina, in pazienti con diabete insipido craniale. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmacocinetica e farmacodinamica della desmopressina somministrata per via orale o endovenosa di giorno o di notte in uomini sani di 55-70 anni. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressina 30 anni in uso clinico: una revisione della sicurezza. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Trattamento del diabete insipido neuroipofisario. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmacocinetica di 1-deamino-8-D-arginina vasopressina dopo varie vie di somministrazione in volontari di salute. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmacocinetica, farmacodinamica, efficacia a lungo termine e sicurezza della vasopressina orale 1-deamino-8-D-arginina in pazienti adulti con diabete insipido centrale. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Farmacocinetica plasmatica di desmopressina dopo la somministrazione sublinguale: uno studio esplorativo di dose-escalation in volontari maschi sani. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressina liofilizzata per il trattamento del diabete insipido centrale: prima esperienza in bambini molto piccoli. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar