- Introduzione
- Materiali e metodi
- Criteri di inclusione
- Stimolazione ovarica e recupero degli ovociti
- Politica di trasferimento embrionale
- Misurazioni dell’esito primario e analisi statistica
- Risultati
- Parametri di ovociti ed embrioni
- Esiti di gravidanza e tasso cumulativo di nati vivi (CLBR)
- Discussione
- Conclusione
- Disponibilità dei dati
- Dichiarazione etica
- Contributi degli autori
- Finanziamento
- Dichiarazione di conflitto di interessi
- Riconoscimenti
Introduzione
Di recente è stato sviluppato un nuovo sistema, i criteri POSEIDON, per classificare i pazienti con infertilità a bassa prognosi sottoposti a trattamento con tecnologia riproduttiva assistita (ART) (1). Si tratta di un sistema utile per l’identificazione e la classificazione delle pazienti con riserva ovarica compromessa o scarsa risposta ovarica (POR), fornendo una guida per la diagnosi e la gestione di queste pazienti (2). Sono stati suggeriti quattro sottoinsiemi basati su parametri quantitativi e qualitativi tra cui l’età, i biomarcatori della riserva ovarica e la risposta ovarica. I nuovi criteri, introducendo una stratificazione più dettagliata della POR, hanno ridotto significativamente l’eterogeneità delle pazienti che soddisfano i criteri di Bologna (3), il che potrebbe differenziare sottogruppi di pazienti all’interno della popolazione POR che potrebbero essere identificati e beneficiare di interventi specifici (4). Anche se i criteri POSEIDON sono stati stabiliti, insieme ad alcune raccomandazioni specifiche di trattamento proposte per i sottogruppi specifici di pazienti (5), non ci sono ancora prove sufficienti per sostenere la validità dei parametri utilizzati nei criteri POSEIDON, così come la valutazione del risultato dei diversi sottogruppi.
Tra i quattro gruppi basati sui criteri POSEIDON, il gruppo 1 è senza dubbio il miglior gruppo prognostico considerando la loro giovane età e la riserva ovarica normale, mentre il gruppo 4 ha la prognosi peggiore a causa dell’età avanzata e della riserva ovarica diminuita. Tuttavia, una domanda interessante è chi otterrebbe migliori risultati di gravidanza, le donne più anziane (gruppo 2) con riserva ovarica normale o le giovani donne (gruppo 3) con riserva ovarica diminuita. Il tasso cumulativo di nati vivi (CLBR) è considerato una misura preferibile del successo del trattamento FIVET (6). Fino ad ora, ci sono stati pochissimi rapporti sui CLBR dei quattro gruppi di pazienti definiti dai criteri POSEIDON.
Le caratteristiche e la prognosi delle pazienti dovrebbero essere utilizzate per sviluppare strategie di gestione clinica. L’obiettivo di questo studio è quello di caratterizzare i pazienti a bassa prognosi al fine di facilitare il processo decisionale del trattamento. In questo studio, sono state analizzate le caratteristiche di base e gli esiti dei gruppi di pazienti definiti dai criteri POSEIDON, e la CLBR risultante da un ciclo di fecondazione in vitro aspirata (IVF)/iniezione intracitoplasmatica di spermatozoi (ICSI) è stata proposta come la misura dell’esito primario per i pazienti a bassa prognosi sottoposti a trattamento IVF (7).
Materiali e metodi
Questo studio retrospettivo ha incluso 18.455 cicli di FIVET aspirati freschi con successivi trasferimenti di embrioni congelati da gennaio 2014 a gennaio 2017 nel nostro centro. L’esito del parto vivo è stato seguito per almeno 2 anni fino a gennaio 2019. Lo studio è stato approvato dal comitato etico per l’applicazione clinica della tecnologia riproduttiva umana assistita dell’ospedale delle donne e dei bambini del nord-ovest (n. 2018002). Il comitato etico ha approvato questo studio rinunciando alla necessità di ottenere il consenso informato. Tutte le ricerche sono state eseguite in conformità con le linee guida e i regolamenti pertinenti.
Criteri di inclusione
I pazienti sono stati classificati secondo i criteri POSEIDON:
Pazienti a bassa prognosi
Gruppo 1 (n = 879 cicli): Età < 35, conta dei follicoli antrali (AFC) ≥ 5, numero di ovociti recuperati ≤ 9 nel ciclo precedente;
Gruppo 2 (n = 482 cicli): Età ≥ 35, AFC≥ 5, numero precedente di ovociti recuperati ≤ 9 nel ciclo precedente;
Gruppo 3 (n = 858 cicli): Età < 35, AFC < 5;
Gruppo 4 (n = 1.306 cicli): Età ≥ 35, AFC < 5;
Pazienti non a bassa prognosi
Gruppo 5 (n = 664 cicli): AFC ≥ 5, precedente stimolazione ovarica > 9 ovociti;
Gruppo 6 (n = 13708 cicli): AFC ≥ 5, nessuna stimolazione ovarica precedente.
Il diagramma di flusso e la procedura di elaborazione dei dati sono elencati nella Figura 1. I dati demografici e le caratteristiche basali dei pazienti sono presentati nella tabella 1.
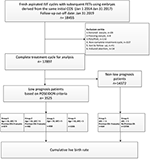
Figura 1. Diagramma di flusso ed elaborazione dei dati.
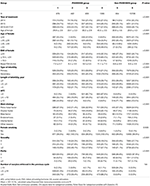
Tabella 1.
Stimolazione ovarica e recupero degli ovociti
Il protocollo per la stimolazione ovarica (OS) è stato determinato individualmente secondo l’età femminile, l’indice di massa corporea (BMI), l’ormone follicolo stimolante (FSH) basale e la conta dei follicoli antrali (AFC). Il 94,33% delle pazienti sottoposte a FIVET ha ricevuto gonadotropine ricombinanti e/o urinarie (rFSH/hMG) nel protocollo GnRH agonista o GnRH antagonista seguito da FIVET o ICSI. Per le donne con riserva ovarica diminuita, è stato utilizzato il protocollo di stimolazione lieve o la stimolazione ovarica in fase luteale o il ciclo naturale. La gonadotropina menopausale umana (hMG, Li Zhu, Cina) è stata aggiunta nel protocollo di ovulazione leggera o nel protocollo di Shanghai secondo la risposta delle pazienti alla stimolazione. La gonadotropina corionica umana (hCG) 4.000-10.000 UI o hCG ricombinante (r-hCG, MerckSerono S.p.A.) 250μg è stata somministrata quando 2-3 follicoli hanno raggiunto la dimensione di 17 mm o superiore. Trentasei ore dopo, il recupero degli ovociti è stato eseguito utilizzando l’aspirazione transvaginale guidata dall’ecografia. I parametri di stimolazione ovarica di ogni gruppo sono elencati nella tabella 2.

Tabella 2. Parametri di stimolazione ovarica.
Politica di trasferimento embrionale
Il trattamento degli ovociti e le procedure di sviluppo embrionale così come il sistema di punteggio embrionale sono stati descritti nei nostri articoli precedenti (8, 9). Gli embrioni di grado 1-3 al giorno 3 sono stati considerati embrioni utilizzabili, e gli embrioni di grado 1-2 sono stati considerati embrioni di buona qualità. Tutti i trasferimenti di embrioni freschi (ET) sono stati effettuati il giorno 3 o il giorno 5. Nei casi con un numero sufficiente (≥ 3-4) di embrioni di buona qualità il giorno 3, il trasferimento di blastocisti il giorno 5 sarebbe stato praticato. Oltre agli embrioni trasferiti, gli embrioni extra dei pazienti sono stati vetrificati il giorno 3 o allo stadio di blastocisti (giorno 5-6). Gli embrioni allo stadio di clivaggio di grado 1-3 il giorno 3 e le blastocisti con punteggio Gardner superiore a 4CC sono stati crioconservati (Cryo-top, sistema aperto, Kuwayama). I metodi e la procedura Frozen ET sono dettagliati nel precedente studio di verifica del nostro team (8, 9). Se l’impianto è fallito nel ciclo a fresco, il trasferimento di embrioni congelati (FET) sarebbe stato effettuato utilizzando gli embrioni vitrificati rimanenti o le blastocisti. I pazienti sotto i 35 anni con embrioni di buona qualità sono stati incoraggiati a ricevere un trasferimento di un singolo embrione. Una politica di trasferimento di un solo embrione è stata applicata anche per le pazienti che hanno l’utero anormale (ad esempio, utero cicatrizzato, malformazione uterina) e / o altri casi in conflitto con la gravidanza gemellare. L’iniezione intramuscolare di progesterone (60 mg/die) è stata somministrata per il supporto della fase luteale dal giorno del prelievo degli ovociti fino a una beta-hCG sierica negativa o fino a 8 settimane di gravidanza.
Misurazioni dell’esito primario e analisi statistica
L’esito primario era il parto vivo cumulativo (CLB) definito come almeno un parto vivo risultante da un ciclo ART aspirato nell’ET fresco o nella successiva FET in relazione al numero di ovociti prelevati. Il numeratore del calcolo del CLBR era la somma dei nati vivi ottenuti nelle FET e dei nati vivi nei cicli a fresco. Solo il primo parto è stato contato nell’analisi se una paziente ha ottenuto più parti. Il CLBR è stato definito il parto vivo cumulativo per aspirazione transvaginale di ovociti secondo la definizione terminologica (7, 10) Un ciclo di trattamento è stato definito come un prelievo di ovociti. Un ciclo di trattamento completo si riferiva a un ciclo di trattamento che ha raggiunto il parto vivo o un ciclo di trattamento che non ha raggiunto il parto vivo con tutti gli embrioni trasferiti. Il tasso cumulativo di nati vivi in questo studio è stato calcolato sulla base del ciclo di trattamento completo, quindi i pazienti (n = 337) di trattamento non completo sono stati esclusi.
L’elaborazione dei dati e l’analisi statistica sono state effettuate utilizzando il software EmpowerStats (www.empowerstats.com) e i pacchetti software statistici R. Per valutare l’odds ratio (OR) di CLBR in diversi gruppi di pazienti, è stato stabilito un modello di regressione a variabili multiple con potenziali fattori di confondimento come variabili e aggiustato per l’anno di trattamento, BMI femminile, tipo di infertilità, durata dell’infertilità, gravidità, parità, eziologia principale, protocollo OS, tipo di gonadotropina e dose iniziale di FSH. I pazienti sono stati arruolati per 3 anni, durante i quali la procedura di FIVET è stata rivista. Per eliminare i bias causati da questo fattore, il tasso cumulativo di nati vivi è stato aggiustato per l’anno di trattamento. L’IMC femminile, il tipo di infertilità, la durata dell’infertilità, la gravidità, la parità e l’eziologia principale erano fattori importanti che influenzano la gravidanza e i nati vivi attraverso l’esperienza o la letteratura. Il protocollo OS, il tipo di gonadotropina e la dose iniziale di FSH sono gli indicatori chiave per influenzare il numero di ovociti recuperati e, infine, la possibilità cumulativa di nati vivi.
Risultati
Parametri di ovociti ed embrioni

Tabella 3. Parametri di ovociti ed embrioni e CLBR.
Esiti di gravidanza e tasso cumulativo di nati vivi (CLBR)
Inconsistente con il modello di distribuzione del numero di ovociti ed embrioni per gruppo, il CLBR nell’ordine dal più alto al più basso era 44.6% nel gruppo 1 (n = 879), 35,5% nel gruppo 3 (n = 858), 24,5% nel gruppo 2 (n = 482) e 12,7% nel gruppo 4 (n = 1306). Un’analisi di regressione a variabili multiple è stata eseguita con le variabili che possono agire come fattori di confondimento descritti nelle tabelle 1, 2. Gli odds ratio aggiustati (OR) di CLBR con i loro intervalli di confidenza al 95% (CI) sono stati mostrati nella tabella 4. Coerentemente con la tendenza dei risultati non aggiustati, il CLBR nel gruppo 3 (OR 0.9, 95% CI 0.7-1.2, p = 0.615) era leggermente inferiore e il gruppo 5 (OR 1.3, 95% CI 0.9-1.7, p = 0.111) era leggermente superiore al CLBR nel gruppo 1 senza differenza statistica significativa. Il CLBR nel gruppo 2 era significativamente più basso che nel gruppo 1 (OR 0.6, 95% CI 0.4-0.8, p = 0.004) e il CLBR nel gruppo 4 era il più basso (OR 0.4, 95% CI 0.3-0.6, p < 0.001) rispetto al gruppo 1. La tabella 5 ha mostrato i risultati di gravidanza per trasferimento a fresco o FET in pazienti a bassa prognosi. I tassi di impianto nei gruppi anziani (gruppo 2 e gruppo 4) erano significativamente più bassi rispetto ai gruppi giovani (gruppo 1 e gruppo 3).

Tabella 4. Analisi di regressione logistica per i CLBR.

Tabella 5. Risultati di gravidanza per trasferimento di embrioni sia freschi che congelati in pazienti a bassa prognosi.
La figura 2 ha mostrato il grafico di tendenza degli eventi chiave in pazienti a bassa prognosi. C’era un incrocio di linee di tendenza tra il gruppo 2 e il gruppo 3 dopo il trasferimento degli embrioni. Le pazienti del gruppo 2 (età ≥35; AFC ≥ 5) avevano un AFC più alto, più ovociti recuperati, più embrioni e più embrioni di buona qualità, ma un tasso di impianto e un CLBR ridotti. Al contrario, anche se le pazienti del gruppo 3 (età < 35; AFC < 5) avevano meno ovociti ed embrioni, il CLBR risultava più alto di quello del gruppo 2. L’analisi SWOT dei 4 gruppi di pazienti a bassa prognosi definiti dai criteri POSEIDON è mostrata nella Figura 3.
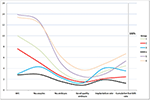
Figura 2. Grafico di tendenza degli eventi chiave nei pazienti a bassa prognosi. C’è stato un incrocio di linee di tendenza tra il gruppo 2 (rosso) e il gruppo 3 (blu) dopo il trasferimento degli embrioni. L’asse X rappresenta il numero medio di AFC, il numero di ovociti, il numero di embrioni, il numero di embrioni di buona qualità, il tasso di impianto e il tasso di nati vivi cumulativi. L’asse Y a sinistra rappresenta il numero delle prime quattro variabili (n) e l’asse Y a destra rappresenta il tasso delle ultime due variabili (%).

Figura 3. Analisi SWOT di 4 gruppi di pazienti a bassa prognosi definiti dai criteri POSEIDON.
Discussione
Il risultato principale di questo studio retrospettivo nella popolazione definita dai criteri POSEIDON era che il CLBR era più alto nel gruppo 1, seguito dal gruppo 3 e dal gruppo 2, e più basso nel gruppo 4. Secondo i nostri risultati, il CLBR delle giovani donne con scarsa riserva ovarica (gruppo 3) era leggermente inferiore a quello delle giovani donne con buona riserva ovarica e precedenti responder bassi (gruppo 1). Anche se le pazienti del gruppo 2 (età ≥ 35 anni; AFC ≥ 5) avevano una migliore riserva ovarica, più ovociti e più embrioni, il CLBR e il tasso di impianto, al contrario, erano più bassi rispetto alle pazienti del gruppo 3 con riserva ovarica più scarsa, meno ovociti e meno embrioni. Questo risultato può facilitare lo sviluppo di strategie di gestione per le pazienti a bassa prognosi.
I criteri innovativi POSEIDON mirano a identificare e stratificare le pazienti a bassa prognosi in quattro gruppi distinti in base all’età femminile, all’AFC e alla risposta ovarica nel ciclo precedente (4). Le pazienti del gruppo 2 erano caratterizzate da una buona riserva ovarica e da un’età avanzata, esattamente l’opposto delle pazienti del gruppo 3 con scarsa riserva ovarica ma di età più giovane. Studi (11-13) hanno dimostrato che la CLBR aumenta con il numero di ovociti recuperati anche nelle donne di età avanzata (14). È stato suggerito che il numero di ovociti recuperati è una variabile molto importante indipendentemente associata alla CLBR. Ci si aspettava che le pazienti del gruppo 2 con un numero maggiore di ovociti avessero una prognosi migliore delle pazienti del gruppo 3, perché le pazienti del gruppo 2 avevano più embrioni da trasferire. Tuttavia, il CLBR e il tasso di impianto erano inversamente più alti nel gruppo 2 che nel gruppo 3.
I nostri risultati sono coerenti con studi precedenti (15, 16) sull’associazione della riserva ovarica e l’esito della gravidanza. Chang et al. (15) hanno trovato che c’erano tassi più bassi di fecondazione normale, scissione, embrioni di alta qualità, impianto e gravidanza in donne più anziane che in donne più giovani con riserva ovarica ridotta. La ragione principale era l’impatto negativo dell’invecchiamento dell’ovocita sull’esito della gravidanza (basso tasso di impianto e alto tasso di perdita della gravidanza) a causa di anomalie cromosomiche (17) e disfunzioni citoplasmatiche (18). Il declino della fertilità con l’invecchiamento coinvolge sia la quantità che la qualità dell’ovocita. L’impianto e l’aborto sono legati alla qualità degli ovociti ma non necessariamente alla riserva ovarica (16). La discreta riserva ovarica nel gruppo 2 aumenterebbe la possibilità di ottenere più ovociti ed embrioni da trasferire, ma allo stesso tempo, il più alto tasso di aneuploidia porterebbe ad un basso tasso di impianto e ad un alto tasso di aborto spontaneo.
Per quanto riguarda la gestione delle pazienti del gruppo 2, si dovrebbe prestare maggiore attenzione a sviluppare strategie per migliorare la qualità degli ovociti piuttosto che la quantità di ovociti o di embrioni. Poiché nel gruppo 2 si ottengono più embrioni al giorno 3, coltivare gli embrioni fino allo stadio di blastocisti per il trasferimento è una buona opzione. Gli embrioni del 5-6° giorno hanno un tasso inferiore di aneuploidia segmentale (19) e una maggiore vitalità per l’impianto (20) rispetto agli embrioni del 2-3° giorno. I test genetici preimpianto per le aneuploidie (PGT-A) sono anche utili per le donne in fase avanzata per selezionare un embrione euploide da trasferire (21). Un regime di stimolazione ovarica ottimale per migliorare la qualità degli ovociti (22, 23) potrebbe essere un’opzione alternativa. Supplementi come il deidroepiandrosterone sono stati provati per migliorare lo sviluppo dei follicoli (24), anche se non ci sono prove sufficienti per sostenere il loro uso in queste pazienti.
Le pazienti del gruppo 3 (età < 35 anni; AFC < 5) avevano una scarsa riserva ovarica, che erano attese come responders con scarso esito di gravidanza. È interessante notare che il tasso di produzione di ovociti (145,3% di ovociti recuperati per AFC) nel gruppo 3 era significativamente più alto che negli altri gruppi, anche se la dose iniziale di FSH non era significativamente aumentata (Tabella 2). Questo ha suggerito che la risposta dei follicoli antrali alla gonadotropina può aver raggiunto il limite della sua capacità, quindi non ci sarà alcun beneficio aggiuntivo nel numero di ovociti per aumentare ulteriormente le dosi giornaliere di gonadotropina (25). La valutazione della sensibilità ovarica all’FSH è un elemento chiave per migliorare i tassi di successo della FIVET in queste pazienti a bassa prognosi e aprire nuove prospettive di trattamento (26). L’alto tasso di produzione di ovociti per AFC nel gruppo 3 ha anche supportato la raccomandazione riportata di una dose massima giornaliera di 300 IU rFSH (5). Per le pazienti del gruppo 3, maggiori sforzi dovrebbero essere concentrati sull’aumento del numero di ovociti, in quanto l’esito clinico della gravidanza è rassicurato una volta che gli ovociti sono acquisiti.
Le pazienti del gruppo 5 erano le pazienti non a bassa prognosi che avevano una buona risposta ovarica (più di 9 ovociti nel precedente prelievo), tuttavia la maggior parte di queste pazienti non è riuscita a vivere il parto nel precedente ciclo IVF. Confrontando con un altro non bassa prognosi pazienti con primo trattamento IVF (gruppo 6), anche se i pazienti nel gruppo 5 hanno più AFC e il numero di ovociti recuperati, lo sviluppo embrionale e l’esito della gravidanza sono stati inferiori a quelli del gruppo 6. Pertanto, il fallimento in pazienti IVF prima con buona risposta ovarica può essere la prognosi scarsa per il successivo trattamento IVF.
Fattore pelvico-tubarico è la causa più comune di infertilità, che rappresenta circa 10,8-78,3% delle donne sterili in Cina (27, 28). Il fattore tubarico coinvolge principalmente l’occlusione tubarica e la patologia peritoneale che causa aderenze, che è stata diagnosticata tramite isterosalpingografia e laparoscopia. La causa prevalente di infertilità da fattore tubarico è stata attribuita alla malattia infiammatoria pelvica (PID), salpingite ed endometriosi (29). Nei gruppi di pazienti di questo studio, il fattore tubarico è la principale eziologia di infertilità, che va dal 62,9 al 71,4%, che era più alto di quello nelle donne infertili di altri paesi e regioni. Pertanto, dovrebbe essere attento a interpretare le implicazioni più ampie dei risultati.
Le limitazioni sono legate alla natura retrospettiva dello studio e il fatto che i dati provenissero da un unico centro indebolisce anche l’universalità delle nostre osservazioni. Altre potenziali limitazioni potrebbero essere che il protocollo analogo non-GnRH è stato utilizzato in alcune donne con riserva ovarica diminuita piuttosto che in quelle con riserva ovarica normale. I cicli freschi che non sono riusciti a produrre alcun ovocita non sono stati inclusi in questo studio, per esempio, i cicli con cancellazione della stimolazione ovarica.
I risultati di questo studio possono fornire nuove intuizioni per lo sviluppo di strategie di gestione per le pazienti a bassa prognosi. È stata eseguita un’analisi SWOT per aiutare la gestione delle pazienti a bassa prognosi in clinica, che è stata tratta dai rapporti POSEIDON (1, 2, 4, 5) e dai dati di questo studio. La reattività dei follicoli antrali alla gonadotropina era estremamente più alta nel gruppo 3 che negli altri gruppi. Considerando il gratificante risultato CLBR nel gruppo 3, al fine di aumentare la resa ovocitaria, suggeriamo di provare più stimolazioni ovariche ma non una stimolazione ovarica più forte attraverso un’eccessiva dose giornaliera di gonadotropina. Anche se le pazienti del gruppo 2 hanno più riserva ovarica e più ovociti ed embrioni, il CLBR era inferiore al previsto. La strategia di gestione per il gruppo 2 dovrebbe essere il miglioramento del tasso di nati vivi piuttosto che l’aumento del numero di ovociti recuperati.
Conclusione
In conclusione, in contrasto con il modello di distribuzione della quantità di ovociti e della quantità di embrioni per gruppo di pazienti, i CLBR nell’ordine dal più alto al più basso erano nel gruppo 1 (giovani donne con buona riserva ovarica), gruppo 3 (giovani donne con scarsa riserva ovarica), gruppo 2 (donne in età avanzata con buona riserva ovarica), e infine gruppo 4 (donne in età avanzata con scarsa riserva ovarica.
Disponibilità dei dati
I dati grezzi che supportano le conclusioni di questo manoscritto saranno resi disponibili dagli autori, senza indebite riserve, a qualsiasi ricercatore qualificato.
Dichiarazione etica
Lo studio è stato approvato dal comitato etico per l’applicazione clinica della tecnologia riproduttiva assistita umana del Northwest Women’s and Children’s Hospital (No. 2018002). Il comitato etico che ha approvato questo studio ha rinunciato alla necessità di ottenere il consenso informato. Tutta la ricerca è stata eseguita in conformità con le linee guida e i regolamenti pertinenti.
Contributi degli autori
WS e JS hanno concepito e progettato lo studio. WS e WZ hanno redatto e rivisto il manoscritto. WS, ZZ e WZ hanno analizzato e interpretato i dati. LT, ZZ, e HZ hanno raccolto e cancellato i dati. Tutti gli autori hanno letto e approvato la versione finale del manoscritto.
Finanziamento
Lo studio è stato finanziato dai progetti generali di sviluppo sociale della provincia dello Shaanxi (n. 2018SF-247) e dal programma di formazione del personale dell’ospedale per donne e bambini del nord-ovest (2018ZD02).
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo tutti i clinici, scienziati ed embriologi del Northwest Women and Children’s Hospital per la loro assistenza nella raccolta dati, e tutti i pazienti per il loro contributo a questo studio. Ringraziamo con gratitudine la dottoressa Xinglin Chen del Dipartimento di Epidemiologia e Biostatistica, X&Y solutions Inc. di Boston per il suo contributo al supporto statistico.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. Una nuova stratificazione più dettagliata delle basse rispondenti alla stimolazione ovarica: da una scarsa risposta ovarica a un concetto di bassa prognosi. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Il nuovo POSEIDON stratificazione di “pazienti a bassa prognosi in tecnologia riproduttiva assistita” e il suo marker proposto di esito positivo. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definizione di pazienti a bassa prognosi sottoposti a tecnologia riproduttiva assistita: Criteri POSEIDON-il perché. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Fattori correlati alla gravidanza clinica dopo il trasferimento di embrioni vitrificati-riscaldati: un’analisi retrospettiva e di regressione logistica multivariata di 2313 cicli di trasferimento. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Tassi di nascita vivi cumulativi secondo il numero di ovociti recuperati dopo la prima stimolazione ovarica per la fecondazione in vitro / iniezione intracitoplasmatica di sperma: un’analisi multicentrica multinazionale con circa 15.000 donne. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Associazione tra il numero di ovociti recuperati e il tasso cumulativo di nati vivi in donne di età compresa tra 35-40 anni sottoposte a lunghi cicli IVF/ICSI con agonisti GnRH. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Prognosi del tasso di nascita vivo cumulativo basato sul numero di ovociti aspirati in precedenti cicli ART. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Tassi di nati vivi cumulativi e numero di ovociti recuperati in donne di età avanzata. Un’analisi di un singolo centro che include 4500 donne >/ = 38 anni. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Qualità dell’uovo ed esito della gravidanza in giovani donne infertili con riserva ovarica diminuita. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. L’invecchiamento degli ovociti è alla base dell’invecchiamento riproduttivo femminile: meccanismi biologici e strategie terapeutiche. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. L’incidenza e l’origine di aneuploidia segmentale in ovociti umani ed embrioni preimpianto. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Confronto dei risultati di gravidanza dopo vitrificazione allo stadio di clivaggio e blastocisti: una meta-analisi. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. La stimolazione ovarica in fase luteale può migliorare il recupero degli ovociti e la qualità degli ovociti nei rispondenti ovarici poveri sottoposti a fecondazione in vitro: risultati preliminari da un singolo centro studio pilota prospettico. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacia del deidroepiandrosterone (DHEA) per superare l’effetto dell’invecchiamento ovarico (DITTO): una prova di principio in doppio cieco randomizzato con placebo controllato. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Capire il tasso di uscita follicolare (FORT) e le sue implicazioni per i criteri POSEIDON. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Studio epidemiologico sulla sterilità in tre province della Cina. Tesi di dottorato, Graduate School of Peking Union Medical College, Pechino, Cina (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologia ed eziologia dell’infertilità dell’ovidotto. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar