Quando l’idrogeno è legato covalentemente ad un atomo altamente elettronegativo, come il fluoro, il cloro, l’ossigeno o l’azoto, l’atomo H ha una parziale carica positiva, scritta Hδ+.
Hδ+ è fisicamente molto piccolo, quindi la densità di carica su di esso è insolitamente alta.
Immagina che un altro atomo negativo o elettronegativo, diciamo su un’altra molecola, si avvicini all’Hδ+; ci sarà un’attrazione reciproca, con conseguente attrazione dipolo-dipolo particolarmente forte.Questa attrazione è chiamata legame idrogeno.
In generale, i legami idrogeno sono più deboli dei legami ionici e covalenti, ma sono più forti delle forze di van der Waals.

Il legame a idrogeno nell’acqua
L’esempio più noto di legame a idrogeno è l’acqua:
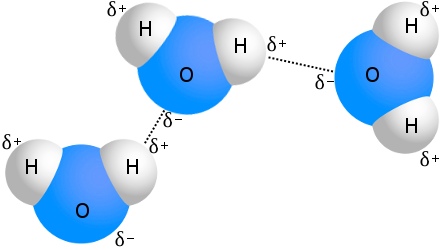
Ogni molecola d’acqua può essere legata a idrogeno ad altre quattro molecole di acqua.In acqua a temperatura ambiente, il numero medio di legami a idrogeno per molecola d’acqua è 3,6.
Il movimento termico casuale delle molecole assicura che la durata di ogni singolo legame a idrogeno in acqua sia breve, in media solo 10 picosecondi.Tuttavia, il tempo per formare un nuovo legame è ancora più breve.
Per rompere permanentemente un singolo legame a idrogeno in acqua ci vogliono 21 kJ mol-1, un input significativo di energia.Il risultato è che i punti di fusione e di ebollizione dell’acqua sono molto più alti di quanto ci si aspetterebbe per un molecolo di peso molecolare così basso.
Considera l’acqua e il metano: le molecole d’acqua sono fortemente attratte l’una dall’altra attraverso il legame a idrogeno, mentre nel metano prevalgono le forze di van der Waals, quindi, sebbene le loro masse molecolari siano simili, 18 per l’acqua e 16 per il metano, le loro proprietà fisiche sono molto diverse.Per esempio, l’acqua fonde a 0,00 °C e bolle a 99,98 °C; il metano fonde a -182,5 °C e bolle a -161,5 °C.
Il legame di idrogeno nell’acqua contro il solfuro di idrogeno
Lo zolfo è nel gruppo 16 della tavola periodica, lo stesso dell’ossigeno. Lo zolfo è più pesante dell’ossigeno, quindiH2S dovrebbe avere punti di fusione e di ebollizione più alti di H2O.Tuttavia, questo non è il caso perché lo zolfo è meno elettronegativo dell’ossigeno, e quindi il legame a idrogeno in H2S è debole.

Mol. Massa: 16
Pt. di fusione: 0,00 °C
Pt. di ebollizione: 99,98 °C
Elettronegatività di O (Pauling): 3,44
Entalpia di legame idrogeno: 21 kJ mol-1

Mol. Mass: 34
Pt. di fusione: -82 °C
Pt. di ebollizione: -60 °C
Elettronegatività di S (Pauling): 2.58
Entalpia del legame di idrogeno: ≅ 3 kJ mol-1
Collegamento di idrogeno in ammoniaca e fluoruro di idrogeno
Fluoro e azoto sono gli elementi più elettronegativi nei loro gruppi della tavola periodica, e il legame di idrogeno è osservato in fluoruro di idrogeno e ammoniaca.
Come nel caso dell’acqua, i punti di fusione e di ebollizione del fluoruro di idrogeno e dell’ammoniaca sono più alti degli idruri degli elementi più pesanti dei loro gruppi.
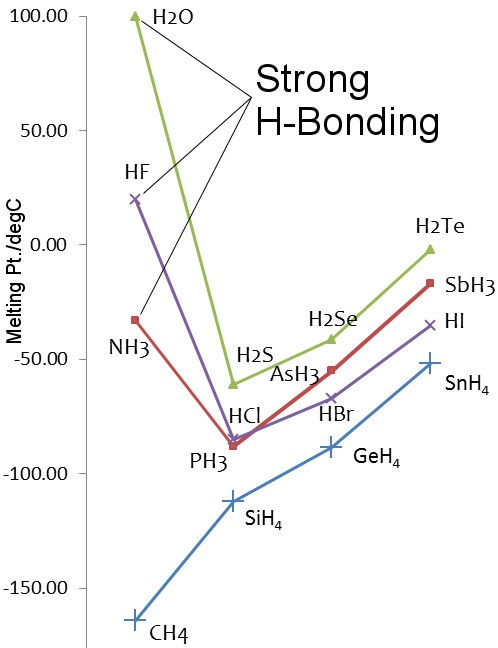
Punti di fusione degli idruri degli elementi del gruppo 14-17
Il legame a idrogeno nel DNA
Le coppie di basi del DNA collegano le sue due catene di eliche.
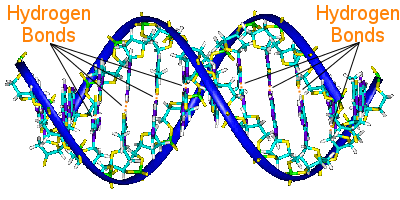
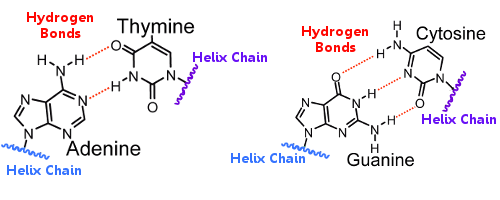
Le coppie di basi su un’elica sono legate alle coppie di basi sull’altra elica da legami a idrogeno.Così il legame a idrogeno tiene insieme le eliche, creando la famosa doppia elica.
Quando il DNA si replica, i legami a idrogeno si rompono, permettendo alle due eliche di separarsi.In questo modo, il legame a idrogeno gioca un ruolo essenziale nel meccanismo di blocco delle coppie di basi della replica del DNA.
Il legame a idrogeno nella lana
Come altre fibre proteiche, la lana è caratterizzata dal legame a idrogeno. L’immagine qui sotto mostra come i legami a idrogeno (punti arancioni) collegano le spire della catena a α-elica della lana (verde).
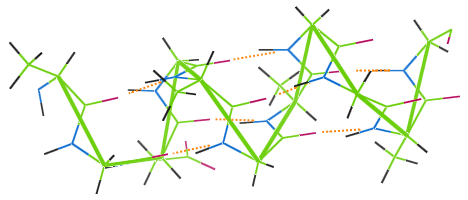
Se un indumento di lana viene lavato ad alta temperatura, i legami a idrogeno vengono distrutti, le spire perdono la loro elasticità e l’indumento diventa difettoso.
