Obiettivi di apprendimento
- Relazionare le configurazioni elettroniche degli elementi alla forma della tavola periodica.
- Determinare la configurazione elettronica attesa di un elemento in base al suo posto sulla tavola periodica.
Nel capitolo 3 “Atomi, molecole e ioni”, abbiamo introdotto la tavola periodica come strumento per organizzare gli elementi chimici conosciuti. Una tavola periodica è mostrata nella figura 8.11 “La tavola periodica”. Gli elementi sono elencati per numero atomico (il numero di protoni nel nucleo), e gli elementi con proprietà chimiche simili sono raggruppati in colonne.
Figura 8.11 La tavola periodica
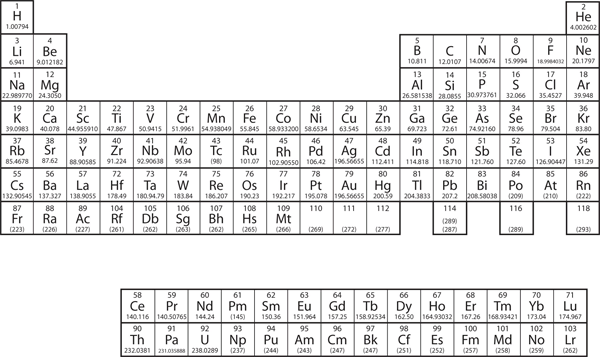
Perché la tavola periodica ha la struttura che ha? La risposta è piuttosto semplice, se si capiscono le configurazioni degli elettroni: la forma della tavola periodica imita il riempimento dei sottogusci con gli elettroni.
Cominciamo con H e He. Le loro configurazioni elettroniche sono 1s1 e 1s2, rispettivamente; con He, il guscio n = 1 è riempito. Questi due elementi costituiscono la prima fila della tavola periodica (vedi Figura 8.12 “L’1”).
Figura 8.12 Il sottoguscio 1s
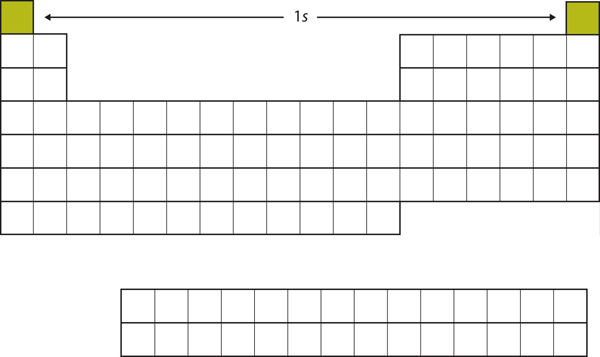
H e He rappresentano il riempimento del sottoguscio 1s.
I due elettroni successivi, per Li e Be, andrebbero nel sottoguscio 2s. La figura 8.13 “Il 2” mostra che questi due elementi sono adiacenti sulla tavola periodica.
Figura 8.13 Il sottoguscio 2s
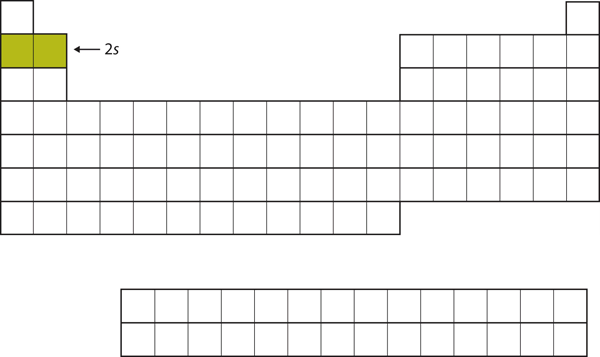
Nel Li e nel Be, il sottoguscio 2s viene riempito.
Per i prossimi sei elementi, il sottoguscio 2p viene occupato da elettroni. Sul lato destro della tavola periodica, questi sei elementi (da B a Ne) sono raggruppati insieme (Figura 8.14 “Il 2”).
Figura 8.14 Il sottoguscio 2p
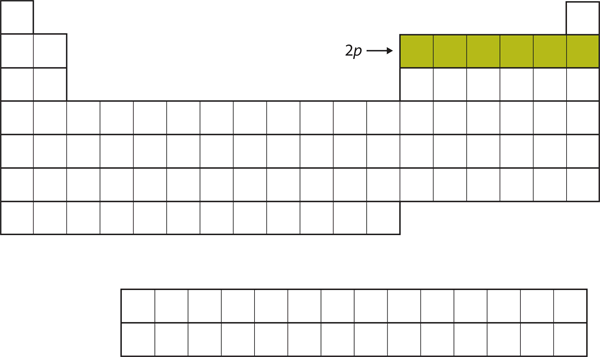
Per B e Ne, il sottoguscio 2p è occupato.
Il prossimo sottoguscio ad essere riempito è il sottoguscio 3s. Gli elementi quando questo sottoguscio viene riempito, Na e Mg, sono di nuovo sul lato sinistro della tavola periodica (Figura 8.15 “Il 3”).
Figura 8.15 Il sottoguscio 3s
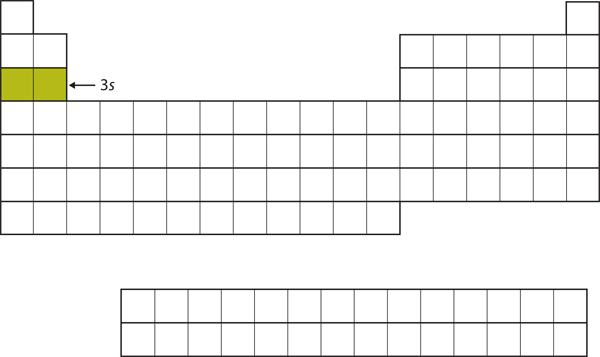
Ora il sottoguscio 3s è occupato.
Poi, il sottoguscio 3p viene riempito con i prossimi sei elementi (Figura 8.16 “Il 3”).
Figura 8.16 Il sottoguscio 3p
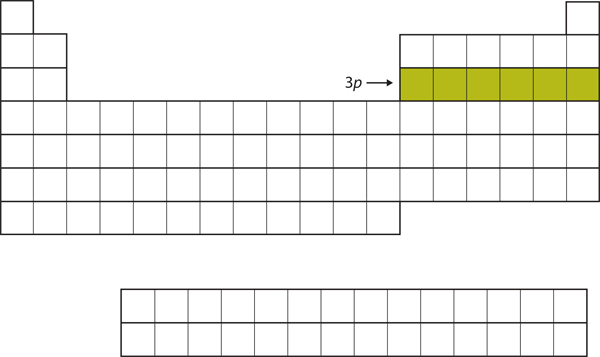
Poi, il sottoguscio 3p viene riempito di elettroni.
Invece di riempire il sottoguscio 3d, gli elettroni vanno nel sottoguscio 4s (Figura 8.17 “Il 4”).
Figura 8.17 Il sottoguscio 4s
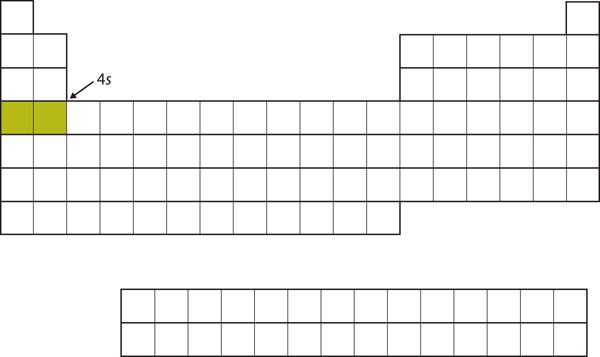
Il sottoguscio 4s viene riempito prima del sottoguscio 3d. Questo si riflette nella struttura della tavola periodica.
Dopo che il sottoguscio 4s è riempito, il sottoguscio 3d è riempito fino a 10 elettroni. Questo spiega la sezione di 10 elementi nel mezzo della tavola periodica (Figura 8.18 “Il 3”).
Figura 8.18 Il sottoguscio 3d
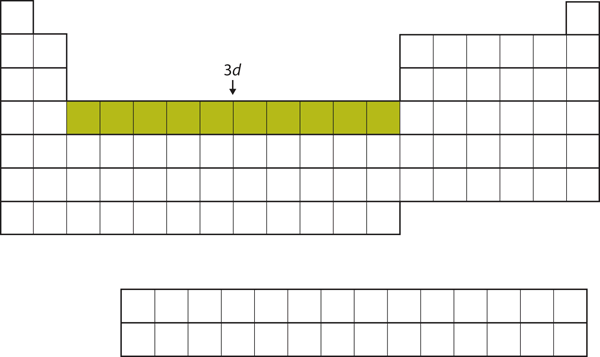
Il sottoguscio 3d è riempito nella sezione centrale della tavola periodica.
E così via. Mentre attraversiamo le righe della tavola periodica, la forma generale della tavola delinea come gli elettroni occupano i gusci e i sottogusci.
Le prime due colonne sul lato sinistro della tavola periodica sono dove i sottogusci s sono occupati. Per questo motivo, le prime due righe della tavola periodica sono etichettate come blocco s. Allo stesso modo, il blocco p sono le sei colonne più a destra della tavola periodica, il blocco d sono le 10 colonne centrali della tavola periodica, mentre il blocco f è la sezione di 14 colonne che viene normalmente rappresentata come staccata dal corpo principale della tavola periodica. Potrebbe essere parte del corpo principale, ma allora la tavola periodica sarebbe piuttosto lunga e ingombrante. La figura 8.19 “Blocchi della tavola periodica” mostra i blocchi della tavola periodica.
Figura 8.19 Blocchi della tavola periodica
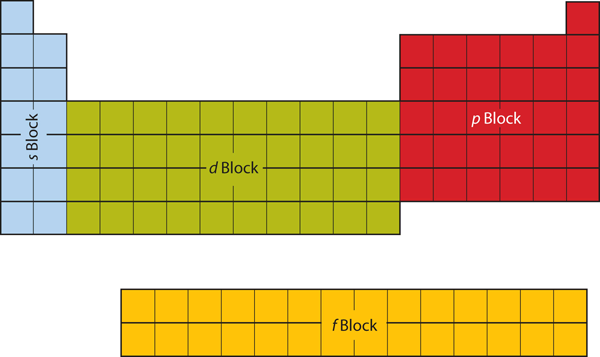
La tavola periodica è separata in blocchi a seconda di quale sottoguscio viene riempito per gli atomi che appartengono a quella sezione.
Gli elettroni nel guscio più alto, più qualsiasi elettrone nell’ultimo sottoguscio non riempito, sono chiamati elettroni di valenza; il guscio più alto è chiamato guscio di valenza. (Gli elettroni interni sono chiamati elettroni del nucleo). Gli elettroni di valenza controllano ampiamente la chimica di un atomo. Se guardiamo solo la configurazione degli elettroni del guscio di valenza, troviamo che in ogni colonna, la configurazione degli elettroni del guscio di valenza è la stessa. Per esempio, prendiamo gli elementi della prima colonna della tavola periodica: H, Li, Na, K, Rb e Cs. Le loro configurazioni elettroniche (abbreviate per gli atomi più grandi) sono le seguenti, con la configurazione elettronica del guscio di valenza evidenziata:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Hanno tutti una configurazione elettronica simile nei loro gusci di valenza: un singolo elettrone s. Poiché gran parte della chimica di un elemento è influenzata dagli elettroni di valenza, ci aspetteremmo che questi elementi abbiano una chimica simile. L’organizzazione degli elettroni negli atomi spiega non solo la forma della tavola periodica ma anche il fatto che gli elementi nella stessa colonna della tavola periodica hanno una chimica simile.
Lo stesso concetto si applica alle altre colonne della tavola periodica. Gli elementi in ogni colonna hanno le stesse configurazioni elettroniche del guscio di valenza, e gli elementi hanno alcune proprietà chimiche simili. Questo è strettamente vero per tutti gli elementi nei blocchi s e p. Nei blocchi d ed f, poiché ci sono eccezioni all’ordine di riempimento dei sottogusci con gli elettroni, gusci di valenza simili non sono assoluti in questi blocchi. Tuttavia, molte somiglianze esistono in questi blocchi, quindi ci si aspetta una somiglianza nelle proprietà chimiche.
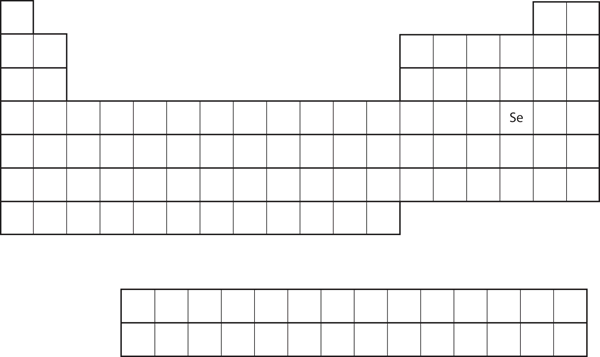
La somiglianza della configurazione elettronica del guscio di valenza implica che possiamo determinare la configurazione elettronica di un atomo solo dalla sua posizione sulla tavola periodica. Consideriamo Se, come mostrato nella figura 8.20 “Il selenio sulla tavola periodica”. Si trova nella quarta colonna del blocco p. Ciò significa che la sua configurazione elettronica dovrebbe finire in una configurazione elettronica p4. Infatti, la configurazione elettronica di Se è 4s23d104p4, come previsto.
Figura 8.20 Selenio sulla tavola periodica
Esempio 8
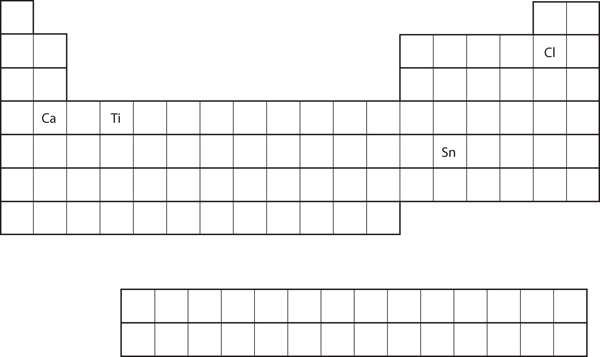
Dalla posizione dell’elemento sulla tavola periodica, predici la configurazione elettronica del guscio di valenza per ogni atomo. Vedi Figura 8.21 “Vari elementi sulla tavola periodica”.
- Ca
- Sn
Soluzione
- Ca si trova nella seconda colonna del blocco s. Ci aspetteremmo che la sua configurazione elettronica finisca con s2. La configurazione elettronica del calcio è 4s2.
- Sn si trova nella seconda colonna del blocco p, quindi ci aspettiamo che la sua configurazione elettronica finisca con p2. La configurazione elettronica dello stagno è 5s24d105p2.
Test Yourself
Dalla posizione dell’elemento sulla tavola periodica, predici la configurazione elettronica dello strato di valenza per ogni atomo. Vedi Figura 8.21 “Vari elementi sulla tavola periodica”.
- Ti
- Cl
Risposta
- 4s23d2
- 3s23p5
Figura 8.21 Vari elementi sulla tavola periodica
App: Colori Artificiali
Il colore degli oggetti deriva da un meccanismo diverso da quello dei colori del neon e di altre luci a scarica. Anche se le luci colorate producono i loro colori, gli oggetti sono colorati perché riflettono preferenzialmente un certo colore dalla luce bianca che li illumina. Un pomodoro rosso, per esempio, è rosso brillante perché riflette la luce rossa mentre assorbe tutti gli altri colori dell’arcobaleno.
Molti cibi, come i pomodori, sono molto colorati; infatti, l’affermazione comune “si mangia prima con gli occhi” è un riconoscimento implicito che l’attrattiva visiva del cibo è importante quanto il suo sapore. Ma che dire dei cibi lavorati?
Molti cibi lavorati hanno coloranti alimentari aggiunti. Ci sono due tipi di coloranti alimentari: naturali e artificiali. I coloranti alimentari naturali includono lo zucchero caramellato per il marrone; annatto, curcuma e zafferano per varie tonalità di arancione o giallo; betanina dalle barbabietole per il viola; e anche il carminio, un colorante rosso intenso che viene estratto dalla cocciniglia, un piccolo insetto che è un parassita dei cactus in America centrale e meridionale. (Proprio così: potreste mangiare succo di insetto!)
Alcuni coloranti sono artificiali. Negli Stati Uniti, la Food and Drug Administration approva attualmente solo sette composti come coloranti artificiali in alimenti, bevande e cosmetici:
- FD&C Blu #1: Brilliant Blue FCF
- FD&C Blu #2: Indigotina
- FD&C Verde #3: Fast Green FCF
- RD&C Rosso #3: Eritrosina
- FD&C Rosso #40: Allura Red AC
- FD&C Giallo #5: Tartrazina
- FD&C Giallo #6: Sunset Yellow FCF
I colori con numero inferiore non sono più sul mercato o sono stati rimossi per vari motivi. In genere, questi coloranti artificiali sono grandi molecole che assorbono molto fortemente alcuni colori della luce, rendendoli utili anche a concentrazioni molto basse negli alimenti e nei cosmetici. Anche in quantità così basse, alcuni critici sostengono che una piccola parte della popolazione (specialmente i bambini) è sensibile ai coloranti artificiali e chiedono che il loro uso sia limitato o interrotto. Tuttavia, gli studi formali sui coloranti artificiali e i loro effetti sul comportamento sono stati inconcludenti o contraddittori. Nonostante questo, la maggior parte delle persone continua a gustare cibi lavorati con coloranti artificiali (come quelli mostrati nella figura di accompagnamento).

I coloranti alimentari artificiali si trovano in una varietà di prodotti alimentari, come cibi lavorati, caramelle e coloranti per uova. Anche gli alimenti per animali domestici contengono coloranti alimentari artificiali, anche se è probabile che all’animale non importi!
Fonte: Foto per gentile concessione di Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Punti chiave
- La disposizione degli elettroni negli atomi è responsabile della forma della tavola periodica.
Esercizi
-
In quale punto della tavola periodica i sottogusci sono occupati dagli elettroni?
-
In quale punto della tavola periodica i sottogusci d sono occupati da elettroni?
-
In quale blocco si trova Ra?
-
Quali sono le configurazioni elettroniche del guscio di valenza degli elementi della seconda colonna della tavola periodica?
-
Quali sono le configurazioni degli elettroni del guscio di valenza degli elementi della penultima colonna della tavola periodica?
-
Quali sono le configurazioni degli elettroni del guscio di valenza degli elementi della prima colonna del blocco p?
-
Quali sono le configurazioni degli elettroni del guscio di valenza degli elementi nell’ultima colonna del blocco p?
-
Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) Sr
b) S
10. Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) Fe
b) Ba
11. Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) V
b) Ar
12. Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) Cl
b) K
13. Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) Ge
b) C
14. Dalla posizione dell’elemento sulla tavola periodica, predire la configurazione elettronica di ogni atomo.
a) Mg
b) I
Risposte
le prime due colonne
il blocco s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2