Chimica dell’acqua 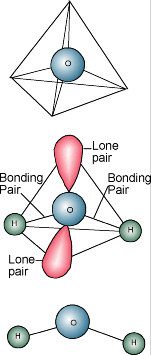 Probabilmente sapete che la descrizione chimica dell’acqua è H2O. Una molecola d’acqua consiste in un atomo di ossigeno legato a due atomi di idrogeno. Gli atomi di idrogeno sono “attaccati” ad un lato dell’atomo di ossigeno, con il risultato che la molecola d’acqua ha una carica positiva sul lato dove si trovano gli atomi di idrogeno e una carica negativa sull’altro lato, dove si trova l’atomo di ossigeno. Poiché le cariche elettriche opposte si attraggono, le molecole d’acqua tendono ad attrarsi a vicenda, rendendo l’acqua un po’ “appiccicosa”. Il lato con gli atomi di idrogeno (carica positiva) attrae il lato dell’ossigeno (carica negativa) di un’altra molecola d’acqua.
Probabilmente sapete che la descrizione chimica dell’acqua è H2O. Una molecola d’acqua consiste in un atomo di ossigeno legato a due atomi di idrogeno. Gli atomi di idrogeno sono “attaccati” ad un lato dell’atomo di ossigeno, con il risultato che la molecola d’acqua ha una carica positiva sul lato dove si trovano gli atomi di idrogeno e una carica negativa sull’altro lato, dove si trova l’atomo di ossigeno. Poiché le cariche elettriche opposte si attraggono, le molecole d’acqua tendono ad attrarsi a vicenda, rendendo l’acqua un po’ “appiccicosa”. Il lato con gli atomi di idrogeno (carica positiva) attrae il lato dell’ossigeno (carica negativa) di un’altra molecola d’acqua.
Tutte queste molecole d’acqua che si attraggono a vicenda, tendono a raggrupparsi. Ecco perché le gocce d’acqua sono, di fatto, gocce! Se non fosse per alcune forze della Terra, come la gravità, una goccia d’acqua sarebbe a forma di palla, una sfera perfetta. Anche se non forma una sfera perfetta sulla Terra, dovremmo essere felici che l’acqua sia appiccicosa.
L’acqua è chiamata il “solvente universale” perché scioglie più sostanze di qualsiasi altro liquido. Questo significa che ovunque vada l’acqua, sia attraverso il terreno che attraverso il nostro corpo, porta con sé sostanze chimiche, minerali e nutrienti preziosi.
L’acqua pura ha un pH neutro. L’acqua pura ha un pH di circa 7, che non è né acido né basico.
Proprietà fisiche dell’acqua:
L’acqua è unica in quanto è l’unica sostanza naturale che si trova in tutti e tre gli stati – liquido, solido (ghiaccio), e gas (vapore) – alle temperature normalmente presenti sulla Terra. L’acqua della Terra è in costante interazione, cambiamento e movimento.
 L’acqua congela a 32° Fahrenheit (F) e bolle a 212° F. Infatti, i punti di congelamento e di ebollizione dell’acqua sono la linea di base con cui si misura la temperatura: 0° sulla scala Celsius è il punto di congelamento dell’acqua, e 100° è il punto di ebollizione dell’acqua. L’acqua è insolita in quanto la forma solida, il ghiaccio, è meno densa della forma liquida, ed è per questo che il ghiaccio galleggia.
L’acqua congela a 32° Fahrenheit (F) e bolle a 212° F. Infatti, i punti di congelamento e di ebollizione dell’acqua sono la linea di base con cui si misura la temperatura: 0° sulla scala Celsius è il punto di congelamento dell’acqua, e 100° è il punto di ebollizione dell’acqua. L’acqua è insolita in quanto la forma solida, il ghiaccio, è meno densa della forma liquida, ed è per questo che il ghiaccio galleggia.
L’acqua ha un alto indice di calore specifico. Questo significa che l’acqua può assorbire molto calore prima di iniziare a scaldarsi. Questo è il motivo per cui l’acqua è preziosa per le industrie e nel radiatore della tua auto come refrigerante. L’alto indice di calore specifico dell’acqua aiuta anche a regolare la velocità con cui l’aria cambia temperatura, motivo per cui il cambiamento di temperatura tra le stagioni è graduale piuttosto che improvviso, specialmente vicino agli oceani.
L’acqua ha una tensione superficiale molto alta. In altre parole, l’acqua è appiccicosa ed elastica, e tende a raggrupparsi in gocce piuttosto che diffondersi in un film sottile. La tensione superficiale è responsabile dell’azione capillare, che permette all’acqua (e alle sue sostanze dissolte) di muoversi attraverso le radici delle piante e attraverso i piccoli vasi sanguigni del nostro corpo.
Temperatura dell’acqua:
La temperatura dell’acqua non è importante solo per i nuotatori e i pescatori, ma anche per le industrie e persino per i pesci e le alghe. Molta acqua è usata per il raffreddamento nelle centrali elettriche che generano elettricità. Hanno bisogno di acqua fredda per iniziare, e generalmente rilasciano acqua più calda nell’ambiente. La temperatura dell’acqua rilasciata può influenzare gli habitat a valle. La temperatura può anche influenzare la capacità dell’acqua di trattenere l’ossigeno e la capacità degli organismi di resistere a certe sostanze inquinanti.
pH:
pH è una misura di quanto è acida/basica l’acqua. La gamma va da 0 a 14, con 7 che è neutro. Un pH inferiore a 7 indica acidità, mentre un pH superiore a 7 indica una base. Il pH è davvero una misura della quantità relativa di ioni idrogeno e idrossile liberi nell’acqua. L’acqua che ha più ioni idrogeno liberi è acida, mentre l’acqua che ha più ioni idrossile liberi è basica. Poiché il pH può essere influenzato dalle sostanze chimiche nell’acqua, il pH è un indicatore importante dell’acqua che sta cambiando chimicamente. Il pH è riportato in “unità logaritmiche”, come la scala Richter, che misura i terremoti. Ogni numero rappresenta un cambiamento di 10 volte nell’acidità/basicità dell’acqua. L’acqua con un pH di 5 è dieci volte più acida dell’acqua con un pH di sei.
L’inquinamento può cambiare il pH dell’acqua, che a sua volta può danneggiare gli animali e le piante che vivono nell’acqua. Per esempio, l’acqua che esce da una miniera di carbone abbandonata può avere un pH di 2, che è molto acido e influenzerebbe sicuramente qualsiasi pesce abbastanza pazzo da provare a viverci! Usando la scala dei logaritmi, quest’acqua di scarico delle miniere sarebbe 100.000 volte più acida dell’acqua neutra – quindi state lontani dalle miniere abbandonate.
Conduttanza specifica:
La conduttanza specifica è una misura della capacità dell’acqua di condurre una corrente elettrica. Dipende fortemente dalla quantità di solidi disciolti (come il sale) nell’acqua. L’acqua pura, come l’acqua distillata, avrà una conduttanza specifica molto bassa, mentre l’acqua di mare avrà una conduttanza specifica elevata. L’acqua piovana spesso dissolve i gas e la polvere trasportati dall’aria mentre è nell’aria, e quindi ha spesso una conduttanza specifica più alta dell’acqua distillata. La conduttanza specifica è un’importante misura della qualità dell’acqua perché dà una buona idea della quantità di materiale dissolto nell’acqua.
Probabilmente a scuola hai fatto l’esperimento in cui colleghi una batteria a una lampadina e fai passare due fili dalla batteria in un becher d’acqua. Quando i fili vengono messi in un becher di acqua distillata, la luce non si accende. Ma la lampadina si accende quando il becher contiene acqua salata (salina). Nell’acqua salata, il sale si è sciolto, rilasciando elettroni liberi, e l’acqua condurrà una corrente elettrica.
Turbidità:
La torbidità è una misura della torbidità dell’acqua. Si misura facendo passare un fascio di luce attraverso l’acqua e vedendo quanto viene riflesso dalle particelle nell’acqua. La torbidità dell’acqua è causata da materiale, come lo sporco e i residui di foglie, che è sospeso (galleggiante) nell’acqua. L’acqua cristallina, come quella del lago Tahoe (dove si lavora duramente per evitare che i sedimenti finiscano nel lago) ha una torbidità molto bassa. Ma guardate un fiume dopo una tempesta – è probabilmente marrone. Stai vedendo tutto il terreno sospeso nell’acqua. Per nostra fortuna, i materiali che causano torbidità nella nostra acqua potabile o si depositano o vengono filtrati prima che l’acqua arrivi nel nostro bicchiere a casa. La torbidità si misura in unità nefelometriche di torbidità (NTU).
Ossigeno disciolto:
Anche se le molecole d’acqua contengono un atomo di ossigeno, questo ossigeno non è quello che serve agli organismi acquatici che vivono nelle nostre acque naturali. Una piccola quantità di ossigeno, fino a circa dieci molecole di ossigeno per milione di acqua, è effettivamente disciolta nell’acqua. Questo ossigeno disciolto è respirato dai pesci e dallo zooplancton ed è loro necessario per sopravvivere.
L’acqua in rapido movimento, come in un torrente di montagna o in un grande fiume, tende a contenere molto ossigeno disciolto, mentre l’acqua stagnante ne contiene poco. Il processo in cui i batteri nell’acqua aiutano la materia organica, come quella proveniente da un impianto di trattamento delle acque reflue, a decomporsi, consuma ossigeno. Così, un eccesso di materiale organico nei nostri laghi e fiumi può causare una situazione di carenza di ossigeno. La vita acquatica può avere un momento difficile in acque stagnanti che hanno molto materiale organico in decomposizione, specialmente in estate, quando i livelli di ossigeno disciolto sono al minimo stagionale.
Durezza:
La quantità di calcio e magnesio dissolti nell’acqua determina la sua “durezza”. La durezza dell’acqua varia in tutti gli Stati Uniti. Se vivete in una zona dove l’acqua è “dolce”, allora potreste non aver mai sentito parlare di durezza dell’acqua. Ma se vivete in Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, South Dakota, Iowa, Wisconsin, o Indiana, dove l’acqua è relativamente dura, potreste notare che è difficile ottenere una schiuma quando vi lavate le mani o i vestiti. E le industrie della tua zona potrebbero dover spendere soldi per addolcire l’acqua, perché l’acqua dura può danneggiare le attrezzature. L’acqua dura può anche accorciare la vita dei tessuti e dei vestiti! Questo significa che gli studenti che vivono in zone con acqua dura si tengono al passo con le ultime mode perché i loro vestiti si consumano più velocemente?
Sedimento sospeso:
Il sedimento sospeso è la quantità di terreno che si muove in un flusso. Dipende molto dalla velocità del flusso dell’acqua, poiché l’acqua che scorre veloce può raccogliere e sospendere più terreno rispetto all’acqua calma. Durante le tempeste, il terreno viene lavato dalle rive del torrente nella corrente. La quantità che viene lavata in un torrente dipende dal tipo di terreno nel bacino di drenaggio del fiume e dalla vegetazione che circonda il fiume.
Se il terreno viene disturbato lungo un torrente e non vengono prese misure di protezione, allora l’eccesso di sedimenti può danneggiare la qualità dell’acqua di un torrente. Probabilmente avete visto quelle brevi recinzioni di plastica che i costruttori mettono ai bordi della proprietà che stanno sviluppando. Queste recinzioni di limo si suppone che intrappolino i sedimenti durante una tempesta di pioggia e li impediscano di essere lavati in un ruscello, poiché i sedimenti in eccesso possono danneggiare i ruscelli, i fiumi, i laghi e i serbatoi.
I sedimenti che entrano in un serbatoio sono sempre una preoccupazione; una volta entrati non possono uscire – la maggior parte si deposita sul fondo. I serbatoi possono “insabbiarsi” se entrano troppi sedimenti. Il volume del bacino si riduce, con conseguente riduzione dell’area per la nautica, la pesca e la ricreazione, oltre a ridurre la capacità di generazione di energia della centrale elettrica nella diga.
Geochimica delle soluzioni acquose:
Guarda un diagramma del ciclo idrogeochimico.
- Acido = sostanza contenente idrogeno che dà idrogeno libero (H + ) quando disciolta in acqua
- Base = sostanza contenente il gruppo OH che rende libero (OH – ) quando disciolta in acqua
-
Una soluzione acida è una contenente un eccesso di H + libero, e una base è una contenente un eccesso di OH – libero. Una reazione tra un acido e una base è solitamente chiamata neutralizzazione.
Per esempio:
-
HCl (acido) + NaOH (base) ==> H 2 O + NaCl
che sono dissociati in ioni:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - cioè Na + e Cl – non sono influenzati.
- pH = log inverso della concentrazione (attività) di H + libero, o pH = -log
-
L’acqua si dissocia in H + e OH – ;
-
la costante di dissociazione è: K acqua = =10 -14
- Quindi ci devono essere 10 -7 moli ciascuno di H+ e OH – in un chilogrammo di soluzione neutra alla temperatura standard di 25°C. Una mole è 6,023 x 10 23 atomi (o molecole) e H 2 O ha un peso molecolare di 18 grammi per mole. Un chilogrammo di acqua ha circa 1000/18 = 55,6 moli di acqua o circa 3,35 x 10 25 atomi di ossigeno e circa il doppio (6,7 x 10 25 atomi) di H + (la quantità di H + libero o OH – libero è relativamente piccola rispetto alla quantità di H 2 O non dissociato).
- Il pH varia a 25°C da 0 a 14; pH < 7 = soluzione acida; pH > 7 = soluzione basica. Se si aggiunge HCl o un altro acido, il pH diminuisce; se si aggiunge NaOH o un’altra base, il pH aumenta.
- Il pH aumenta quando l’acido carbonico (un acido debole) si dissocia: Quando l’anidride carbonica si combina con l’acqua, come succede nell’atmosfera quando vengono bruciati i combustibili fossili, si forma l’acido carbonico: H 2 O + CO 2 ==> H 2 CO 3 . Gli H + liberi sono resi disponibili durante le dissociazioni successive:
-
H 2 CO 3 ==> H + + HCO 3- da acido carbonico a bicarbonato, avviene a pH ~6,4
-
HCO 3 ==> H + + CO 32- da bicarbonato a carbonato, avviene a pH ~10.3
Ricorda, l’H + libero è disponibile solo quando è acido, o quando il pH < ~7. La dissociazione del bicarbonato a carbonato avviene quando c’è troppo OH – nel sistema e l’H + viene “rilasciato” per bilanciare la base.
- Cationi e anioni disciolti in acqua
Cationi = donatori di elettroni, caricati positivamente: Na + , K + , Mg ++ , Ca ++ , Fe ++ o Fe +++ , Mn ++ , Al +++
Anioni = accettori di elettroni, carichi negativamente: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metalli = agiscono per lo più come cationi: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, ecc.
- Analisi dell’acqua – Necessità di avere un bilancio cationi-anioni
millequivalente (MEQ) = mole di carica equivalente o anione o catione, misura della carica totale dovuta allo ione in questione disciolto nella soluzione. Iniziare con la concentrazione, dividere per il peso della mole, moltiplicare per la carica: XX mg/L / MW x CHG = MEQ
Esempio: NaCl in soluzione, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Quindi, se le MEQ totali di cationi e anioni non sono bilanciate, esiste qualche errore nell’analisi.