Che cos’è un’anomalia congenita delle arterie coronarie?
C’è un dibattito in corso su cosa debba essere considerato normale e cosa debba essere considerato un’anomalia delle arterie coronarie (CAA). Secondo Angelini,1 le CAA sono diagnosticate per esclusione, il che significa che, nei casi in cui la morfologia delle arterie coronarie non è normale, definire la normalità secondo un criterio statistico (intervallo tra più o meno 2 deviazioni standard del valore medio). Così, una CAA sarebbe quella morfologia coronarica osservata in meno dell’uno per cento della popolazione generale.1,2 La CAA può essere prodotta durante la cardiogenesi normale o patologica: nel primo caso, il risultato sarebbe una CAA isolata, sulla quale ci concentriamo in questo articolo, mentre, nel secondo caso, sarebbero associate ad altre malformazioni cardiache.
CLASSIFICAZIONE
Esistono diverse classificazioni.1-3 Una nuova che tenta di standardizzare i criteri diagnostici e raggruppa la CAA secondo 7 categorie è stata recentemente proposta4 (Tabella 1).


Gruppi internazionali chiedono che i registri includano almeno le anomalie che causano la maggior parte degli eventi clinici (morte improvvisa e ischemia miocardica) attribuiti alla CAA,5-7 costituite da quelle che hanno origine nel seno di Valsalva controlaterale o “sbagliato”. Questo gruppo comprende le arterie coronarie a singolo vaso (“iperdominanza” nella classificazione di Rigatelli et al4), poiché devono fornire sangue al miocardio a partire da un unico ostium coronarico e stabilire percorsi che occasionalmente sono simili a quelli delle CAA con origine nel seno di Valsalva sbagliato (Figura 1).

Figura 1. Le diverse definizioni o classificazioni e l’analisi di entrambe le serie angiografiche8,9 e autoptiche10 e, negli ultimi anni, le serie ecocardiografiche11 danno come risultato un’incidenza riportata di CAA che varia tra 0,1% e 8,4%,1,8,11 rendendo difficile stabilire l’esatta grandezza del problema che rappresentano. Nel complesso, l’incidenza può essere abbastanza simile a quella di altre malattie che siamo stati in grado di definire più accuratamente, come
la cardiomiopatia ipertrofica (0,2%)12 o la sindrome di Wolff-Parkinson-White (da 0,1% a 0,3%).13
L’incidenza di arterie coronarie anomale con origine nel seno sbagliato e arterie coronariche a vaso singolo negli studi angiografici coronarici varia tra lo 0.28% e 1,74%.2,3,8,9,14-16 Data la loro importanza clinica, concentreremo la nostra revisione su queste anomalie.
Presentazioni cliniche
Inizialmente, queste anomalie sono state diagnosticate durante l’angiografia coronarica eseguita in pazienti con malattia valvolare o cardiopatia ischemica, ed erano considerate senza significato clinico. Più tardi, cominciarono ad esserci rapporti di morte improvvisa in giovani atleti in cui l’unico segno di malattia era un’anomalia con origine nelle arterie coronarie.8,17
Lo spettro clinico alla presentazione è variabile: mentre alcuni pazienti sono asintomatici, altri presentano angina, dispnea, sincope, infarto miocardico acuto, insufficienza cardiaca e morte improvvisa.1,2,5,8,17-20 Attualmente, la CAA è considerata la seconda causa più comune di morte improvvisa negli atleti negli Stati Uniti.21
Questo significa che tutte le CAA devono essere considerate ad alto rischio? Assolutamente no, ma da un punto di vista strategico, dovrebbero essere considerate “potenzialmente maligne” fino a quando non vengono eseguiti ulteriori test per escludere un’ischemia miocardica provocata dall’anomalia.
La preoccupazione maggiore sta nel determinare quali CAA possono presentare una morte improvvisa. Oggi sappiamo che quelle che seguono un decorso interarterioso (o intramurale), quelle in cui l’arteria coronaria anomala è quella dominante e quelle che producono segni clinici in pazienti di meno di 30 o 35 anni sono quelle in cui l’incidenza di morte improvvisa è più alta.22-26
Per questo motivo, il nostro approccio a una CAA deve essere diverso a seconda dell’età del paziente. Nei giovani, sotto i 35 anni, ci “concentreremo” sulla prevenzione della morte improvvisa, mentre in quelli sopra i 35 anni, l’obiettivo principale sarà il trattamento dell’ischemia miocardica (Figura 2).
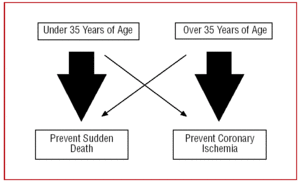
Figura 2. Approccio diverso a seconda dell’età del paziente.
Occasione, a causa della loro origine e del loro decorso anomalo, i CAA possono essere danneggiati durante l’intervento chirurgico per la sostituzione della valvola, ma questo può avvenire anche durante la chiusura percutanea del forame ovale. Per questo motivo, la presenza di CAA dovrebbe essere esclusa prima di interventi di questo tipo.27-30
PATOLOGIA DELL’ISCHEMIA NELLE ANOMALIE CORONARIE
Ci sono diverse teorie31 per spiegare i meccanismi che producono ischemia nella CAA, ma nessuna di esse è stata chiaramente dimostrata. In una, la causa è considerata la marcata angolazione dell’arteria anomala dove emerge dall’aorta. In contrasto con un’arteria coronaria normale, che è perpendicolare all’aorta alla sua origine, l’arteria coronaria anomala deve piegarsi su se stessa per raggiungere, dal seno di Valsalva opposto, il suo normale territorio di alimentazione. A causa di questo, l’ostio dell’arteria coronaria anomala sarebbe più piccolo, con creste simili a valvole, rispetto all’ostio circolare normale, e potrebbe essere compresso nel caso di una marcata espansione dell’aorta, come quella osservata durante un esercizio faticoso.32
Un’altra teoria si riferisce al corso iniziale della CAA. Quando è interarterioso, tra l’aorta e l’arteria polmonare, l’aumento della pressione nei 2 vasi, che si verifica durante lo sforzo, produrrebbe una compressione dell’arteria coronaria anomala.33 Inoltre, se il percorso iniziale è intramurale, l’ostruzione può essere rafforzata poiché l’arteria coronaria può deformarsi all’interno della parete aortica durante i periodi di ipertensione.34
Alcuni autori ritengono che il meccanismo che porta all’ischemia coinvolga la produzione di uno spasmo nell’arteria coronaria anomala come risultato del danno endoteliale prodotto dalla via anomala,35 e altri, che si produrrebbe un’intussuscezione della porzione prossimale della CAA nella parete aortica.31
Infine, tutti i meccanismi discussi possono produrre ischemia acuta o cronica (eventi ischemici minori) che provocano fibrosi miocardica che, a sua volta, potrebbe essere la causa della generazione di aritmie letali.36
Come viene diagnosticata un’anomalia coronarica?
La diagnosi richiede un alto indice di sospetto e la valutazione della sua presenza in determinate circostanze. Come abbiamo detto sopra, la maggior parte delle CAA sono scoperte incidentalmente durante le angiografie coronariche eseguite in pazienti con cardiopatia ischemica o malattia valvolare sottoposti a questo studio prima di un intervento chirurgico per la sostituzione della valvola.
I giovani che non presentano fattori di rischio coronarico o malattia valvolare associata rappresentano la più grande sfida diagnostica. Dovremmo sospettare una CAA in presenza di sincope da sforzo, dispnea o dolore toracico indicativo di angina.24,26,35 Evidentemente, il primo test diagnostico che tutti noi eseguiamo è l’ergometria standard. Tuttavia, questo non ha dimostrato di essere molto utile in questo tipo di pazienti, poiché di solito è negativo, un fatto che indica che l’ischemia dovuta alla CAA si presenta solo occasionalmente.35,36
Quindi, dato che i test “funzionali” non sono di grande aiuto, dobbiamo optare per uno studio di imaging che ci permette di esaminare l’anatomia coronarica. Il test non invasivo inizialmente raccomandato è l’ecocardiografia transtoracica (TTE).7,26,37-40 Nella maggior parte di questi pazienti, l’esecuzione di una semplice TTE in proiezione parasternale ad asse corto nel piano della radice aortica permette di distinguere i due ostia coronarici e persino di determinare il decorso iniziale della CAA. Pellicia et al hanno studiato 1360 atleti d’élite mediante ecocardiografia, visualizzando l’ostio e la porzione prossimale della coronaria principale sinistra nel 97% dei casi e la coronaria principale destra nell’80%.41
Di recente, Frommelt et al34 hanno eseguito l’ecocardiografia in tutti i bambini e gli adolescenti (età compresa tra 3 mesi e 20 anni) inviati al loro ospedale (1997-2002) con sintomi di ischemia miocardica, sospetta cardiopatia congenita o dolore muscoloscheletrico. Tutti sono stati sottoposti a TTE convenzionale con l’aiuto della mappatura del flusso di colore Doppler per determinare la direzione del flusso sanguigno. Hanno identificato 10 pazienti con origine anomala di un’arteria coronaria nel seno sbagliato (6 pazienti con arteria coronaria sinistra originata nel seno destro di Valsalva e 4 con arteria coronaria destra originata nel seno sinistro di Valsalva). Utilizzando TTE con tecniche color Doppler, hanno osservato un corso intramurale all’interno della parete aortica in nove dei pazienti e un corso intramiocardico nel paziente rimanente. Quando il corso di un CAA che ha origine nel seno sbagliato è intramurale, può sembrare che emerga dal suo ostium normale. Così, gli autori raccomandano l’utilizzo del color Doppler per determinare la direzione del flusso quando è necessario escludere la presenza di un’anomalia.
I miglioramenti nelle tecniche di imaging ecocardiografico ci permettono di determinare l’origine e seguire il corso iniziale di un CAA in alcuni gruppi di pazienti. Sono stati condotti studi su bambini, adolescenti e atleti d’élite, ma non sono ancora state studiate grandi serie che coinvolgano la popolazione adulta normale. Quindi, l’identificazione degli ostia coronarici nei giovani pazienti con questa sintomatologia dovrebbe essere effettuata sistematicamente nell’esame TTE.7,26
Nei pazienti con una scarsa finestra ecocardiografica, o quando il dubbio diagnostico persiste nonostante le indicazioni cliniche, per consentire la visualizzazione dell’origine e del decorso iniziale della CAA, può essere eseguita l’ecocardiografia transesofagea (TEE),7,26,42,43 la tomografia computerizzata (CT)26,44-46–con fascio elettronico o multislice–(Figura 3) o la risonanza magnetica cardiaca (CMRI)26,47,48 (Figura 4).

Figura 3. Immagine di tomografia computerizzata multidetettore che mostra l’arteria coronaria circonflessa (Cx) che origina dall’arteria coronaria destra (CD), seguendo un corso retroaortico per arrivare al suo territorio di distribuzione normale. Ao indica l’aorta; AP, arteria polmonare. Per gentile concessione del Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Spagna.
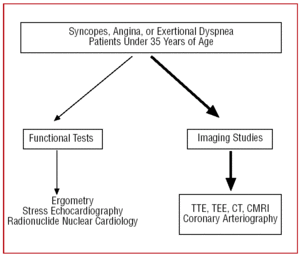
Figura 4. Protocollo diagnostico proposto in pazienti sotto i 35 anni di età con sospetta anomalia coronarica. CMRI indica risonanza magnetica cardiaca; CT, tomografia computerizzata; TEE, ecocardiografia transesofagea; TTE, ecocardiografia transtoracica.
Quale tecnica dobbiamo usare e in quale ordine? Ogni team medico dovrebbe rispondere a questa domanda in base alle tecniche disponibili e alla propria esperienza. Quello che dovremmo fare è identificare la CAA e il suo decorso iniziale con la tecnica meno invasiva a nostra disposizione. Anche se la TEE è stata utilizzata nella diagnosi e nell’identificazione del decorso iniziale di alcune CAA, riteniamo che, data la sua natura semi-invasiva, debba essere impiegata solo dopo che altre tecniche hanno fallito. Oggi, grazie alla crescente disponibilità e alle eccellenti immagini tridimensionali che si possono ottenere, sembrerebbe prudente optare per la TC multidetettore (Figura 5) o per la CMRI.49,50 L’arteriografia coronarica standard sarebbe indicata se gli altri test non portano a una diagnosi definitiva. A questo proposito, la 36a Conferenza di Bethesda51 per la selezione degli atleti agonisti con anomalie cardiovascolari, pubblicata nell’aprile 2005, raccomanda: “Le anomalie coronariche dovrebbero essere prese in considerazione negli atleti con sincope da sforzo o aritmia ventricolare sintomatica e dovrebbero essere indagate utilizzando studi appropriati come l’ecocardiografia, la CMR o la tomografia computerizzata ultrarapida. L’angiografia coronarica è indicata se altri studi non sono diagnostici”. In breve, non optano per 1 studio diagnostico o un altro.
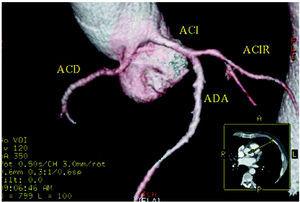
Figura 5. Tomografia computerizzata multislice (16 fette); ricostruzione tridimensionale renderizzata che mostra l’arteria coronaria destra (ACD) che origina nel seno sinistro di Valsalva. ACI indiactes arteria coronaria sinistra; ACIR, arteria coronaria circonflessa; ADA, arteria coronaria discendente anteriore. Per gentile concessione del Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spagna.
Nei pazienti di età superiore ai 35 anni che presentano segni clinici di angina o sincope ripetuta, dopo il test funzionale (ergometria, ecocardiografia da sforzo, ecc), un cateterismo è solitamente eseguito poiché la maggiore incidenza di aterosclerosi porta a un sospetto di malattia coronarica. In alcuni centri dotati di questa tecnologia, i pazienti con un quadro clinico atipico possono essere sottoposti a uno screening iniziale con TC multidetettore o CRMI. In entrambe le circostanze, la CAA sarebbe un reperto (Figura 6).
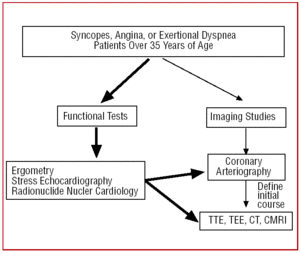
Figura 6. Protocollo diagnostico proposto in pazienti di età superiore ai 35 anni con sospetta anomalia coronarica. CRM indica risonanza magnetica cardiaca; CT, tomografia computerizzata; TEE, ecocardiografia transesofagea; TTE, ecocardiografia transtoracica.
Come si identifica il decorso iniziale di un’anomalia coronarica?
Questo è uno dei punti più complessi dello studio della CAA e costituisce un aspetto fondamentale nell’identificazione del rischio.
Per cominciare, dobbiamo tener conto del fatto che il nome e la natura di un’arteria coronaria sono definiti dal territorio che alimentano, non dalla loro origine. Così, una coronaria che nasce dal seno destro di Valsalva e si dirama per alimentare i territori delle arterie discendenti anteriori e circonflesse (Cx), non è una coronaria destra ma una coronaria principale sinistra con origine nel seno sbagliato. Quando un’arteria coronaria nasce dal seno sbagliato, il nome, la natura e anche la funzione rimangono gli stessi; solo la sua origine e il suo corso iniziale sono anomali.2
Dopo essere emersa dal seno di Valsalva sbagliato, un’arteria coronaria anomala può raggiungere il suo territorio di alimentazione normale attraverso almeno cinque vie diverse2,52:
1. Retrocardiaca, dietro le valvole mitrale e tricuspide.
2. 2. Retroaortica, di solito seguita dal Cx con origine nel seno di Valsalva destro o nella coronaria destra, adiacente alla parete aortica posteriore, nel solco tra atrio e aorta (seno trasverso) (Figura 3).
3. Preaortica o interarteriosa (tra l’aorta e l’arteria polmonare), in cui le coronarie anomale destra, discendente anteriore sinistra o principale sinistra attraversano il setto o lo spazio aortopolmonare. Questo è il decorso che è stato più frequentemente correlato a segni di ischemia e/o morte improvvisa (Figure 7 e 8).
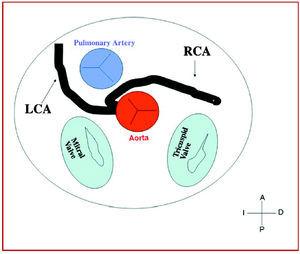
Figura 7. Diagramma che mostra il corso interarterioso di un’arteria coronaria destra (RCA) che origina nel seno controlaterale.
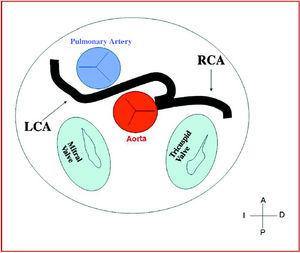
Figura 8. Diagramma che mostra il corso interarterioso di un’arteria coronaria sinistra (LCA) che ha origine nel seno controlaterale.
4. Intraseptal, attraverso la parte superiore del setto intraventricolare. È intramiocardica nella maggior parte dei casi e si riconosce all’angiografia a causa del restringimento sistolico, simile a un ponte miocardico, e perché di solito ci sono 1 o 2 rami perforatori settali in questa zona (Figura 9).

Figura 9. Diagramma che mostra il corso intrasettale di un’arteria coronaria sinistra (CI) che origina nel seno destro di Valsalva.
5. Precardica o prepolmonare, caratterizzata dalla sua posizione subepicardica, nella parete anteriore del tratto di efflusso del ventricolo destro o infundibolo. Questo passaggio è solitamente seguito da un’anomalia della coronaria destra, del tronco principale sinistro o dell’arteria coronaria discendente anteriore sinistra.
Sono stati riportati altri possibili decorsi o anche diversi decorsi in un dato paziente.2
Come si possono identificare questi decorsi iniziali con l’angiografia coronarica? Inizialmente, si riteneva che l’introduzione di un filo guida nell’arteria polmonare seguita da un’arteriografia coronarica in proiezione laterale sarebbe stata sufficiente per determinare il rapporto tra l’anomalia e i grandi vasi. Tuttavia, questa tecnica ha un valore limitato poiché, per esempio, in una vista laterale, sia il decorso settale che quello interarterioso sembrerebbero essere situati posteriormente all’arteria polmonare e anteriormente all’aorta quando, in realtà, il decorso settale è situato caudalmente ad entrambi i vasi.53
Sono state riportate anche diverse caratteristiche angiografiche coronariche per il riconoscimento dell’anomalia e del suo decorso iniziale, anche prima della visualizzazione. A questo proposito, Page et al54 propongono due segni che permettono di riconoscere un’origine anomala del Cx e il suo decorso iniziale:
1. Il segno del “miocardio non infuso”. Durante l’opacizzazione selettiva della coronaria sinistra, possiamo osservare un’area avascolare nella zona posterolaterale del ventricolo sinistro che indica l’origine anomala del Cx. È necessario prima iniettare un mezzo di contrasto nel seno coronarico sinistro per escludere il coinvolgimento di ostia indipendenti dalle arterie discendenti anteriori e Cx. Tuttavia, se l’identificazione del Cx non è chiara, dobbiamo ricordare che è più comune osservare il Cx che origina nel seno coronarico destro o nell’arteria coronaria destra che la presenza di ostia separati nel seno coronarico sinistro.55
2. Il segno della “radice aortica”. In ventriculografia, la proiezione obliqua anteriore destra mostra il contorno del Cx anomalo e segue il suo corso mentre passa dietro il seno coronarico destro (Figura 10).
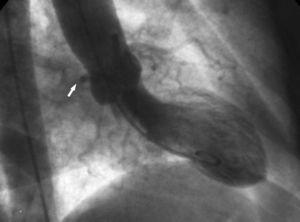
Figura 10. Ventriculografia in proiezione obliqua anteriore destra che mostra il contorno dell’arteria circonflessa anomala (freccia) che passa dietro il seno coronarico destro; questo è noto come segno della radice aortica o segno di Page.
Nel 1985, Ishikawa et al,56 seguito da Serota et al nel 1990,57 hanno proposto una serie di criteri arteriografici coronarici destinati a definire il rapporto, lungo il corso iniziale, tra il vaso anomalo e l’aorta e l’arteria polmonare (Figura 11). Questi autori tentarono di identificare i diversi percorsi sulla base dell’orientamento del “loop” formato dalla coronaria anomala con il resto dell’albero coronarico56 o applicando il concetto di “dot” (visualizzazione della colonna di contrasto della CAA che, a causa del giro che compie, adotta la morfologia di un dot57).
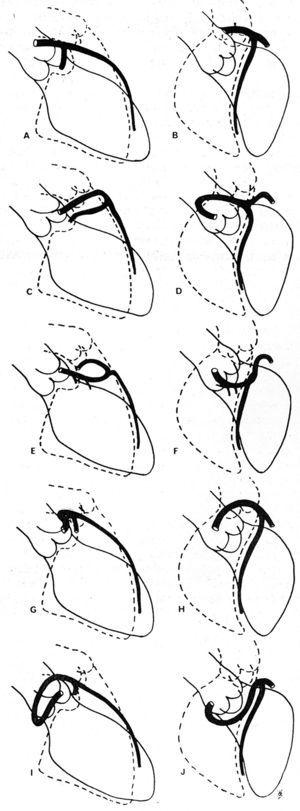
Figura 11. Illustrazioni di immagini angiografiche coronariche delle arterie coronarie discendenti anteriori sinistre e circonflesse prossimali in proiezione obliqua anteriore destra (A, C, E, G, I) e in proiezione obliqua anteriore sinistra (B, D, F, H, J), mostrando i diversi possibili percorsi iniziali di un’arteria coronaria sinistra che ha origine nel seno di Valsalva destro. A e B rappresentano una coronaria normale; C e D mostrano “loop” anterocranico, descritto nel corso anteriore; E e F: “loop” anterocaudale, corso settale; G e H: “loop” posterocranico, corso interarterioso; I e J: “loop” posterocaudale, corso retroaortico. Tratto da Ishikawa et al.56
In molti casi, l’identificazione del decorso iniziale della CAA per mezzo dell’angiografia coronarica è difficile poiché questa tecnica fornisce una visione bidimensionale dell’albero coronarico, che è una struttura tridimensionale complessa. Il cardiologo interventista esperto nella diagnosi di CAA, l’angiografia coronarica può essere sufficiente per la corretta identificazione del corso. Tuttavia, data la loro bassa incidenza, la maggior parte dei cardiologi interventisti ha un’esperienza limitata nello studio della CAA. Così, nella stragrande maggioranza dei casi, non sono descritti correttamente. In un recente registro che ha coinvolto 13 ospedali spagnoli, il decorso iniziale del CAA riportato non è stato identificato nella maggior parte dei casi.16
Quindi, in molte occasioni, l’identificazione del decorso iniziale di un CAA con origine nel seno sbagliato richiede una tecnica di imaging supplementare. Come abbiamo detto sopra, sia la TTE che la TEE possono essere impiegate a questo scopo ma, data la crescente disponibilità nei nostri ospedali di tecniche non invasive che forniscono una definizione più corretta ed esatta dell’anatomia coronarica e del suo rapporto con le strutture adiacenti in pazienti che possono essere candidati alla chirurgia, optiamo per la CMRI o la TC multidetettore.35,37,47,49
Qual è il migliore approccio terapeutico?
Questo è uno degli aspetti più controversi di questa condizione, poiché non sono state stabilite linee guida ufficiali a questo proposito.
Una volta che la CAA è stata diagnosticata e caratterizzata, sembrerebbe logico cercare di determinare se sta provocando o meno l’ischemia miocardica. Se il paziente ha avuto un infarto miocardico (senza alcuna relazione dimostrabile con l’aterosclerosi) o è stato sottoposto a rianimazione per morte improvvisa attribuibile all’anomalia e ha meno di 35 anni, la maggior parte degli autori raccomanda la rivascolarizzazione.24,26,35
Un test da sforzo al tallio o un’ecocardiografia sotto stress farmacologico o da sforzo che dimostri un’ischemia reversibile nel territorio dell’anomalia aiuterà nel processo decisionale.36
Cosa si deve fare nel caso di individui giovani e asintomatici in cui la CAA viene scoperta incidentalmente se i criteri di rischio sono soddisfatti, ma il test da sforzo non produce alcuna prova di ischemia? In primo luogo, il paziente dovrebbe adottare uno stile di vita sedentario.26,35
Corrado et al hanno confrontato la morte improvvisa in giovani atleti e non atleti e solo quelli attribuiti alla CAA o alla displasia aritmogena del ventricolo destro erano associati allo sforzo.58 Per quanto riguarda il trattamento, la rivascolarizzazione è controversa, ma ci sono autori che optano per questo approccio poiché, in questi pazienti, la morte improvvisa è imprevedibile e può essere il primo segno di CAA.24,26,34,35 Alcuni autori sostengono visite annuali di follow-up in questi casi, con ecocardiogrammi o test da sforzo al tallio, e basano le loro decisioni sui risultati.7,36 Dopo il trattamento chirurgico, i pazienti godono di uno stile di vita normale, compresa la partecipazione allo sport.25,34,49
Nei pazienti oltre i 35 anni di età, le decisioni devono essere prese su base individuale. Il rischio di morte improvvisa è minore ma, poiché la CAA può provocare un’ischemia miocardica sintomatica, in alcuni casi si esegue una rivascolarizzazione (Figura 12).24,26
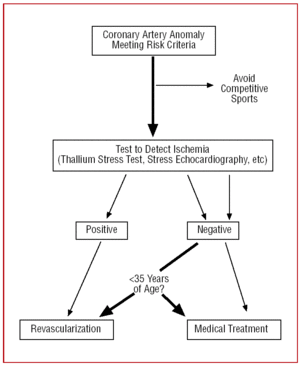
Figura 12. Protocollo terapeutico proposto per le anomalie coronariche con origine nel seno di Valsalva controlaterale in presenza di fattori di rischio.
Alcuni gruppi stanno studiando l’utilizzo di alcuni protocolli diagnostici (ecocardiografia intracoronarica per valutare l’ostio coronarico anomalo a riposo e dopo infusione di dobutamina o sovraccarico di liquidi)59 o l’utilizzo di fili di pressione intracoronarica per rilevare l’ischemia.60
Come si può osservare, fino a quando non saranno stabilite linee guida ufficiali in materia, l’approccio più ragionevole sembrerebbe essere, in primo luogo, confermare se l’età del paziente e l’anatomia della CAA sono associate al rischio e, in secondo luogo, verificare che l’ischemia coronarica (presentata dal paziente o dimostrata) sia chiaramente provocata dall’anomalia.
COME SI DEVE EFFETTUARE LA RIVASCOLARIZZAZIONE?
Logicamente, è necessario trattare ogni caso su base individuale secondo l’anatomia coronarica; quindi, la rivascolarizzazione può essere chirurgica o percutanea.
La rivascolarizzazione chirurgica comporta il bypass aortocoronarico, il reimpianto ostiale o la tecnica dell’unroofing, che libera il segmento intramurale della CAA per mezzo di un’incisione nella parete condivisa dalla CAA e dall’aorta, creando così un nuovo, più ampio orifizio nel seno appropriato.61,62 Esiste una grande controversia sulla rivascolarizzazione chirurgica in questi pazienti, soprattutto nei giovani. L’innesto di bypass aortocoronarico è stato fortemente criticato7,63 a causa della sua pervietà “limitata” e dell’inevitabile flusso competitivo tra il bypass e il CAA. Così, la tecnica dell’unroofing, che sembrerebbe essere più fisiologica,62 è sempre più adottata.
L’intervento per via ercutanea, con impianto di stent nella regione della compressione tra i grandi vasi e nell’ostio anomalo, è stato eseguito in diversi casi, negli adulti, con successo a breve termine.64 Ad oggi, la rivascolarizzazione chirurgica è preferita nei pazienti giovani e la procedura percutanea viene eseguita solo negli adulti.26,62-64 Evidentemente, in entrambi i casi, è necessario un follow-up a lungo termine.
Il trattamento medico è un’opzione?
La mancanza di serie e di studi controllati rende difficile rispondere a questa domanda. Ci sono rapporti che riguardano il follow-up di 2 anni e 5 anni in pazienti che hanno rifiutato l’intervento chirurgico, in cui l’approccio è stato o la gestione dell’attesa o il trattamento con beta-bloccanti, e tra i quali non ci sono stati casi di morte improvvisa.65-68 Tuttavia, alcuni autori sostengono contro la decisione di iniziare un trattamento “per tutta la vita” nei bambini e negli adolescenti.7
MAGGIORI PROBLEMI INSOLUTI
Il vero rischio di morte improvvisa associato ad ogni anomalia è sconosciuto.5 La ragione di ciò è che il rischio è calcolato sulla base di studi autoptici, che non indicano il rischio reale di una persona che muore a causa di una CAA, ma suggeriscono la possibilità che una persona che ha avuto una morte improvvisa abbia una CAA.7 Inoltre, i rischi calcolati possono essere sovrastimati rispetto alla popolazione generale poiché sono ottenuti da serie di atleti agonisti che, come è stato riportato, hanno un rischio di morte improvvisa due volte superiore a quello di una persona sedentaria.69 Sappiamo che il rischio di morte improvvisa a causa di una CAA è maggiore nei giovani; infatti, si raccomanda un approccio terapeutico o un altro a seconda che il paziente abbia meno di 30 o 35 anni. Questi cut-off points si basano sui pochi studi che si occupano di questo argomento23,25 e, quindi, devono essere considerati puramente indicativi. Per questo motivo, l’approccio terapeutico deve essere sempre deciso su base individuale.
Se si adotta la soluzione chirurgica sopra descritta, bisogna tener conto che non esistono serie in cui il decorso dei pazienti sia stato studiato per più di due anni. All’incertezza sulla pervietà del bypass si aggiunge il possibile danno alla valvola aortica che la procedura di disostruzione può produrre. A questo proposito, ci sono rapporti di insufficienza aortica o addirittura di sostituzione della valvola in seguito a questa procedura.7,70 Dobbiamo ricordare che la chirurgia cardiaca comporta sempre il rischio di complicazioni neurologiche, la cui incidenza nei giovani è stata stimata intorno al 2,3%.71
Infine, le linee guida per la selezione degli atleti competitivi con anomalie cardiovascolari raccomandano l’esclusione dei pazienti con CAA da tutti gli sport competitivi.51 Ancora una volta, i dati di una popolazione di atleti sono stati estrapolati alla popolazione generale. In un adolescente, il termine “competitivo” può essere difficile da definire. Inoltre, proibire a un adolescente o a un giovane adulto di partecipare alle lezioni di ginnastica o allo sport che gli piace può causare più danni che benefici. Forse gli sport faticosi dovrebbero essere evitati, ma non uno sport meno impegnativo.7
CONCLUSIONE
Le arterie coronarie che hanno origine nel seno di Valsalva sbagliato costituiscono il gruppo di CAA più comunemente associato all’ischemia miocardica e, in particolare, alla morte improvvisa.
L’indice di sospetto di questa anomalia dovrebbe essere alto nei giovani pazienti che mostrano segni clinici di angina, dispnea o sincope da sforzo. In questi casi, la TTE dovrebbe essere eseguita nel tentativo di identificare gli ostia e il corso iniziale di entrambe le arterie coronarie.
Dovremmo definire chiaramente il corso iniziale di ogni arteria coronaria anomala, utilizzando tecniche di imaging come TTE, TEE o, preferibilmente, CT multidetettore o CMRI, secondo le caratteristiche del nostro ospedale.
Dobbiamo dare priorità alla creazione di registri nazionali e internazionali che ci permettano di determinare l’incidenza di queste anomalie, così come i tassi associati di morbilità e mortalità, la prognosi, il trattamento, le possibili influenze genetiche o ambientali e, in breve, imparare il più possibile su questo.
È necessario effettuare un follow-up a lungo termine dei pazienti che hanno subito un intervento per CAA, soprattutto i giovani. In ogni caso, la rivascolarizzazione (chirurgica o percutanea) può essere valida per i pazienti con questo tipo di malattia.
RICONOSCIMENTI
Ringraziamo il dottor Joaquín Alonso e il dottor Gabriel C. Fernández per il loro aiuto nell’ottenere le immagini della tomografia computerizzata multidetettore.