Un “minerale” è una sostanza inorganica che è composta da uno o più elementi chimici. Per definizione, un minerale deve essere:
La composizione chimica di un minerale è conosciuta come la sua composizione elementare. La maggior parte dei minerali si presentano come composti (una combinazione di vari elementi diversi). Tuttavia, alcuni minerali si presentano come elementi chimici da soli. Questi sono conosciuti come minerali nativi.
Cosa sono i cristalli?
I cristalli sono una sostanza solida che possiede una struttura cristallina organizzata che è formata da atomi. La disposizione interna degli atomi spesso risulta in facce esterne piane come quelle viste su un cristallo di quarzo, tuttavia questo non è un requisito per essere classificato come un cristallo. I cristalli possono essere classificati diversamente dai minerali a causa del fatto che alcuni materiali possono essere considerati cristalli organici. Poiché i minerali sono puramente inorganici, un cristallo organico non può essere un minerale. Per esempio, le proteine e gli zuccheri sono solidi che possono formare cristalli, ma poiché sono sostanze organiche, non possono essere classificati come minerali.

Le impurità nelle soluzioni che formano i cristalli possono provocare cambiamenti di colore e alterazioni significative della struttura cristallina. Troppe impurità all’interno di un reticolo cristallino durante la cristallizzazione possono produrre cristalli con inclusioni da piccole a grandi. Queste inclusioni possono anche alterare la forma del cristallo.
Minerali, cristalli o rocce?
La maggior parte dei minerali si presenta in natura come cristalli, tuttavia non tutti i cristalli sono minerali poiché i cristalli organici non sono affatto minerali. Un minerale con la stessa formula chimica può formare più di un tipo di cristallo. Per esempio, ci sono tre polimorfi (stessa formula chimica, strutture cristalline diverse) di carbonato di calcio che sono conosciuti come calcite, aragonite e vaterite. I cristalli di calcite si presentano nel sistema trigonale, quelli di aragonite appartengono al sistema ortorombico e quelli di vaterite si formano nel sistema esagonale. Queste strutture cristalline possono variare durante la formazione come risultato di diversi fattori che includono impurità che inibiscono i modelli di crescita, la temperatura dell’ambiente durante la formazione, la saturazione dei minerali all’interno della soluzione, la geometria dei legami covalenti e i cambiamenti nel movimento della soluzione.
I minerali hanno una struttura atomica organizzata e formata naturalmente con una composizione chimica specifica. I cristalli per la maggior parte condividono queste caratteristiche, tuttavia gli atomi sono disposti in un modello ripetitivo che risulta in un reticolo cristallino, spesso presentandosi con facce di cristallo.
Molte volte sentirete la gente chiamare minerali o cristalli, rocce, tuttavia una “roccia” è definita come un aggregato legato di minerali, mineraloidi o frammenti di altre rocce. La parola “legato” significa che l’aggregazione di minerali deve essere in un certo senso cementata insieme. Per esempio, la sabbia non è considerata una roccia anche se nella maggior parte dei casi i grani di sabbia sono aggregati insieme. L’arenaria per esempio è diventata una roccia perché i grani di sabbia sono stati cementati insieme da minerali a grana più fine e/o da materiale organico, formando una massa relativamente solida.
Le tre principali classificazioni di rocce sono ignee, metamorfiche e sedimentarie.
Rock igneo – Roccia che si è formata dal raffreddamento e dalla cristallizzazione del magma all’interno o sopra la litosfera (crosta terrestre). I cristalli si formano all’interno del magma quando comincia a solidificarsi, di cui la velocità di raffreddamento può dettare la dimensione dei cristalli che si formano.

Una vista ravvicinata del granito porfirico, un tipo di roccia ignea. Il granito porfirico si verifica quando la temperatura di raffreddamento del magma cambia rapidamente. In questo caso, grandi cristalli sono stati lasciati formare con un lento raffreddamento, solo per essere interrotti da un improvviso cambiamento di temperatura decrescente che ha accelerato il processo di cristallizzazione, dando luogo a cristalli più piccoli.
Rock sedimentario – Roccia che si è formata come risultato di materiali erosi da rocce formate in precedenza che si sono depositate lungo i fondali oceanici, i letti dei fiumi, i letti dei laghi, ecc, insieme al deposito di minerali dall’acqua. Nel corso degli anni questi depositi vengono compattati dalle forze naturali, per poi solidificarsi in una massa solida (roccia).

Questa è una formazione di roccia sedimentaria che fa parte di Zabriskie Point, situato nella Death Valley, California. È composta da sedimenti del lago Furnace Creek che si è prosciugato circa 5 milioni di anni fa. Milioni di anni di erosione hanno lasciato gli strati di sedimenti esposti.
Rock metamorfico – Rock che si è verificato quando le rocce sedimentarie o ignee esistenti sono state esposte a pressioni e in alcuni casi a cambiamenti di temperatura che hanno alterato la loro mineralogia originale.

Rete metamorfica conosciuta come “gneiss di granito”. Formata da granito metamorfosato.
Come si formano i cristalli inorganici?
I cristalli possono formarsi da una varietà di processi diversi, tra cui:
Depositi di evaporite – Queste sono formazioni minerali che si presentano come risultato di processi sulla superficie terrestre. I cristalli si formano da soluzioni contenenti minerali che si concentrano per disidratazione/evaporazione di una soluzione acquosa. Mentre il fluido viene lentamente rimosso per evaporazione, i minerali concentrati si riuniscono e precipitano dall’acqua in un modello strutturato che si sviluppa in un cristallo. Un esempio di depositi di precipitazione sono i cristalli di halite rosa del Seamless Lake a Trona, California.
Depositi di minerali secondari – Questi si formano dal processo di esposizione dell’acqua ai minerali primari, dalla deposizione da soluzioni idrotermali o sono formati dalla cristallizzazione del magma.
- Esposizione ai minerali primari – L’acqua che è introdotta nei minerali esposti (tipicamente all’interno di una cavità) per percolazione verso il basso attraverso le rocce. Questo può iniziare processi chimici che rompono il minerale e ridistribuiscono i minerali lungo le pareti della cavità aperta. L’azurite e la malachite sono buoni esempi di questo, dove le soluzioni acquose si sono spostate attraverso aree di minerali primari di rame e li hanno ridistribuiti come cristalli di azurite e malachite i cui requisiti di formazione includono acqua, carbonati e rame.
- Il deposito di fluidi idrotermali – nella maggior parte dei casi si verifica quando i fluidi idrotermali si fanno strada verso l’alto attraverso la roccia, raccogliendo minerali all’interno della roccia circostante nel processo. Quando una cavità aperta si presenta a questi fluidi, la precipitazione dei minerali può avvenire sotto forma di cristalli e/o di una massa solida. A volte i minerali all’interno della roccia circostante possono essere sostituiti, questo evento è noto come un deposito di sostituzione.
- Cristallizzazione del magma – si verifica quando il magma si raffredda e i minerali all’interno del magma iniziano a separarsi in gruppi di minerali simili e compatibili. A seconda della velocità di raffreddamento, della composizione e dell’atmosfera, le dimensioni dei cristalli possono variare significativamente. A volte il raffreddamento può avvenire troppo velocemente, con la conseguente mancanza di una struttura elementare, l’ossidiana (vetro vulcanico) ne è un esempio. Composta principalmente da SiO₂ (quarzo nella maggior parte dei casi), l’ossidiana ha una formula chimica con il potenziale per essere un cristallo/minerale, tuttavia la mancanza di struttura cristallina e la variabilità della composizione porta alla sua classificazione come mineraloide.

Il mineraloide, ossidiana.
Classi di minerali
La composizione chimica del minerale detta come si presenterà in natura. Alcune delle classi di minerali comuni in base alla loro composizione chimica sono:
Minerali nativi – Elementi che si presentano in natura con una struttura minerale distinta e nessuna combinazione con un altro elemento. Alcuni esempi di elementi che sono noti per formarsi come minerali nativi sono oro (Au), argento (Ag), zolfo (S), rame (Cu), grafite ((C) – carbonio liberamente imballato) e diamanti ((C) – carbonio densamente imballato – in genere contiene alcune impurità).

Diamante naturale grezzo

Argento nativo

Rame nativo
Ossidi – Una classe di composti chimici in cui uno ione ossigeno (O2-) fa coppia con un elemento, in molti casi un metallo caricato positivamente. Alcuni esempi sono SiO₂ – Quarzo, Fe₂O₃ – Ematite, Cu₂O – Cuprite, ecc.
Carbonati – Minerali caratterizzati dalla presenza di uno ione carbonato (CO₃2-). Tipicamente si lega a cationi metallici che nella maggior parte dei casi formano composti insolubili (non possono essere dissolti in acqua). Alcuni esempi sono CaCO₃ – Calcite/Aragonite, FeCO₃ – Siderite, ZnCO₃ – Smithsonite, ecc.
Silicati – Minerali di una famiglia di anioni che contengono sia silicio (Si) che ossigeno (O). Questi sali formano un componente importante delle rocce in tutta la litosfera (crosta terrestre). Alcuni esempi di silicati sono SiO₂ – Quarzo, AlKO₆Si₂ – Silicato di potassio e alluminio, (Fe,Mg)₂SiO₄ – Olivina, ecc.
Solfuro (Solfuro) – Anione inorganico dello zolfo che presenta la formula chimica S^2- e può coinvolgere reazioni che sono considerate abbastanza complesse. La precipitazione dei solfuri può includere reazioni con metalli pesanti in cui si formano precipitati metallici insolubili. Alcuni esempi di questi metalli pesanti che si formano dagli ioni solfuro sono FeS₂ – Pirite, CuFeS₂ – Calcopirite, PbS – Galena, ecc.
Solfati (Solfati) – Sali che si formano quando l’acido solforico (H₂SO₄) reagisce con un altro prodotto chimico. Alcuni esempi di solfati sono (Ba,Sr)SO₄ – Barite (Baryte), CaSO₄- 2H₂O – Gypsum, SrSO₄ – Celestina (Celestite), ecc.
Fosfati – Minerali caratterizzati dalla loro presenza dell’anione complesso (PO₄)^3-., la maggior parte dei quali sono considerati abbastanza rari in natura. Alcuni esempi di fosfati sono Ca5(PO₄)(OH,F,CL) – Apatite, CuAl₆(PO₄)₄(OH)₈ – 4H₂O – Turchese, Fe(II)3(PO4)₂- 8H2O – Vivianite, ecc.
Economia dei cristalli e dei minerali
In tempi moderni, perché un minerale sia considerato economicamente degno di essere estratto, deve esistere una concentrazione di minerali utili che può essere lavorata (estratta) ottenendo comunque un profitto. La concentrazione deve anche essere abbastanza alta da rendere l’estrazione un processo degno. A volte, la fine del minerale all’interno della miniera può comportare la chiusura immediata della miniera. Per questo motivo, l’estrazione mineraria può essere un affare molto rischioso dal punto di vista economico.
I metalli sono attualmente i minerali più importanti dal punto di vista economico, perché sono usati per una grande varietà di applicazioni moderne. Questi metalli sono estratti da depositi metalliferi che consistono nel minerale (minerali ricercati) e nella maggior parte dei casi nei minerali circostanti indesiderati e meno economici conosciuti come “ganga”.
Terminologia e illustrazioni
Elemento chimico – Un elemento chimico è una sostanza della materia i cui atomi contengono tutti lo stesso numero di protoni, noto come numero atomico. La tavola periodica è in un certo senso una chiave che fu messa insieme da Dimitri Mendeleev, un chimico russo, per classificare questi atomi in categorie elementari basate sul loro numero di protoni. Per esempio, un atomo di idrogeno (H) contiene un protone, un atomo di elio (He) contiene due protoni, un atomo di litio (Li) contiene tre protoni e così via.
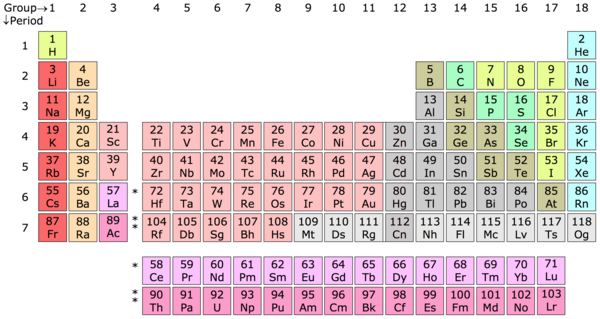
Tabella periodica
Composto chimico – Formato da molecole. Per essere considerato un composto chimico, la molecola deve essere composta da un massimo di due più elementi chimici diversi che sono legati insieme.
Atomo – La più piccola unità di un elemento chimico. Un atomo è composto da protoni, elettroni e neutroni che insieme determinano la carica dell’atomo. Gli atomi possono perdere o guadagnare elettroni, dando luogo a cariche positive e negative note come ioni.
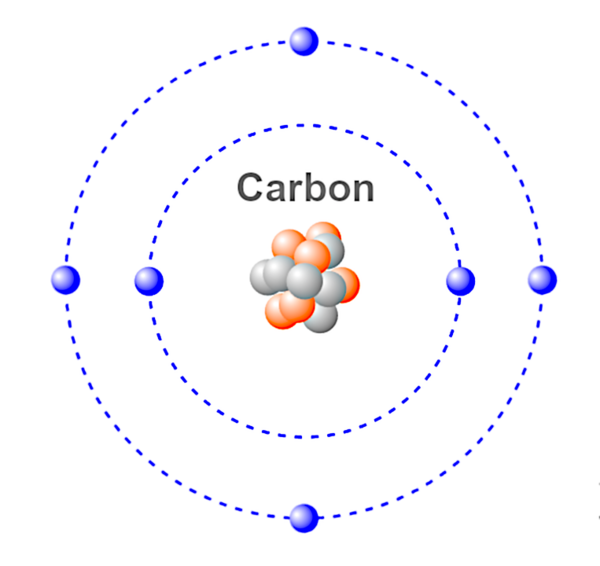
Questa è un’illustrazione di un atomo di carbonio.
Blu – Elettroni.
Rosso &Grigio – Neutroni & Protoni.
Ione – Un atomo o una molecola con una carica elettrica che risulta da una perdita o un guadagno di uno o più elettroni.
Catione – Uno ione con carica positiva che è attratto da ioni con carica negativa. Esempio – Ione idrogeno H+.
Anione – Uno ione caricato negativamente che è attratto da ioni caricati positivamente. Esempio – Lo ione carbonato è CO₃2-.
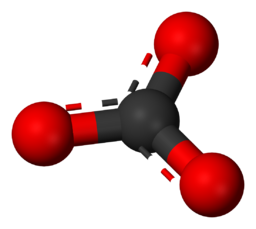
Questa immagine illustra la struttura molecolare di uno ione carbonato (CO₃2-) a livello atomico.