Obiettivi di apprendimento
- Estendere i concetti di equilibrio precedentemente introdotti agli acidi e alle basi che possono donare o accettare più di un protone
Possiamo anche usare le forze relative delle coppie acido-base coniugate per capire le proprietà acido-base delle soluzioni di sali. Una reazione di neutralizzazione può essere definita come la reazione di un acido e una base per produrre un sale e acqua. Cioè, un altro catione, come \(Na^+\), sostituisce il protone dell’acido. Un esempio è la reazione di \(\ce{CH3CO2H}}), un acido debole, con \(\ce{NaOH}), una base forte:
A seconda delle proprietà acido-base dei suoi ioni componenti, tuttavia, un sale può dissolversi in acqua per produrre una soluzione neutra, una soluzione basica, o una soluzione acida.
Quando un sale come \(NaCl\) si scioglie in acqua, produce ioni \(Na^+_{(aq)}) e \(Cl^-_{(aq)}). Usando un approccio di Lewis, lo ione \(Na^+\) può essere visto come un acido perché è un accettore di coppia di elettroni, anche se la sua bassa carica e il raggio relativamente grande lo rendono un acido molto debole. Lo ione \(Cl^-\) è la base coniugata dell’acido forte \(HCl\), quindi non ha essenzialmente carattere basico. Di conseguenza, dissolvendo \(NaCl\) in acqua non ha alcun effetto sul \(pH\) di una soluzione, e la soluzione rimane neutra.
Ora confrontiamo questo comportamento con quello delle soluzioni acquose di cianuro di potassio e acetato di sodio. Di nuovo, i cationi (\(K^+\) e \(Na^+\)) non hanno essenzialmente carattere acido, ma gli anioni (\(CN^-\) e \(CH_3CO_2^-\)) sono basi deboli che possono reagire con l’acqua perché sono le basi coniugate degli acidi deboli \(HCN\) e acido acetico, rispettivamente.
Nessuna delle due reazioni procede molto a destra come scritto perché viene favorita la formazione della coppia acido-base più debole. Sia \(HCN\) che l’acido acetico sono acidi più forti dell’acqua, e l’idrossido è una base più forte dell’acetato o del cianuro, quindi in entrambi i casi, l’equilibrio è a sinistra. Tuttavia, ognuna di queste reazioni genera abbastanza ioni idrossido per produrre una soluzione basica. Per esempio, il \ pH\ di una soluzione 0.1 M di acetato di sodio o cianuro di potassio a 25°C è 8.8 o 11.1, rispettivamente. Dalle tabelle E1 e E2, possiamo vedere che \(CN^-\) è una base più forte (\(pK_b = 4.79\)) che l’acetato (\(pK_b = 9.24\)), che è coerente con \(KCN\) che produce una soluzione più basica dell’acetato di sodio alla stessa concentrazione.
Al contrario, l’acido coniugato di una base debole dovrebbe essere un acido debole. Per esempio, il cloruro di ammonio e il cloruro di piridinio sono sali prodotti facendo reagire l’ammoniaca e la piridina, rispettivamente, con \(HCl\). Come già sai, lo ione cloruro è una base così debole che non reagisce con l’acqua. Al contrario, i cationi dei due sali sono acidi deboli che reagiscono con l’acqua come segue:
La figura \(\PageIndex{2}\ mostra che \(H_3O^+) è un acido più forte di \(NH_4^+) o \(C_5H_5NH^+), e viceversa, ammoniaca e piridina sono entrambe basi più forti dell’acqua. L’equilibrio sarà quindi molto a sinistra in entrambi i casi, favorendo la coppia acido-base più debole. La concentrazione di \(H_3O^+) prodotta dalle reazioni è abbastanza grande, tuttavia, da diminuire il \(pH) della soluzione in modo significativo: il \(pH) di una soluzione 0,10 M di cloruro di ammonio o cloruro di piridinio a 25°C è 5,13 o 3,12, rispettivamente.
Cosa succede con soluzioni acquose di un sale come l’acetato di ammonio, dove sia il catione che l’anione possono reagire separatamente con l’acqua per produrre rispettivamente un acido e una base? Secondo la figura 16.10, lo ione ammonio abbasserà il \(pH\), mentre secondo la figura 16.9, lo ione acetato alzerà il \(pH\). Questo caso particolare è insolito, in quanto il catione è un acido forte quanto l’anione è una base (pKa ≈ pKb). Di conseguenza, i due effetti si annullano e la soluzione rimane neutra. Con sali in cui il catione è un acido più forte di quanto l’anione sia una base, la soluzione finale ha un \(pH\) < 7,00. Al contrario, se il catione è un acido più debole dell’anione è una base, la soluzione finale ha un \(pH) > 7.00.
Ioni metallici acidi
Le soluzioni di sali semplici di ioni metallici possono anche essere acide, anche se uno ione metallico non può donare un protone direttamente all’acqua per produrre \(H_3O^+\). Invece, uno ione metallico può agire come un acido di Lewis e interagire con l’acqua, una base di Lewis, coordinandosi a una coppia solitaria di elettroni sull’atomo di ossigeno per formare uno ione metallico idrato (figura \(\PageIndex{1a}). Una molecola d’acqua coordinata a uno ione metallico è più acida di una molecola d’acqua libera per due motivi. In primo luogo, le interazioni elettrostatiche repulsive tra lo ione metallico caricato positivamente e gli atomi di idrogeno parzialmente caricati positivamente della molecola d’acqua coordinata rendono più facile per l’acqua coordinata perdere un protone.
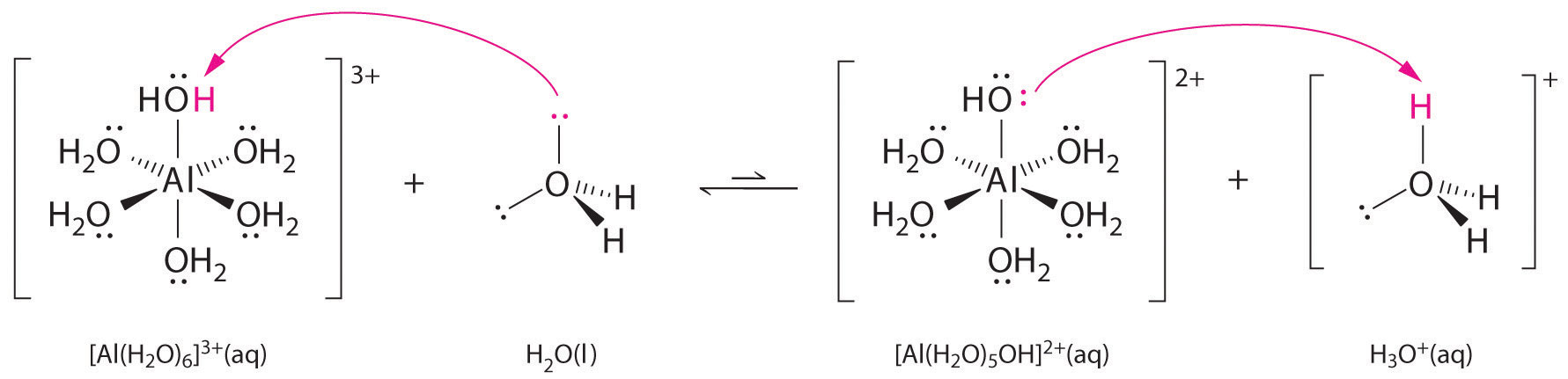
In secondo luogo, la carica positiva dello ione \(Al^{3+}) attira la densità di elettroni dagli atomi di ossigeno delle molecole d’acqua, che diminuisce la densità di elettroni nei legami \ce{O-H}, come mostrato nella figura \(\PageIndex{1b}). Con meno densità di elettroni tra gli atomi di \O e gli atomi di H, i legami \ce{O-H} sono più deboli che in una molecola libera di \H_2O, rendendo più facile perdere uno ione \H^+\.
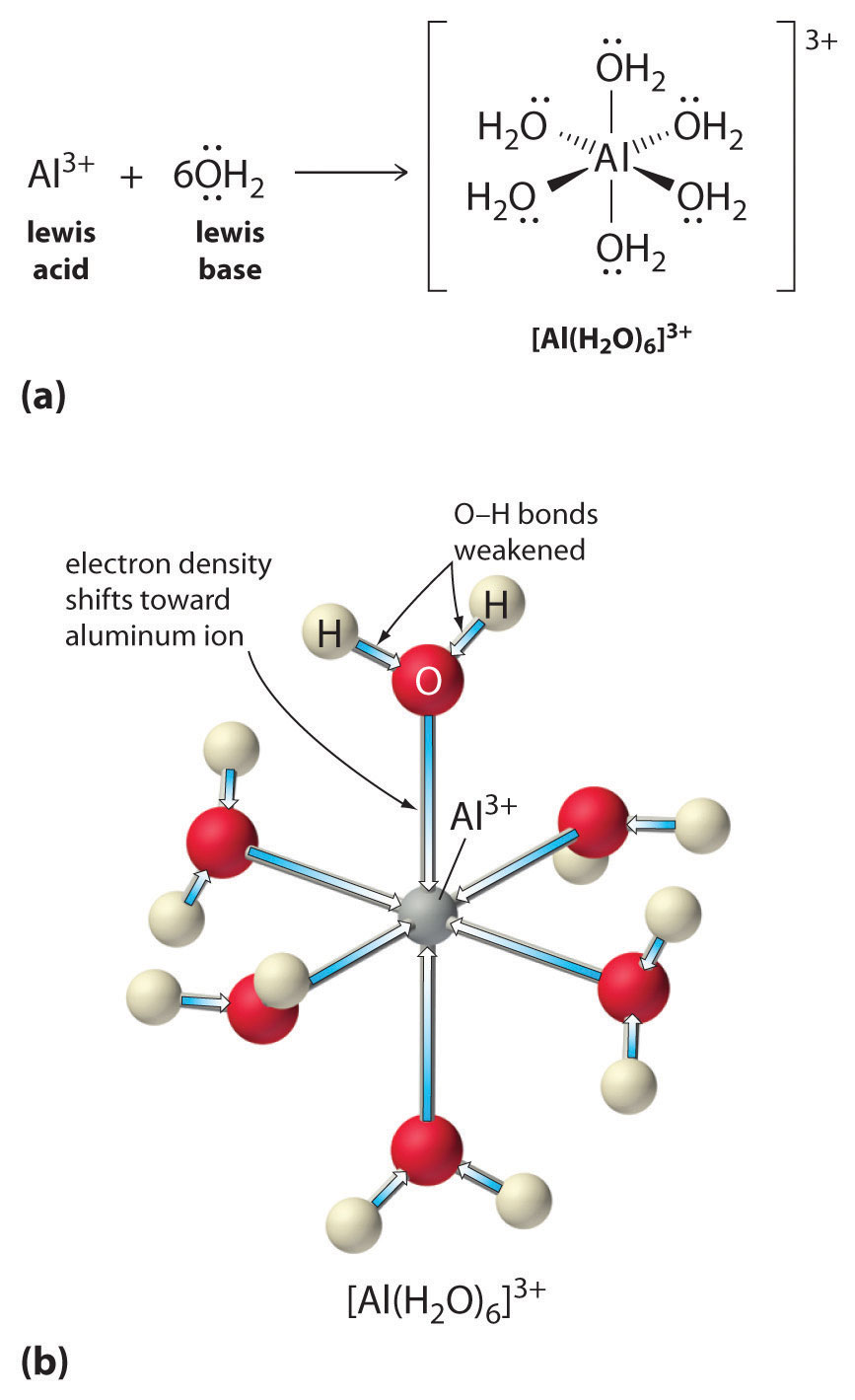
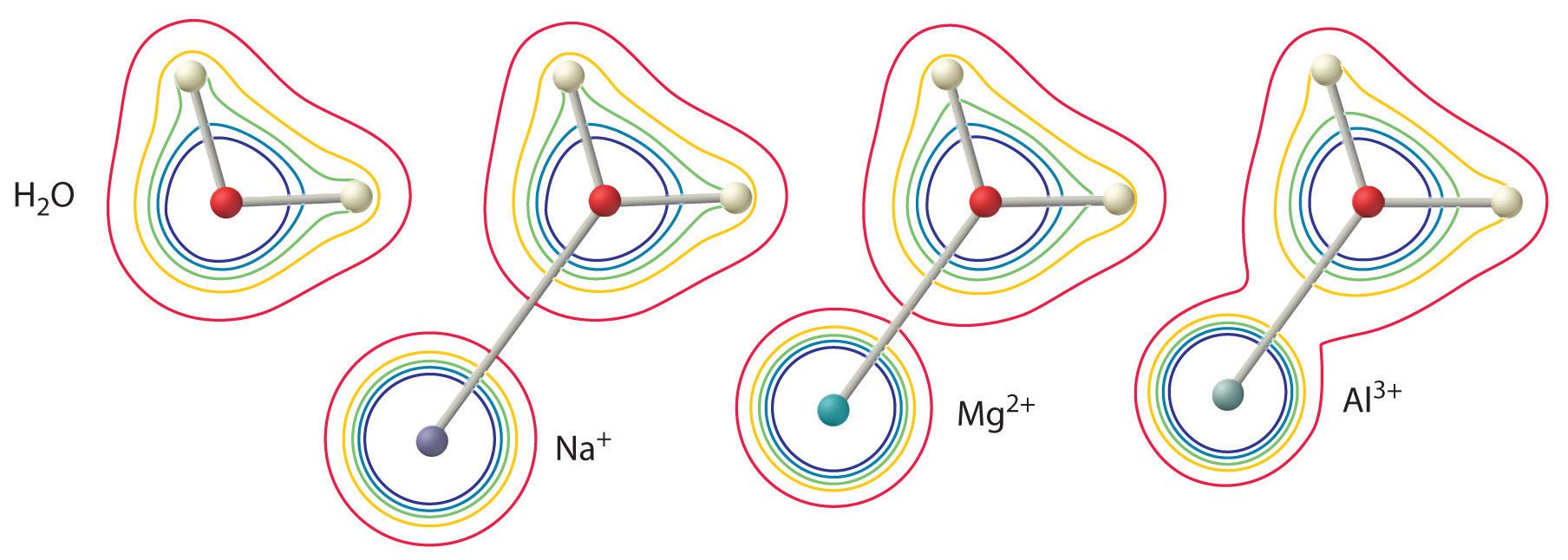
La grandezza di questo effetto dipende dai seguenti due fattori (Figura \PageIndex{3}):
- La carica sullo ione metallo. Uno ione divalente (\M^{2+}) ha approssimativamente un effetto doppio sulla densità di elettroni in una molecola d’acqua coordinata rispetto ad uno ione monovalente (\M^+) dello stesso raggio.
- Il raggio dello ione metallico. Per gli ioni metallici con la stessa carica, più piccolo è lo ione, più corta è la distanza internucleare dall’atomo di ossigeno della molecola d’acqua e maggiore è l’effetto del metallo sulla distribuzione della densità elettronica nella molecola d’acqua.
Quindi le soluzioni acquose di piccoli ioni metallici altamente carichi, come \(Al^{3+}) e \(Fe^{3+}), sono acide:
{^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)}
Lo ione \(^{3+}) ha un \(pK_a\) di 5.0, che lo rende quasi un acido forte come l’acido acetico. A causa dei due fattori descritti in precedenza, il parametro più importante per prevedere l’effetto di uno ione metallico sull’acidità delle molecole d’acqua coordinate è il rapporto carica-raggio dello ione metallico. Un certo numero di coppie di ioni metallici che si trovano su una linea diagonale nella tavola periodica, come ad esempio \(Li^+\) e \(Mg^{2+\) o \(Ca^{2+\) e \(Y^{3+\), hanno dimensioni e cariche diverse, ma rapporti carica-raggio simili. Di conseguenza, queste coppie di ioni metallici hanno effetti simili sull’acidità delle molecole d’acqua coordinate, e spesso mostrano anche altre significative somiglianze nella chimica.
Ioni metallici acidi
Le soluzioni di piccoli ioni metallici altamente carichi in acqua sono acide.
Reazioni come quelle discusse in questa sezione, in cui un sale reagisce con acqua per dare una soluzione acida o basica, sono spesso chiamate reazioni di idrolisi. Usare un nome separato per questo tipo di reazione è spiacevole perché suggerisce che sono in qualche modo diverse. Infatti, le reazioni di idrolisi sono solo reazioni acido-base in cui l’acido è un catione o la base è un anione; obbediscono agli stessi principi e regole di tutte le altre reazioni acido-base.
Idrolisi
Una reazione di idrolisi è una reazione acido-base.
Esempio \(\PageIndex{1})
Predici se le soluzioni acquose di questi composti sono acide, basiche o neutre.
- \(KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Dato: composto
Chiesto: acidità o basicità della soluzione acquosa
Strategia:
- Valuta le proprietà acido-base del catione e dell’anione. Se il catione è un debole acido di Lewis, non influenzerà il \(pH\) della soluzione. Se il catione è l’acido coniugato di una base debole o di un catione metallico relativamente molto carico, tuttavia, reagirà con l’acqua per produrre una soluzione acida.
- Se l’anione è la base coniugata di un acido forte, non influenzerà il \(pH\) della soluzione. Se, invece, l’anione è la base coniugata di un acido debole, la soluzione sarà basica.
Soluzione:
a
- Il catione \(K^+\) ha una piccola carica positiva (+1) e un raggio relativamente grande (perché è nella quarta fila della tavola periodica), quindi è un acido di Lewis molto debole.
- L’anione \(NO_3-\) è la base coniugata di un acido forte, quindi non ha essenzialmente carattere basico (Tabella 16.1). Quindi né il catione né l’anione reagiranno con l’acqua per produrre \(H^+\) o \(OH^-\), e la soluzione sarà neutra.
b.
- Lo ione \(Cr^{3+\) è un catione metallico relativamente molto carico che dovrebbe comportarsi in modo simile allo ione \(Al^{3+\) e formare il complesso 3+, che si comporta come un acido debole: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}]
- L’anione \(Br^-\) è una base molto debole (è la base coniugata dell’acido forte \(HBr\)), quindi non influenza il \(pH\) della soluzione. Quindi la soluzione sarà acida.
c.
- Lo ione \(Na^+\), come il \(K^+\), è un acido molto debole, quindi non dovrebbe influenzare l’acidità della soluzione.
- Al contrario, \(SO_4^{2-}\ è la base coniugata di \(HSO_4^-\), che è un acido debole. Quindi lo ione \(SO_4^{2-}- reagirà con l’acqua come mostrato in Figura 16.6 per dare una soluzione leggermente basica.
Esercizio \(\PageIndex{1})
Prevedere se le soluzioni acquose delle seguenti sono acide, basiche o neutre.
- (KI)
- (Mg(ClO_4)_2)
- (NaHS)
Risposta a
neutrale
Risposta b
acido
Risposta c
basico (a causa la reazione di \(HS^-\) con l’acqua per formare \(H_2S\) e \(OH^-\))
Sommario
Un sale può dissolversi in acqua per produrre una soluzione neutra, una soluzione neutra, basica o acida, a seconda che contenga la base coniugata di un acido debole come anione (\(A^-\)), l’acido coniugato di una base debole come catione (\(BH^+\)), o entrambi. I sali che contengono piccoli ioni metallici molto carichi producono soluzioni acide in acqua. La reazione di un sale con l’acqua per produrre una soluzione acida o basica è chiamata reazione di idrolisi.