Objetivos de aprendizaje
- Relacionar las configuraciones electrónicas de los elementos con la forma de la tabla periódica.
- Determinar la configuración electrónica esperada de un elemento por su lugar en la tabla periódica.
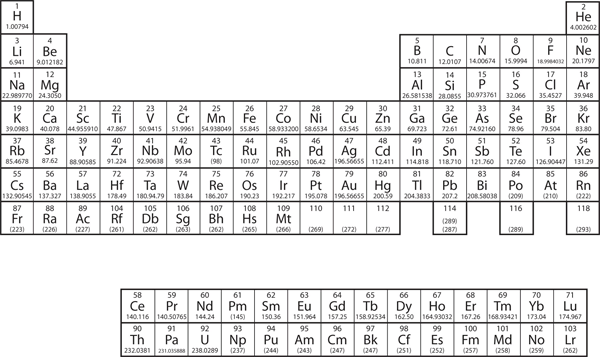
En el capítulo 3 «Átomos, moléculas e iones», introdujimos la tabla periódica como herramienta para organizar los elementos químicos conocidos. En la figura 8.11 «La tabla periódica» se muestra una tabla periódica. Los elementos se enumeran por número atómico (el número de protones en el núcleo), y los elementos con propiedades químicas similares se agrupan en columnas.
Figura 8.11 La tabla periódica
¿Por qué la tabla periódica tiene la estructura que tiene? La respuesta es bastante sencilla, si se entienden las configuraciones electrónicas: la forma de la tabla periódica imita el llenado de las subcubiertas con electrones.
Empecemos con el H y el He. Sus configuraciones electrónicas son 1s1 y 1s2, respectivamente; en el caso del He, la capa n = 1 está llena. Estos dos elementos forman la primera fila de la tabla periódica (véase la figura 8.12 «El 1»).
Figura 8.12 La subcapa 1s
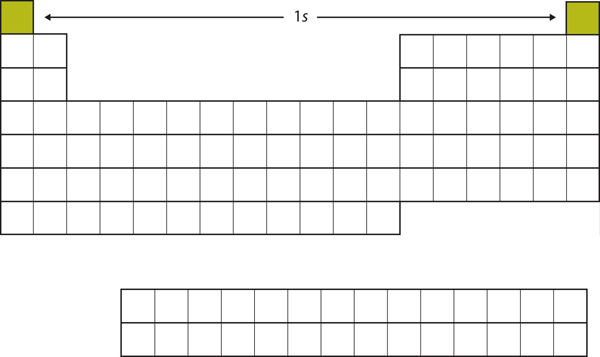
El H y el He representan el llenado de la subcapa 1s.
Los siguientes dos electrones, para el Li y el Be, irían a la subcapa 2s. La figura 8.13 «El 2» muestra que estos dos elementos son adyacentes en la tabla periódica.
Figura 8.13 La subcapa 2s
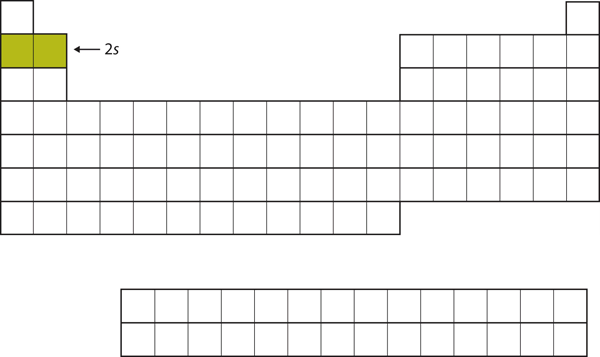
En el Li y el Be, la subcapa 2s está siendo ocupada.
Para los siguientes seis elementos, la subcapa 2p está siendo ocupada con electrones. En el lado derecho de la tabla periódica, estos seis elementos (del B al Ne) están agrupados (Figura 8.14 «El 2»).
Figura 8.14 La subcapa 2p
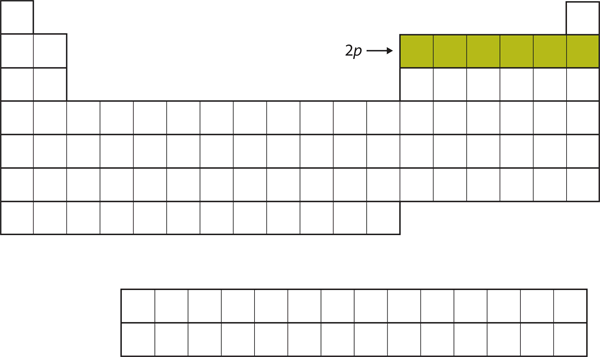
Para los elementos del B al Ne, la subcapa 2p está ocupada.
La siguiente subcapa que se llena es la subcapa 3s. Los elementos cuando se está llenando este subesqueleto, Na y Mg, están de vuelta en el lado izquierdo de la tabla periódica (Figura 8.15 «El 3»).
Figura 8.15 La subcapa 3s
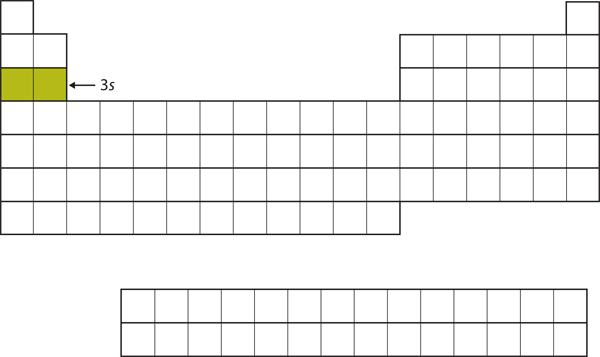
Ahora la subcapa 3s está siendo ocupada.
A continuación, la subcapa 3p se llena con los siguientes seis elementos (Figura 8.16 «El 3»).
Figura 8.16 La subcapa 3p
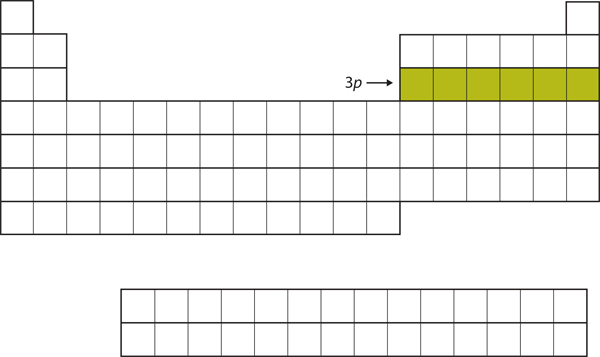
A continuación, la subcapa 3p se llena de electrones.
En lugar de llenar la subcapa 3d a continuación, los electrones pasan a la subcapa 4s (Figura 8.17 «El 4»).
Figura 8.17 La subcapa 4s
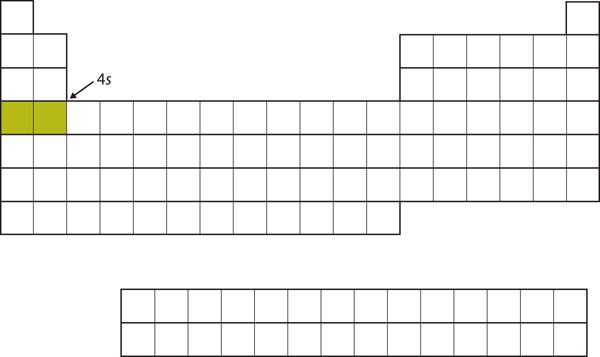
La subcapa 4s se llena antes que la subcapa 3d. Esto se refleja en la estructura de la tabla periódica.
Después de llenarse la subcapa 4s, la subcapa 3d se llena con hasta 10 electrones. Esto explica la sección de 10 elementos en el centro de la tabla periódica (Figura 8.18 «El 3»).
Figura 8.18 La subcapa 3d
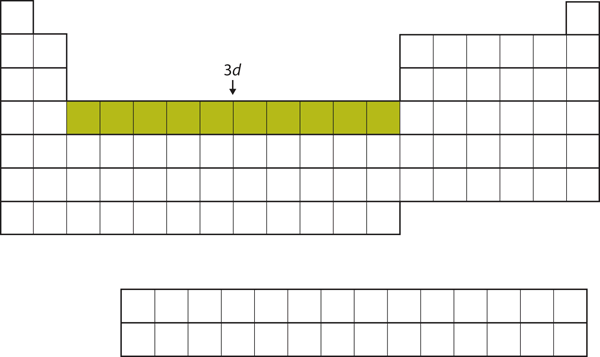
La subcapa 3d se llena en la sección central de la tabla periódica.
Y así sucesivamente. A medida que avanzamos por las filas de la tabla periódica, la forma general de la tabla describe cómo los electrones están ocupando las cáscaras y las subcáscaras.
Las dos primeras columnas del lado izquierdo de la tabla periódica son las que ocupan las subcáscaras s. Por ello, las dos primeras filas de la tabla periódica se denominan bloque s. Del mismo modo, el bloque p son las seis columnas más a la derecha de la tabla periódica, el bloque d son las 10 columnas centrales de la tabla periódica, mientras que el bloque f es la sección de 14 columnas que normalmente se representa como separada del cuerpo principal de la tabla periódica. Podría formar parte del cuerpo principal, pero entonces la tabla periódica sería bastante larga y engorrosa. La figura 8.19 «Bloques de la tabla periódica» muestra los bloques de la tabla periódica.
Figura 8.19 Bloques de la tabla periódica
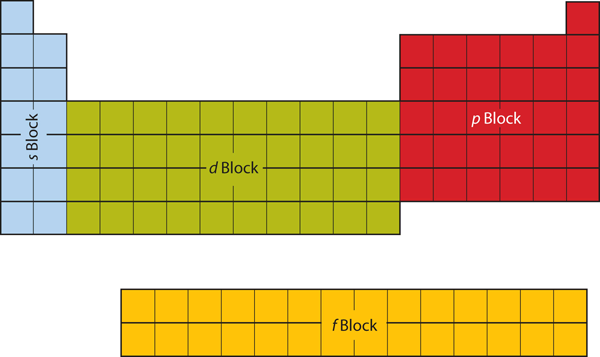
La tabla periódica se separa en bloques dependiendo de qué subcapa se está llenando para los átomos que pertenecen a esa sección.
Los electrones de la capa más alta, más los electrones de la última subcapa sin rellenar, se llaman electrones de valencia; la capa más alta se llama capa de valencia. (Los electrones de valencia controlan en gran medida la química del átomo. Si nos fijamos sólo en la configuración de los electrones de la capa de valencia, encontramos que en cada columna, la configuración de los electrones de la capa de valencia es la misma. Por ejemplo, tomemos los elementos de la primera columna de la tabla periódica: H, Li, Na, K, Rb y Cs. Sus configuraciones electrónicas (abreviadas para los átomos más grandes) son las siguientes, con la configuración electrónica de la capa de valencia resaltada:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Todos ellos tienen una configuración electrónica similar en sus capas de valencia: un solo electrón s. Dado que gran parte de la química de un elemento está influida por los electrones de valencia, cabría esperar que estos elementos tuvieran una química similar, y así es. La organización de los electrones en los átomos explica no sólo la forma de la tabla periódica sino también el hecho de que los elementos de la misma columna de la tabla periódica tengan una química similar.
El mismo concepto se aplica a las otras columnas de la tabla periódica. Los elementos de cada columna tienen las mismas configuraciones electrónicas de la capa de valencia, y los elementos tienen algunas propiedades químicas similares. Esto es estrictamente cierto para todos los elementos de los bloques s y p. En los bloques d y f, debido a que hay excepciones en el orden de llenado de las subcáscaras con electrones, la similitud de las cáscaras de valencia no es absoluta en estos bloques. Sin embargo, existen muchas similitudes en estos bloques, por lo que se espera una similitud en las propiedades químicas.
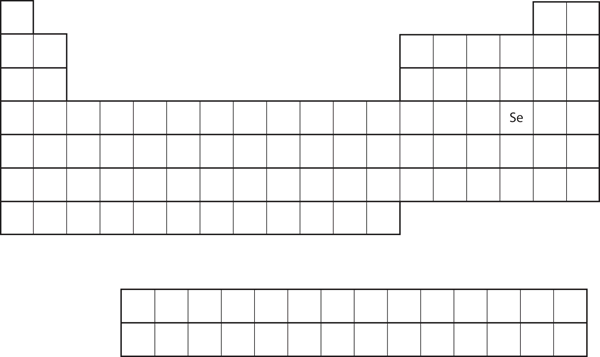
La similitud de la configuración de los electrones de la capa de valencia implica que podemos determinar la configuración de los electrones de un átomo únicamente por su posición en la tabla periódica. Consideremos el Se, como se muestra en la figura 8.20 «El selenio en la tabla periódica». Se encuentra en la cuarta columna del bloque p. Esto significa que su configuración electrónica debería terminar en una configuración electrónica p4. Efectivamente, la configuración electrónica del Se es 4s23d104p4, como se esperaba.
Figura 8.20 El selenio en la tabla periódica
Ejemplo 8
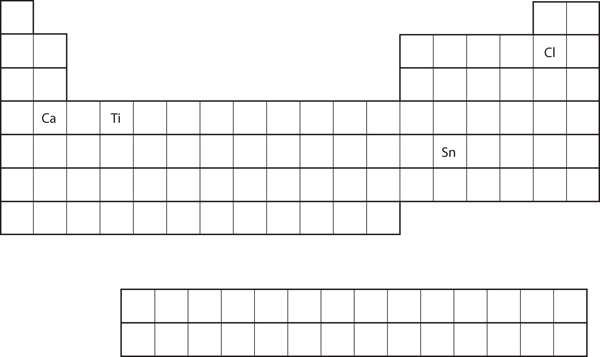
A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de la capa de valencia de cada átomo. Vea la figura 8.21 «Varios elementos en la tabla periódica».
- Ca
- Sn
Solución
- Ca se encuentra en la segunda columna del bloque s. Es de esperar que su configuración electrónica termine en s2. La configuración electrónica del calcio es 4s2.
- El Sn se encuentra en la segunda columna del bloque p, por lo que esperamos que su configuración electrónica termine en p2. La configuración electrónica del estaño es 5s24d105p2.
Ponte a prueba
A partir de la posición del elemento en la tabla periódica, predice la configuración electrónica de la capa de valencia de cada átomo. Vea la Figura 8.21 «Varios elementos en la tabla periódica».
- Ti
Cl
Respuesta
- 4s23d2 3s23p5
Figura 8.21 Varios elementos de la tabla periódica
App: Colores artificiales
El color de los objetos proviene de un mecanismo diferente al de los colores del neón y otras luces de descarga. Aunque las luces de color producen sus colores, los objetos son de color porque reflejan preferentemente un determinado color de la luz blanca que los ilumina. Un tomate rojo, por ejemplo, es de color rojo brillante porque refleja la luz roja mientras absorbe todos los demás colores del arco iris.
Muchos alimentos, como los tomates, son muy coloreados; de hecho, la afirmación común «primero se come con los ojos» es un reconocimiento implícito de que el atractivo visual de los alimentos es tan importante como su sabor. Pero, ¿qué ocurre con los alimentos procesados?
Muchos alimentos procesados tienen colorantes añadidos. Hay dos tipos de colorantes alimentarios: naturales y artificiales. Los colorantes naturales incluyen el azúcar caramelizado para el color marrón; el achiote, la cúrcuma y el azafrán para varios tonos de naranja o amarillo; la betanina de la remolacha para el color púrpura; e incluso el carmín, un tinte rojo intenso que se extrae de la cochinilla, un pequeño insecto que es un parásito de los cactus en América Central y del Sur. (Así es: ¡puedes estar comiendo jugo de insectos!)
Algunos colorantes son artificiales. En Estados Unidos, la Administración de Alimentos y Medicamentos (FDA) sólo aprueba actualmente siete compuestos como colorantes artificiales en alimentos, bebidas y cosméticos:
- FD&C Azul #1: Azul Brillante FCF
- FD&C Azul #2: Indigotina
- FD&C Verde #3: Verde rápido FCF
- RD&C Rojo #3: Eritrosina
- FD&C Rojo #40: Rojo Allura AC
- FD&C Amarillo #5: Tartrazina
- FD&C Amarillo #6: Sunset Yellow FCF
Los colorantes con números más bajos ya no están en el mercado o han sido retirados por diversas razones. Normalmente, estos colorantes artificiales son moléculas grandes que absorben ciertos colores de la luz con mucha fuerza, lo que los hace útiles incluso en concentraciones muy bajas en alimentos y cosméticos. Incluso en cantidades tan bajas, algunos críticos afirman que una pequeña parte de la población (especialmente los niños) es sensible a los colorantes artificiales e instan a que se reduzca o se detenga su uso. Sin embargo, los estudios formales sobre los colorantes artificiales y sus efectos en el comportamiento no han sido concluyentes o son contradictorios. A pesar de ello, la mayoría de la gente sigue disfrutando de los alimentos procesados con colorantes artificiales (como los que se muestran en la figura adjunta).

Los colorantes alimentarios artificiales se encuentran en una gran variedad de productos alimenticios, como los alimentos procesados, los caramelos y los tintes para huevos. Incluso los alimentos para mascotas contienen colorantes alimentarios artificiales, aunque es probable que al animal no le importe
Fuente: Foto por cortesía de Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Las claves
- La disposición de los electrones en los átomos es responsable de la forma de la tabla periódica.
- Las configuraciones de los electrones pueden predecirse por la posición de un átomo en la tabla periódica.
Ejercicios
-
¿En qué lugar de la tabla periódica están ocupando los electrones las subcubiertas s?
-
¿En qué lugar de la tabla periódica se encuentran las subcubiertas d ocupadas por electrones?
-
¿En qué bloque se encuentra Ra?
-
¿En qué bloque se encuentra Br?
-
¿Cuáles son las configuraciones electrónicas de la capa de valencia de los elementos de la segunda columna de la tabla periódica?
-
¿Cuáles son las configuraciones electrónicas de la capa de valencia de los elementos de la penúltima columna de la tabla periódica?
-
¿Cuáles son las configuraciones electrónicas de la capa de valencia de los elementos de la primera columna del bloque p?
-
¿Cuáles son las configuraciones electrónicas de la capa de valencia de los elementos de la última columna del bloque p?
-
A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) Sr
b) S
10. A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) Fe
b) Ba
11. A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) V
b) Ar
12. A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) Cl
b) K
13. A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) Ge
b) C
14. A partir de la posición del elemento en la tabla periódica, prediga la configuración electrónica de cada átomo.
a) Mg
b) I
Respuestas
las dos primeras columnas
el bloque s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2