Objetivos de aprendizaje
Al finalizar esta sección, será capaz de:
- Identificar las relaciones matemáticas entre las diversas propiedades de los gases
- Utilizar la ley combinada de los gases, y las leyes de los gases relacionadas, para calcular los valores de diversas propiedades de los gases bajo condiciones especificadas
Durante los siglos XVII y especialmente XVIII, impulsados tanto por el deseo de comprender la naturaleza como por la búsqueda de fabricar globos en los que poder volar (Figura 1), varios científicos establecieron las relaciones entre las propiedades físicas macroscópicas de los gases, es decir, la presión, el volumen, la temperatura y la cantidad de gas. Aunque sus mediciones no eran precisas según los estándares actuales, pudieron determinar las relaciones matemáticas entre los pares de estas variables (por ejemplo, presión y temperatura, presión y volumen) que se mantienen para un gas ideal, una construcción hipotética a la que se aproximan los gases reales bajo ciertas condiciones. Finalmente, estas leyes individuales se combinaron en una única ecuación -la ley de los gases ideales- que relaciona las cantidades de gas para los gases y es bastante precisa para presiones bajas y temperaturas moderadas. Consideraremos los desarrollos clave en las relaciones individuales (por razones pedagógicas, no en orden histórico), y luego los reuniremos en la ley de los gases ideales.

Figura 1. En 1783 se produjo el primer (a) vuelo en globo lleno de hidrógeno, (b) vuelo tripulado en globo de aire caliente y (c) vuelo tripulado en globo lleno de hidrógeno. Cuando el globo lleno de hidrógeno representado en (a) aterrizó, los asustados habitantes de Gonesse lo destruyeron con horcas y cuchillos. Se dice que el lanzamiento de este último fue visto por 400.000 personas en París.
Presión y temperatura: Ley de Gay-Lussac
Imagina que llenas un recipiente rígido unido a un manómetro con gas y luego lo sellas para que no pueda escapar ningún gas. Si el recipiente se enfría, el gas del interior también se enfría y se observa que su presión disminuye. Como el recipiente es rígido y está bien cerrado, tanto el volumen como el número de moles de gas permanecen constantes. Si calentamos la esfera, el gas del interior se calienta más (Figura 2) y la presión aumenta.

Figura 2. El efecto de la temperatura sobre la presión del gas: Cuando la placa caliente está apagada, la presión del gas en la esfera es relativamente baja. A medida que el gas se calienta, la presión del gas en la esfera aumenta.
Esta relación entre la temperatura y la presión se observa para cualquier muestra de gas confinada en un volumen constante. En la figura 3 se muestra un ejemplo de datos experimentales de presión-temperatura para una muestra de aire en estas condiciones. Encontramos que la temperatura y la presión están relacionadas linealmente, y si la temperatura está en la escala kelvin, entonces P y T son directamente proporcionales (de nuevo, cuando el volumen y los moles de gas se mantienen constantes); si la temperatura en la escala kelvin aumenta en un determinado factor, la presión del gas aumenta en el mismo factor.
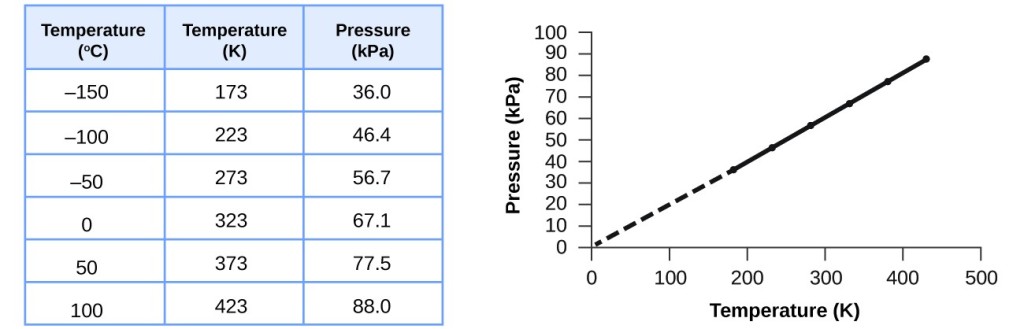
Figura 3. Para un volumen y una cantidad de aire constantes, la presión y la temperatura son directamente proporcionales, siempre que la temperatura esté en kelvin. (No se pueden realizar mediciones a temperaturas inferiores debido a la condensación del gas). Cuando esta línea se extrapola a presiones más bajas, alcanza una presión de 0 a -273 °C, que es el 0 en la escala kelvin y la temperatura más baja posible, llamada cero absoluto.
Guillaume Amontons fue el primero en establecer empíricamente la relación entre la presión y la temperatura de un gas (~1700), y Joseph Louis Gay-Lussac determinó la relación con mayor precisión (~1800). Por ello, la relación P-T de los gases se conoce como ley de Gay-Lussac o ley de Amontons. Con cualquiera de las dos denominaciones, afirma que la presión de una determinada cantidad de gas es directamente proporcional a su temperatura en la escala kelvin cuando el volumen se mantiene constante. Matemáticamente, se puede escribir:
\año P\año T
\año P=\año T
\año P=k\año T
donde ∝ significa «es proporcional a», y k es una constante de proporcionalidad que depende de la identidad, cantidad y volumen del gas.
\Nfrac{{P}_{1}}{T}_{1}}=\Nfrac{{P}_{2}}{T}{2}
Esta ecuación es útil para los cálculos de presión-temperatura para un gas confinado a volumen constante. Tenga en cuenta que las temperaturas deben estar en la escala kelvin para cualquier cálculo de la ley de los gases (0 en la escala kelvin y la temperatura más baja posible se llama cero absoluto). (También hay que tener en cuenta que hay al menos tres formas de describir cómo cambia la presión de un gas cuando cambia su temperatura: Podemos utilizar una tabla de valores, una gráfica o una ecuación matemática.)
Volumen y temperatura: Ley de Charles
Si llenamos un globo con aire y lo sellamos, el globo contiene una cantidad específica de aire a presión atmosférica, digamos 1 atm. Si metemos el globo en un frigorífico, el gas del interior se enfría y el globo se encoge (aunque tanto la cantidad de gas como su presión permanecen constantes). Si hacemos que el globo esté muy frío, se encogerá mucho, y volverá a expandirse cuando se caliente.
Este vídeo muestra cómo el enfriamiento y el calentamiento de un gas hacen que su volumen disminuya o aumente, respectivamente.
Estos ejemplos del efecto de la temperatura sobre el volumen de una cantidad dada de un gas confinado a presión constante son ciertos en general: El volumen aumenta a medida que la temperatura aumenta, y disminuye a medida que la temperatura disminuye. Los datos de volumen-temperatura para una muestra de 1 mol de gas metano a 1 atm se enumeran y grafican en la Figura 4.

Figura 4. El volumen y la temperatura están relacionados linealmente para 1 mol de gas metano a una presión constante de 1 atm. Si la temperatura está en kelvin, el volumen y la temperatura son directamente proporcionales. La línea se detiene en 111 K porque el metano se licúa a esta temperatura; cuando se extrapola, interseca el origen del gráfico, lo que representa una temperatura de cero absoluto.
La relación entre el volumen y la temperatura de una cantidad dada de gas a presión constante se conoce como ley de Charles en reconocimiento al científico francés y pionero de los vuelos en globo Jacques Alexandre César Charles. La ley de Charles establece que el volumen de una determinada cantidad de gas es directamente proporcional a su temperatura en la escala kelvin cuando la presión se mantiene constante.
Matemáticamente, esto se puede escribir como:
\año V\año T
\año V=\año T
\año V=k\año T
siendo k una constante de proporcionalidad que depende de la cantidad y la presión del gas.
{large}{frac{V}_{1}}{T}{1}}={frac{V}_{2}}{T_{2}}
Volumen y Presión: Ley de Boyle
Si llenamos parcialmente una jeringa hermética con aire, la jeringa contiene una cantidad determinada de aire a temperatura constante, digamos 25 °C. Si empujamos lentamente el émbolo manteniendo la temperatura constante, el gas de la jeringa se comprime en un volumen menor y su presión aumenta; si sacamos el émbolo, el volumen aumenta y la presión disminuye. Este ejemplo del efecto del volumen sobre la presión de una cantidad dada de un gas confinado es cierto en general. La disminución del volumen de un gas confinado aumentará su presión, y el aumento de su volumen disminuirá su presión. De hecho, si el volumen aumenta en un determinado factor, la presión disminuye en el mismo factor, y viceversa. Los datos de volumen-presión para una muestra de aire a temperatura ambiente se grafican en la Figura 5.

Figura 5. Cuando un gas ocupa un volumen menor, ejerce una presión mayor; cuando ocupa un volumen mayor, ejerce una presión menor (suponiendo que la cantidad de gas y la temperatura no cambian). Como P y V son inversamente proporcionales, una gráfica de 1/P vs. V es lineal.
A diferencia de las relaciones P-T y V-T, la presión y el volumen no son directamente proporcionales entre sí. En cambio, P y V presentan una proporcionalidad inversa: Al aumentar la presión se produce una disminución del volumen del gas. Matemáticamente, esto puede escribirse:
Ppropio de 1{/}V{/} o }P=k\cdot 1{/}V{/} o }P\cdot V=k{/} o }{P}_{1}{V}{1}={P}_{2}{V}{2}
siendo k una constante. Gráficamente, esta relación se muestra por la línea recta que resulta al graficar la inversa de la presión \large\left(\frac{1}{P}\right) contra el volumen (V), o la inversa del volumen \large\left(\frac{1}{V}\right) contra la presión (V). Los gráficos con líneas curvas son difíciles de leer con precisión en valores bajos o altos de las variables, y son más difíciles de usar para ajustar ecuaciones y parámetros teóricos a los datos experimentales. Por estas razones, los científicos suelen tratar de encontrar una forma de «linealizar» sus datos. Si representamos P frente a V, obtenemos una hipérbola (véase la figura 6).
La relación entre el volumen y la presión de una determinada cantidad de gas a temperatura constante fue publicada por primera vez por el filósofo natural inglés Robert Boyle hace más de 300 años. Se resume en el enunciado que ahora se conoce como ley de Boyle: El volumen de una determinada cantidad de gas mantenida a temperatura constante es inversamente proporcional a la presión bajo la que se mide.
Química en acción: La respiración y la ley de Boyle
¿Qué haces unas 20 veces por minuto durante toda tu vida, sin descanso, y a menudo sin ser siquiera consciente de ello? La respuesta, por supuesto, es la respiración. ¿Cómo funciona? Resulta que se aplican las leyes de los gases. Los pulmones toman el gas que el cuerpo necesita (oxígeno) y eliminan el gas de desecho (dióxido de carbono). Los pulmones están formados por un tejido esponjoso y elástico que se expande y contrae al respirar. Cuando inhalas, el diafragma y los músculos intercostales (los músculos entre las costillas) se contraen, expandiendo la cavidad torácica y aumentando el volumen de los pulmones. El aumento de volumen provoca una disminución de la presión (ley de Boyle). Esto hace que el aire fluya hacia los pulmones (de alta presión a baja presión). Al exhalar, el proceso se invierte: El diafragma y los músculos de las costillas se relajan, la cavidad torácica se contrae y el volumen pulmonar disminuye, lo que hace que la presión aumente (ley de Boyle de nuevo) y el aire salga de los pulmones (de alta presión a baja presión). A continuación, se inhala y se exhala una y otra vez, repitiendo este ciclo de la ley de Boyle durante el resto de la vida (Figura 7).
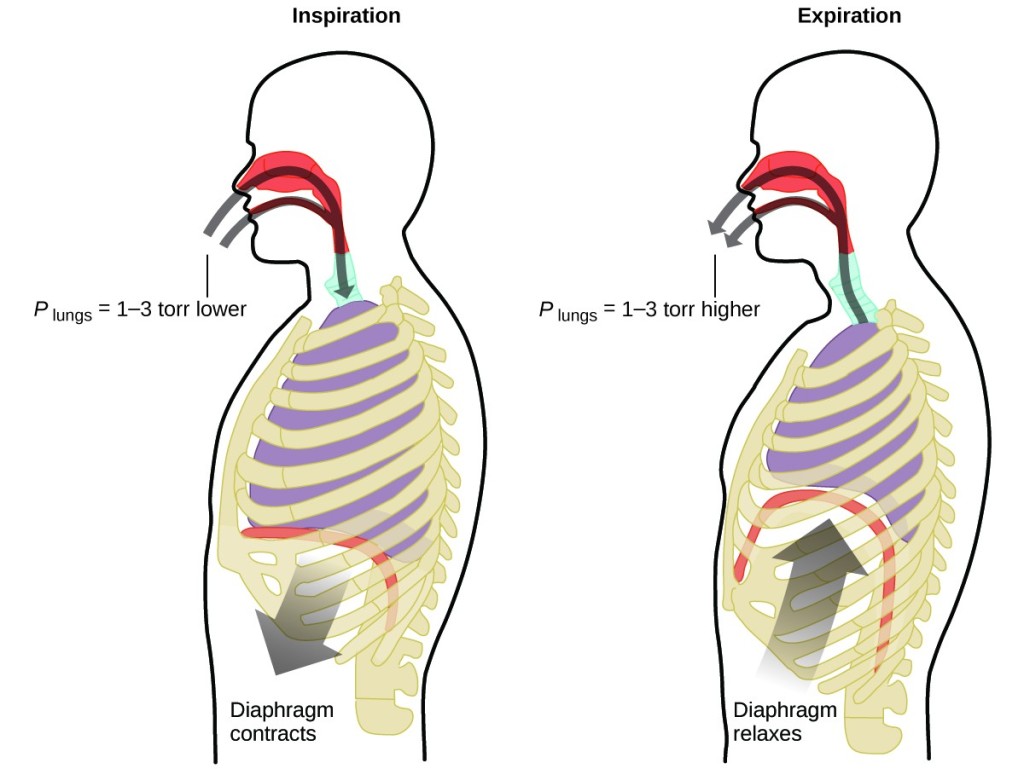
Figura 7. La respiración se produce porque la expansión y contracción del volumen pulmonar crea pequeñas diferencias de presión entre los pulmones y el entorno, lo que hace que el aire entre y salga de los pulmones.
Moles de gas y volumen: Ley de Avogadro
El científico italiano Amedeo Avogadro planteó una hipótesis en 1811 para explicar el comportamiento de los gases, afirmando que volúmenes iguales de todos los gases, medidos en las mismas condiciones de temperatura y presión, contienen el mismo número de moléculas. Con el paso del tiempo, esta relación se vio respaldada por numerosas observaciones experimentales, expresadas por la ley de Avogadro: Para un gas confinado, el volumen (V) y el número de moles (n) son directamente proporcionales si la presión y la temperatura permanecen constantes.
En forma de ecuación, esto se escribe como:
{combinación}{ccccc}V{propio de n& {texto{o}& V=k{veces n& {texto{o}& \frac{V}_1}{{n}_{1}=\frac{V}_{2}}{n}{2}{end{array}
También se pueden determinar relaciones matemáticas para los otros pares de variables, como P versus n, y n versus T.
Glosario
Cero absoluto: temperatura a la que el volumen de un gas sería cero según la ley de Charles.
Ley de Avogadro: el volumen de un gas a temperatura y presión constantes es proporcional al número de moléculas del gas
Ley de Boyle: el volumen de un número determinado de moles de gas mantenido a temperatura constante es inversamente proporcional a la presión a la que se mide
Ley de Charles: el volumen de un número determinado de moles de gas es directamente proporcional a su temperatura kelvin cuando la presión se mantiene constante
Ley de Gay-Lussac: (también, ley de Amontons) la presión de un número determinado de moles de gas es directamente proporcional a su temperatura kelvin cuando el volumen se mantiene constante