Vízkémia 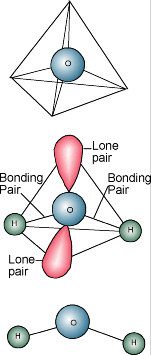 Valószínűleg tudod, hogy a víz kémiai leírása H2O. Egy vízmolekula egy oxigénatomból áll, amely két hidrogénatomhoz kötődik. A hidrogénatomok az oxigénatom egyik oldalához “kapcsolódnak”, így a vízmolekula pozitív töltéssel rendelkezik azon az oldalon, ahol a hidrogénatomok vannak, és negatív töltéssel a másik oldalon, ahol az oxigénatom van. Mivel az ellentétes elektromos töltések vonzzák egymást, a vízmolekulák vonzzák egymást, ami a vizet egyfajta “ragacsossá” teszi. A hidrogénatomos oldal (pozitív töltés) vonzza egy másik vízmolekula oxigénes oldalát (negatív töltés).
Valószínűleg tudod, hogy a víz kémiai leírása H2O. Egy vízmolekula egy oxigénatomból áll, amely két hidrogénatomhoz kötődik. A hidrogénatomok az oxigénatom egyik oldalához “kapcsolódnak”, így a vízmolekula pozitív töltéssel rendelkezik azon az oldalon, ahol a hidrogénatomok vannak, és negatív töltéssel a másik oldalon, ahol az oxigénatom van. Mivel az ellentétes elektromos töltések vonzzák egymást, a vízmolekulák vonzzák egymást, ami a vizet egyfajta “ragacsossá” teszi. A hidrogénatomos oldal (pozitív töltés) vonzza egy másik vízmolekula oxigénes oldalát (negatív töltés).
Az egymást vonzó vízmolekulák hajlamosak összecsomósodni. Ezért a vízcseppek valójában cseppek! Ha nem lenne néhány földi erő, például a gravitáció, akkor a vízcsepp gömb alakú lenne – egy tökéletes gömb. Még ha a Földön nem is alkot tökéletes gömböt, örülnünk kell, hogy a víz ragadós.
A vizet “univerzális oldószernek” nevezik, mert több anyagot old fel, mint bármely más folyadék. Ez azt jelenti, hogy bárhová is kerül a víz, akár a földön, akár a testünkön keresztül, értékes vegyi anyagokat, ásványi anyagokat és tápanyagokat visz magával.
A tiszta víz pH-ja semleges. A tiszta víz pH-ja, körülbelül 7, ami sem nem savas, sem nem bázikus.
A víz fizikai tulajdonságai:
A víz egyedülálló abban, hogy ez az egyetlen természetes anyag, amely mindhárom halmazállapotban – folyékony, szilárd (jég) és gáz (gőz) – megtalálható a Földön szokásos hőmérsékleten. A földi víz állandó kölcsönhatásban, változásban és mozgásban van.
 A víz 32° Fahrenheit (F) fokon fagy meg, és 212° F-en forr. Valójában a víz fagyási és forráspontja az alapvonal, amellyel a hőmérsékletet mérik: a Celsius-skálán 0° a víz fagyási pontja, és 100° a víz forráspontja. A víz abban a tekintetben szokatlan, hogy szilárd formája, a jég, kisebb sűrűségű, mint a folyékony forma, ezért a jég lebeg.
A víz 32° Fahrenheit (F) fokon fagy meg, és 212° F-en forr. Valójában a víz fagyási és forráspontja az alapvonal, amellyel a hőmérsékletet mérik: a Celsius-skálán 0° a víz fagyási pontja, és 100° a víz forráspontja. A víz abban a tekintetben szokatlan, hogy szilárd formája, a jég, kisebb sűrűségű, mint a folyékony forma, ezért a jég lebeg.
A víznek magas a fajhőindexe. Ez azt jelenti, hogy a víz sok hőt képes elnyelni, mielőtt elkezdene felmelegedni. Ezért értékes a víz az iparban és az autó hűtőrendszerében hűtőfolyadékként. A víz magas fajhőindexe segít szabályozni a levegő hőmérsékletváltozásának sebességét is, ezért az évszakok közötti hőmérsékletváltozás inkább fokozatos, mint hirtelen, különösen az óceánok közelében.
A víznek nagyon magas a felületi feszültsége. Más szóval a víz ragadós és rugalmas, és hajlamos arra, hogy cseppekbe csomósodjon, ahelyett, hogy vékony filmként szétterülne. A felületi feszültség felelős a kapilláris hatásért, amely lehetővé teszi a víz (és a benne oldott anyagok) mozgását a növények gyökerein és a testünkben lévő apró véredényeken keresztül.
Vízhőmérséklet:
A víz hőmérséklete nemcsak az úszók és a horgászok, hanem az ipar, sőt a halak és az algák számára is fontos. Sok vizet használnak hűtési célokra a villamos energiát termelő erőművekben. Kezdetben hűvös vízre van szükségük, és általában melegebb vizet engednek vissza a környezetbe. A kibocsátott víz hőmérséklete hatással lehet a folyásirányban lévő élőhelyekre. A hőmérséklet befolyásolhatja a víz oxigéntartó képességét, valamint az élőlények ellenálló képességét bizonyos szennyező anyagokkal szemben.
pH:
A pH azt méri, hogy a víz mennyire savas/bázikus. A tartomány 0 és 14 között mozog, a 7-es érték semleges. 7-nél kisebb pH savasságot jelez, míg a 7-nél nagyobb pH bázist. A pH valójában a vízben lévő szabad hidrogén- és hidroxil-ionok relatív mennyiségét méri. A több szabad hidrogéniont tartalmazó víz savas, míg a több szabad hidroxil-iont tartalmazó víz bázikus. Mivel a pH-t befolyásolhatják a vízben lévő vegyi anyagok, a pH fontos mutatója a kémiailag változó víznek. A pH-t “logaritmikus egységekben” adják meg, hasonlóan a Richter-skálához, amely a földrengéseket méri. Minden egyes szám a víz savasságának/lúgosságának 10-szeres változását jelenti. Az 5-ös pH-jú víz tízszer savasabb, mint a 6-os pH-jú víz.
A szennyezés megváltoztathatja a víz pH-ját, ami viszont károsíthatja a vízben élő állatokat és növényeket. Például egy elhagyott szénbányából származó víz pH-ja 2 lehet, ami nagyon savas, és biztosan hatással lenne minden olyan halra, amely elég őrült ahhoz, hogy megpróbáljon benne élni! A logaritmikus skálát használva ez a bányavíz 100 000-szer savasabb lenne, mint a semleges víz – ezért maradj távol az elhagyott bányáktól.
Specifikus vezetőképesség:
A specifikus vezetőképesség a víz elektromos áramot vezető képességének mérőszáma. Nagymértékben függ a vízben lévő oldott szilárd anyagok (pl. só) mennyiségétől. A tiszta víz, például a desztillált víz fajlagos vezetőképessége nagyon alacsony, a tengervízé pedig magas. Az esővíz gyakran oldja a levegőben lévő gázokat és a levegőben szálló port, ezért gyakran magasabb a fajlagos vezetőképessége, mint a desztillált vízé. A fajlagos vezetőképesség fontos vízminőségi mérés, mert jó képet ad a vízben oldott anyagok mennyiségéről.
Vélhetően az iskolában már végeztél olyan kísérletet, ahol egy elemet csatlakoztatsz egy villanykörtéhez, és az elemről két vezetéket vezetsz egy pohár vízbe. Amikor a vezetékeket egy desztillált vízzel teli pohárba tesszük, a lámpa nem fog világítani. De az izzó világít, ha a főzőpohárban sós víz (sóoldat) van. A sós vízben a só feloldódott, szabad elektronokat szabadított fel, és a víz elektromos áramot vezet.
Turbiditás:
A turbulencia a víz zavarosságának mértékegysége. Úgy mérik, hogy egy fénysugarat vezetnek át a vízen, és megnézik, hogy mennyi verődik vissza a vízben lévő részecskékről. A víz zavarosságát a vízben lebegő (lebegő) anyagok, például a szennyeződések és a levelek maradványai okozzák. A kristálytiszta víznek, például a Tahoe-tónak (ahol keményen dolgoznak azon, hogy az üledék ne mosódjon a tóba) nagyon alacsony a zavarossága. De nézz meg egy folyót vihar után — valószínűleg barna. Látod az összes lebegő talajt a vízben. Szerencsénkre az ivóvizünkben zavarosságot okozó anyagok vagy leülepednek, vagy kiszűrődnek, mielőtt a víz az otthoni ivópoharunkba kerül. A zavarosságot nefelometrikus zavarossági egységekben (NTU) mérik.
Az oldott oxigén:
Bár a vízmolekulák tartalmaznak egy oxigénatomot, erre az oxigénre a természetes vizeinkben élő vízi szervezeteknek nincs szükségük. Egy kis mennyiségű oxigén, körülbelül tíz molekula oxigén egymillió vízmolekulára vetítve, valójában a vízben oldott oxigén. Ezt az oldott oxigént a halak és a zooplanktonok lélegzik be, és szükségük van rá a túléléshez.
A gyorsan mozgó víz, mint például egy hegyi patak vagy egy nagy folyó, általában sok oldott oxigént tartalmaz, míg az állóvíz kevés. Az a folyamat, amikor a vízben lévő baktériumok segítik a szerves anyagok, például a szennyvíztisztító telepről származó anyagok bomlását, oxigént fogyaszt. Így a tavainkban és folyóinkban lévő felesleges szerves anyag oxigénhiányos helyzetet okozhat. A vízi élővilágnak nehéz dolga lehet a sok rothadó, szerves anyagot tartalmazó állóvízben, különösen nyáron, amikor az oldott oxigén szintje szezonálisan alacsony.
Keménység:
A vízben oldott kalcium és magnézium mennyisége határozza meg a víz “keménységét”. A víz keménysége az Egyesült Államokban változó. Ha olyan területen él, ahol a víz “lágy”, akkor lehet, hogy még csak nem is hallott a vízkeménységről. Ha azonban Floridában, Új-Mexikóban, Arizonában, Utahban, Wyomingban, Nebraskában, Dél-Dakotában, Iowában, Wisconsinban vagy Indianában él, ahol a víz viszonylag kemény, észreveheti, hogy kéz- vagy ruhamosáskor nehezen habzik a víz. Az Ön területén működő iparágaknak pedig lehet, hogy pénzt kell költeniük a vízlágyításra, mivel a kemény víz károsíthatja a berendezéseket. A kemény víz még a szövetek és ruhák élettartamát is lerövidítheti! Ez azt jelenti, hogy a kemény vízzel rendelkező területeken élő diákok nem tartanak lépést a legújabb divattal, mivel ruháik gyorsabban elhasználódnak?
Suszpendált üledék:
A szuszpendált üledék a patakban mozgó talaj mennyisége. Ez nagymértékben függ a víz áramlási sebességétől, mivel a gyorsan áramló víz több talajt tud felvenni és felfüggeszteni, mint a nyugodt víz. Viharok idején a talaj a patakpartokról a patakba mosódik. A patakba mosódó talaj mennyisége függ a folyó vízgyűjtőjében lévő földtípustól és a folyót körülvevő növényzettől.
Ha egy patak mentén a földet megbolygatják, és nem tesznek védelmi intézkedéseket, akkor a felesleges üledék károsíthatja a patak vízminőségét. Bizonyára látta már azokat a rövid, műanyag kerítéseket, amelyeket az építkezők állítanak fel az általuk fejlesztett ingatlan szélén. Ezeknek az iszapkerítéseknek az a feladata, hogy esőzéskor felfogják az üledéket, és megakadályozzák, hogy az a patakba mosódjon, mivel a felesleges üledék károsíthatja a patakokat, folyókat, tavakat és víztározókat.
A víztározóba kerülő üledék mindig aggodalomra ad okot; ha egyszer bekerült, nem tud kijutni – nagy része leülepszik a fenékre. A tározók “beiszapolódhatnak”, ha túl sok üledék kerül beléjük. A tározó térfogata csökken, ami kevesebb csónakázásra, halászatra és rekreációra alkalmas területet eredményez, valamint csökkenti a gátban lévő erőmű energiatermelő képességét.
Vizes oldatok geokémiája:
Nézze meg a hidrogeokémiai ciklus diagramját.
- Sav = hidrogént tartalmazó anyag, amely vízben oldva szabad hidrogént (H + ) ad
- Bázis = OH-csoportot tartalmazó anyag, amely vízben oldva szabad (OH – ) ad
-
Savas oldat az, amely szabad H + -ot, bázis az, amely szabad OH -ot tartalmaz. Egy sav és egy bázis közötti reakciót általában semlegesítésnek nevezzük.
Pl:
-
HCl (sav) + NaOH (bázis) ==> H 2 O + NaCl
amelyek ionokká disszociálódnak:
H + + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - azaz a Na + és Cl – nem változik.
- pH = a szabad H + koncentráció (aktivitás) fordított logaritmusa, vagy pH = -log
-
A víz H + -ra és OH -ra disszociál ;
-
a disszociációs állandó: K víz = =10 -14
- Tehát egy kilogramm semleges oldatban 25°C-os standard hőmérsékleten 10 -7 mólnyi H+ és OH – oldatnak kell lennie. Egy mol 6,023 x 10 23 atom (vagy molekula), a H 2 O molekulatömege pedig 18 gramm/mol. Egy kilogramm vízben körülbelül 1000/18 = 55,6 mól víz vagy körülbelül 3,35 x 10 25 atom oxigén és körülbelül kétszer ennyi (6,7 x 10 25 atom) H + van (a szabad H + vagy szabad OH – mennyisége viszonylag kicsi a nem disszociált H 2 O mennyiségéhez képest).
- A pH 25°C-on 0 és 14 között mozog; pH < 7 = savas oldat; pH > 7 = bázikus oldat. Ha HCl-t vagy más savat adunk hozzá, akkor a pH csökken; ha NaOH-t vagy más bázist adunk hozzá, akkor a pH nő.
- A szénsav (gyenge sav) disszociációjával nő a pH: Amikor a szén-dioxid vízzel egyesül, mint például ami a légkörben történik a fosszilis tüzelőanyagok elégetésekor, szénsav keletkezik: H 2 O + CO 2 ==> H 2 CO 3 . Az egymást követő disszociációk során szabad H + szabadul fel:
-
H 2 CO 3 ==> H + + HCO 3- szénsavból bikarbonát lesz, pH ~6,4-nél történik
-
HCO 3 ==> H + + CO 32- bikarbonátból karbonát, pH ~10-nél történik.3
Ne feledjük, szabad H + csak akkor áll rendelkezésre, ha savas, vagy ha a pH < ~7. A bikarbonát karbonáttá történő disszociációja akkor következik be, ha túl sok OH – van a rendszerben, és H + “szabadul fel” a bázis kiegyenlítésére.
- Oldott kationok és anionok a vízben
Kationok = elektrondonorok, pozitív töltésűek: Na + , K + , Mg ++ , Ca ++ , Fe ++ vagy Fe +++ , Mn ++ , Al +++
Anionok = elektronakceptorok, negatív töltésűek: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Fémek = többnyire kationként viselkednek: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo stb.
- Vízelemzések – Kation-anion egyensúlyra van szükség
millequivalent (MEQ) = mólegyenérték töltés vagy anion vagy kation, az oldatban oldott adott ion által okozott teljes töltés mértéke. A koncentrációval kezdjük, osszuk el a mol tömeggel, szorozzuk meg a töltéssel: NaCl oldatban, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Tehát, ha az összes kation és anion MEQ-ja nem kiegyensúlyozott, akkor az elemzésben hiba van.