Ha a hidrogén kovalens kötésben van egy erősen elektronegatív atomhoz, például fluorhoz, klórhoz, oxigénhez vagy nitrogénhez, a H atom részleges pozitív töltéssel rendelkezik, amit Hδ+-nak írunk.
A Hδ+ fizikailag nagyon kicsi, ezért a rajta lévő töltéssűrűség szokatlanul nagy.
Mondjuk, egy másik negatív vagy elektronegatív atom, mondjuk egy másik molekulán, megközelíti a Hδ+-t;kölcsönös vonzás jön létre, ami különösen erős dipólus-dipólus vonzást eredményez.Ezt a vonzást hidrogénkötésnek nevezzük.
A hidrogénkötések általában gyengébbek, mint az ionos és kovalens kötések, de erősebbek, mint a van der Waals-erők.

hidrogénkötés a vízben
A hidrogénkötés legismertebb példája a víz:
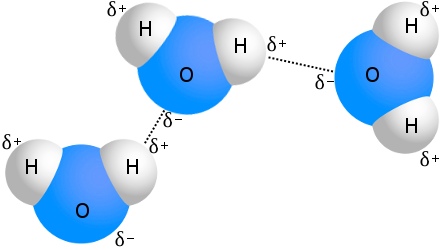
Minden vízmolekulához akár négy másik vízmolekula is kapcsolódhat hidrogénkötéssel.A vízben szobahőmérsékleten az egy vízmolekulára jutó hidrogénkötések átlagos száma 3,6.
A molekulák véletlenszerű hőmozgása biztosítja, hogy a vízben az egyes hidrogénkötések élettartama rövid, átlagosan csak 10 pikoszekundum.Egy új kötés kialakulásához azonban még rövidebb idő áll rendelkezésre.
Egyetlen hidrogénkötés tartós felbontásához a vízben 21 kJ mol-1 szükséges, ami jelentős energiabefektetés.
Az eredmény az, hogy a víz olvadási és forráspontja sokkal magasabb, mint ami egy ilyen kis molekulatömegű molekulától elvárható lenne.
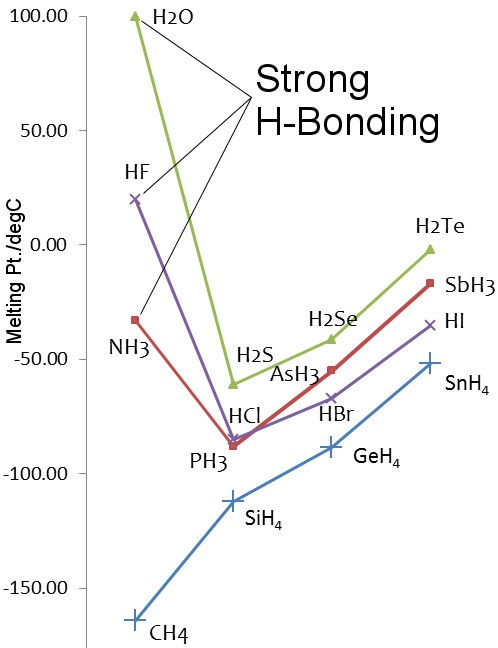
Vizsgáljuk meg a víz és a metán viszonyát.A vízmolekulákat meglehetősen erősen vonzza egymáshoz a hidrogénkötés, míg a metánban a van der Waals-erők érvényesülnek.Így, bár molekulatömegük hasonló, a vízé 18, a metáné 16, fizikai tulajdonságaik nagyon eltérőek.Például a víz 0,00 °C-on olvad és 99,98 °C-on forr; a metán -182,5 °C-on olvad és -161,5 °C-on forr.
Hidrogénkötés a vízben vs. hidrogén-szulfid
A kén a periódusos rendszer 16. csoportjában található, ugyanúgy, mint az oxigén. A kén nehezebb, mint az oxigén, ezért a H2S-nek magasabb olvadás- és forrásponttal kellene rendelkeznie, mint a H2O-nak.Ez azonban nem így van, mert a kén kevésbé elektronegatív, mint az oxigén, ezért a hidrogénkötés a H2S-ben gyenge.

Mol. Tömeg: 16
olvadási Pt.: 0,00 °C
forrási Pt.: 99,98 °C
O elektronegativitása (Pauling): 3,44
hidrogénkötési entalpia: 21 kJ mol-1

Mol. Mass: 34
Olvadáspont: -82 °C
Forráspont: -60 °C
S elektronegativitása (Pauling): 2.58
hidrogénkötési entalpia: ≅ 3 kJ mol-1
Hidrogénkötés ammóniában és fluorhidrogénben
A fluor és a nitrogén a periódusos rendszer csoportjainak legelektronegatívabb elemei, és hidrogénkötés figyelhető meg a fluorhidrogénben és az ammóniában.
A vízhez hasonlóan a hidrogén-fluorid és az ammónia olvadás- és forráspontja magasabb, mint a csoportjukban lévő nehezebb elemek hidridjeinek.
A 14-17. csoportba tartozó elemek hidridjeinek olvadáspontjai
Hidrogénkötés a DNS-ben
A DNS két spirálláncát a bázispárok kötik össze.A bázispárok hordozzák a DNS genetikai információit.
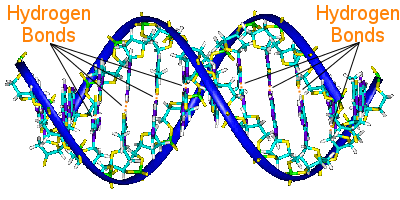
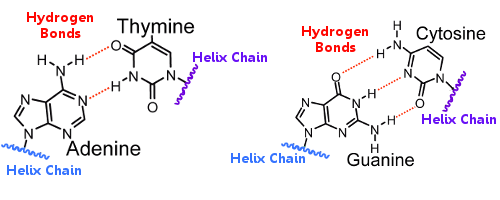
Az egyik spirál bázispárjai hidrogénkötésekkel kapcsolódnak a másik spirál bázispárjaihoz.
A DNS replikációjakor a hidrogénkötések felszakadnak, és lehetővé teszik a két spirál szétválását.
A hidrogénkötés így alapvető szerepet játszik a DNS replikáció bázispár-záró mechanizmusában.
Hidrogénkötés a gyapjúban
A többi fehérjeszálhoz hasonlóan a gyapjú is rendelkezik hidrogénkötéssel.Az alábbi képen látható, hogy a hidrogénkötések (narancssárga pontok) hogyan kötik össze a gyapjú α-hélix láncának tekercseit (zöld).
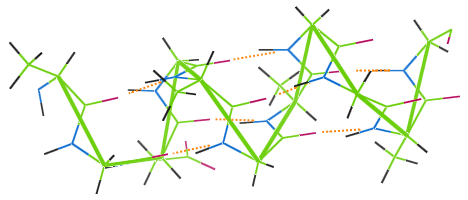
Ha a gyapjúból készült ruhadarabot magas hőmérsékleten mossák, a hidrogénkötések megsemmisülnek, a tekercsek elveszítik rugalmasságukat, és a ruhadarab szálkássá válik.
