A kéziratot elfogadták :29 Aug 19
Megjelent online:: 18-09-2019 Plágiumellenőrzés: Grigorios Kyriakopoulos
Végleges jóváhagyás: Grigorios Kyriakopoulos
Final Approval by: Ayush Dogra
How to Citeclose | Publication Historyclose
 , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 és Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 és Kedsukon Maneewan1
1Natural Antioxidant Innovation Research Unit, Biotechnológiai Tanszék, Technológiai Kar, Mahasarakham Egyetem, Khamriang, Kantarawichai, Maha Sarakham, 44150, Thaiföld.
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thailand.
Corresponding Author E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
A tanulmány célja olyan baktériumok izolálása és azonosítása volt, amelyek képesek amiláz enzimet termelni a feltáratlan Nasinuan erdőből, Kantarawichai District, Mahasarakham Province, Thailand. Tizenhárom, 1%-os keményítő agaron amiláztermelő képességgel rendelkező baktérium izolátumot azonosítottunk 16S rRNS szekvenálással. Tizenkét baktérium gram-pozitív, pálcika alakú volt, és Bacillus spp.-ként azonosították, egy gram-negatív és pálcika alakú baktérium pedig Enterobacter cloacae volt. Legközelebbi rokonaikat Indiában, Kínában, Koreában, Indonéziában, Argentínában, Olaszországban, Izraelben, az USA-ban, Argentínában és Dél-Afrikában találták. E baktériumok specifikus amilázaktivitását 1-3 napos enzimindukció után 1%-os keményítővel, 37°C-on vizsgálták. Az eredmények a legmagasabb specifikus aktivitást a 2. napi inkubációnál mutatták a következő sorrendben: Bacillus cereus 3,5AL2 > 3,4AL1 > 1,4AL3, ezért a további elemzéshez a 2 napos enzimindukciót választották. A Bacillus sp. 3.5AL2 mutatta a legmagasabb specifikus amiláz enzimaktivitást (1,97 ± 0,41 U/mg fehérje) az optimális körülmények között (60 °C és pH 7,0), miután 30 percig inkubálták 1% keményítővel 0,05 M PBS pufferben. Ez az amilázt termelő baktériumtörzs nagy lehetőségeket kínál a thaiföldi élelmiszer- és mezőgazdasági iparban való alkalmazásra.
Kulcsszavak
Amiláz; Baktériumok; Nasinuan erdő; talaj
Download this article as: ![]()
Copy the following to cite this article:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3).
Copy the following to cite this URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3). Available from: http://biomedpharmajournal.org/?p=28497
Bevezetés
A keményítő-hidrolitikus amilázok (α-amiláz, β-amiláz és glükoamiláz) a mai biotechnológiában az egyik legszélesebb körben használt enzim. A glükoamilázok (1,4-α-D-glükán glükanohidroláz; EC 3.2.1.3) vagy amiloglükozidázok olyan exoaktív amilázok, amelyek a keményítő nem redukáló végéből és a megfelelő oligoszacharidokból glükózt állítanak elő. A glükoamilázokat kereskedelmi forgalomban a malto-oligoszacharidok glükózzá történő átalakítására alkalmazzák1. Bár az amilázokat különböző forrásokból (mikroorganizmusokból, növényekből és állatokból) állítják elő, a mikrobákból származó amilázok a legalkalmasabbak az ipari termelésre a mikrobák rövid növekedési ideje, az alacsony költséghatékonyságú termelés, a környezetbarát viselkedés, a munkavállalók számára kevesebb kezelési probléma, a termelékenység2 és a bakteriális gének könnyű manipulálhatósága miatt3. A baktériumok és gombák hajlamosak a sejteken kívül amilázokat kiválasztani a keményítő sejten kívüli, cukorrá történő emésztése céljából. A mikrobiális amilázok iránti növekvő ipari kereslet a reakció specifitása, a reakcióhoz szükséges enyhe körülmények és a hagyományos, nem enzimatikus kémiai módszerekhez képest kisebb energiafelhasználás miatt figyelhető meg.
Az amiláz kiterjedt alkalmazása az élelmiszeriparban, a keményítő cseppfolyósításában, a szacharifikációban, a sörfőzésben, a mosószer-, a papír-, a textil- és a szesziparban nagyobb figyelmet fordított az α-amiláz hazai termelésének növelésére4. A Bacillus az ipari amiláztermelés gyakori bakteriális forrása. A különböző törzsek azonban eltérő optimális növekedési feltételekkel és enzimtermelési profillal rendelkeznek. A jelentések szerint a Bacillus törzseket széles körben használták iparilag α-amiláz előállítására, beleértve a B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8 és B. circulans9 törzseket.
A mai napig számos amiláztermelő baktériumot dokumentáltak, azonban a thaiföldi Nasinuan Community Forest, Kantharawichai District, Mahasarakham Province, Thailand talajából származó amiláztermelő baktériumokról még nem számoltak be. Úgy tűnik, hogy ez az erdő gazdag mikrobiális biodiverzitásban, amely hasznos lehet az ipari enzimek, köztük az amiláz előállításában. Ez az első jelentés a Nasinuan erdőből izolált amiláztermelő baktériumok azonosításáról. Ezek a bakteriális amilázok a jövőben helyben alkalmazhatók különböző iparágakban, beleértve a cellulóz- és papíripart, a textilipart, a bioetanolt, a sörfőzdét, az élelmiszer-feldolgozást, az állati takarmányt és a mezőgazdaságot Thaiföldön.
Az anyagok és módszerek
Talajminták
A talajmintákat véletlenszerűen gyűjtöttük a talajfelszín alatt 15 cm-re, polisztirol zsákokban tárolva a Nasinuan közösségi erdőből, Kantarawichai körzet, Mahasarakham tartomány, Thaiföld (területe 9.6 hektár; koordináták: 16.340941, 103.210799).
Az amiláztermelő baktériumok izolálása
A talajmintát (10 g) 90 ml steril 0,85%-os NaCl-oldatban szuszpendáltuk. A szuszpenziókat (100 µL) sorozatos hígításban keményítő agarra (g/L) terítettük; 3,0 marhahús kivonat, 10,0 oldható keményítő, 15,0 agar pH 7,0 és 37 ºC-on inkubáltuk 7 napig. Ezután a lemezeket Gram-jóddal árasztottuk el. Minden olyan kolóniát, amely körül tiszta zóna képződött, folyékony levesben szubkultúráztunk, és legalább ötször csíkoztunk, hogy tiszta izolátumokat kapjunk, amit Gram-festéssel és 1000X fénymikroszkópos megfigyeléssel igazoltunk. A tiszta izolátumokat keményítőagarra oltottuk, és 37 °C-on 7 napig inkubáltuk. A tiszta zónák átmérőjét a kolóniák átmérője felett vonalzóval megmértük, mint a Halo : Kolónia arányt.
16S rRNS gén szekvenálás és filogenetikai elemzés
A tiszta baktériumizolátumokat a fenti módszerrel nyert genomiális DNS és univerzális primerek felhasználásával azonosítottuk: 27F forward primer 5′-GAGAGAGTTTGATYCTGGCTCAG-3′ és 1492R reverse primer 5’AAGGAGGTGATCCARCCGCA -3′. A 25 µl PCR-keverékben 0,5 ng genomi DNS, 2X Master Mix (One PCR) 100 mM Tris-HCl (pH 9,1), 0,1% TritonTMX-100, 200 mM dNTP, 1,5 mM MgCl2, 0,005 U Taq DNS-polimeráz és 0,2 µM forward és reverse primer volt, a térfogatot nukleázmentes vízzel beállítva. A PCR termocycler (Thermo Scientific Hybaid Px2) programozása a következőképpen történt: (1) kezdeti denaturálás 2 percig 94 ºC-on 1 cikluson keresztül; (2) denaturálás 94 ºC-on 45 másodpercig; lágyítás 54 ºC-on 45 másodpercig és hosszabbítás 72 ºC-on 1 percig 32 cikluson keresztül; (3) végső hosszabbítás 72 ºC-on 7 percig. A mintákat a további elemzésig 4 ºC-on tartottuk. A 16S rRNS PCR-termékeket (~ 1500 bp) 0,8%-os agaróz gélen mutattuk ki, majd a PCR-termék tisztító kit (Vivantis, Malajzia) segítségével tisztítottuk, és elküldtük a First Base Co. Ltd. (Malajzia) részére DNS-szekvenálás céljából. A 16S rRNS gén szekvenciáit ezután BLASTN program (Basic Local Alignment Search Tools)10 segítségével összehasonlítottuk a GenBankban elérhető többi szekvenciával. A filogenetikai fát a szekvencia-illesztés Muscle-módszerével és a maximális valószínűség módszerével a MEGA X segítségével, 1000 ismétléses bootstrap értékekkel11 építettük fel. Az amiláztermelő izolátumaink összes 16S rRNS parciális szekvenciáját letétbe helyeztük az NCBI adatbázisában.
Az amiláz enzimaktivitás meghatározása
A módszer Bhaskara és munkatársai (2011)12 módszerét követte. Az amiláz enzimaktivitás meghatározásához a három legnagyobb Halo: Kolónia arányú baktériumot választottuk ki. Mindegyik izolátumot keményítő folyadéklevesben szubkultúráztuk (g/L): 10,0 oldható keményítő, 10,0 pepton, 20,0 élesztőkivonat, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O és 37 ºC-on, 150 rpm-en inkubáltuk 1, 2 és 3 napig. A tiszta felülúszót (nyers extracelluláris amiláz enzim) 10 000 g-nél 4 ºC-on 15 percig tartó centrifugálás után kaptuk. A nyers kivonatot MWCO 10 kDa ultracentrifuga fehérjekoncentrátorral (Vivaspin, Sartorius, UK) koncentráltuk.
A DNS-módszert13 használtuk az egyes baktériumizolátumok amilázaktivitásának meghatározására az egyes enzimindukciós napokon. Egy mL nyers enzimet 1 mL 1%-os keményítőoldattal kevertünk 1 mL 0,05 M nátrium-foszfát puffer pH 7,0-ban. A mintákat 37°C-on inkubáltuk 30 percig. Az inkubáció után 0,5 mL DNS-oldatot adtunk minden egyes mintához a reakció leállítása érdekében, majd 100°C-on 5 percig vízfürdőben forraltuk. Az oldat színintenzitását az optikai sűrűség (OD) 575 nm-es spektrofotométerrel történő mérésével figyeltük meg. A leolvasott értéket összehasonlítottuk egy elkészített vakoldattal (nyers enzim nélkül). A T30 perces minták OD-értékeit kivontuk a T0 perces minták OD-értékeiből, mivel a T0 perces mintákban az 1, 2 és 3 napos enzimindukciós folyamat után még mindig maradt glükóz. A folyamatot három példányban végeztük el. Az egyes oldatokban előállított glükóz koncentrációját a glükóz standard görbéből kaptuk. Az amiláz aktivitását kiszámítottuk. Az amiláz aktivitás egy egységét úgy definiáltuk, hogy az amiláznak az a mennyisége szükséges a redukáló cukor képződésének katalizálására, amely a vizsgálati körülmények között 1 µmol glükóznak felel meg percenként14.
A legnagyobb aktivitással rendelkező baktériumizolátum nyers enzimét választottuk ki a további munkához.
A kiválasztott izolátumok specifikus enzimaktivitásának meghatározásához a Folin-Lowry módszert használtuk az összes fehérje becslésére15. A specifikus enzimaktivitást a következő képlettel mértük.
Specifikus aktivitás (U/mg) = Enzimaktivitás (U/ml)/Extracelluláris fehérje koncentráció (mg/ml)
Az amiláz enzimaktivitás optimális pH-ja és hőmérséklete
Az oldható keményítőoldatokat (1%) különböző pH értékeken vizsgáltuk 3 és 10 között. Egy ml különböző 1%-os szubsztrátoldathoz 1 ml-t adtunk a megfelelő pufferekből; 0,05 M citrát puffer (pH 3-5), 0,05 M nátrium-foszfát puffer (pH 6 és 7), 0,05 M Tris-HCl (pH 8 és 9) és 0,05 M glicin NaOH (pH 10). Ezekhez a pufferekhez is egy ml nyers enzimet adtunk. A mintákat 37°C-on inkubáltuk 30 percig. A specifikus amiláz aktivitást kiszámítottuk. Megjegyeztük azt a pH-t, amelynél a legnagyobb aktivitást figyeltük meg. Hasonlóképpen, különböző szubsztrátoldatokat készítettünk 1%-os oldható keményítő pH 7,0 oldatokban történő feloldásával Egy mL 1%-os oldható keményítőt adtunk hozzá 1 mL 0,05 M nátrium-foszfát pufferhez (pH 7). A pufferekhez szintén egy mL nyers enzimet adtunk. A mintákat 20, 30, 40, 50, 60, 70 és 80 °C-on inkubáltuk 30 percig. A specifikus amiláz aktivitást kiszámítottuk. Megjegyeztük azt a hőmérsékletet, amelyen a legnagyobb aktivitást figyeltük meg. Mind az optimális pH-t, mind a hőmérsékletet a végső specifikus amiláz enzimaktivitás meghatározásához használtuk.
Statisztikai elemzés
Az SPSS Statistics Ver. 17.0 programban egyutas varianciaanalízist (One-way ANOVA) alkalmaztunk Duncan Multiple Range’s Test segítségével. Az eredményeket átlag ± SD-ben fejeztük ki, statisztikai különbséggel, ha p < 0,05.
Eredmények
Az amiláztermelő baktériumok izolálása
Ebben a vizsgálatban 13 amilázpozitív izolátum mutatott tiszta zónákat 1%-os keményítő agaron, különböző Halo : Colony arányokkal. A jódoldatban tiszta zónákat mutató kolóniákat tekintettük pozitív keményítőbontó baktériumtelepeknek. Valamennyi baktériumizolátum hasonló kolóniamorfológiát mutatott, és Gram-pozitív és rúd alakú baktériumként jelent meg (1. táblázat). Az eredmény szerint a Halo : kolónia arány 1,18 és 1,71 között volt (1. táblázat). A bakteriális izolátumokat ezután az optimális amiláz enzimindukciós időtartam meghatározására használtuk, és csak a 3 legnagyobb specifikus aktivitású izolátumot mutattuk be a 3.4. pontban.
Az amiláztermelő baktériumok törzsazonosítása
A törzsazonosításhoz mind a 13 amilázpozitív baktériumtörzset 16S rRNS génszekvenálásnak vetettük alá. A BLAST eredmények azt mutatták, hogy az összes amilázpozitív izolátum a Bacillus nemzetséghez tartozik, kivéve egy Enterobacterhez tartozó izolátumot (2. táblázat). Legközelebbi rokonaikat Indiában, Kínában, Koreában, Indonéziában, Argentínában, Olaszországban, Izraelben, az USA-ban, Argentínában és Dél-Afrikában találták, 96-100%-os azonossággal.
Filogenetikai elemzés
A 13 amilázpozitív baktériumtörzs és 2 feltételezett amiláz enzimekkel rendelkező referencia törzs filogenetikai fája a MEGA 7.0 segítségével azt mutatta, hogy az E. cloacae 2.1AL2 evolúciósan különbözik a többi Bacillus törzstől (1. ábra). A B. thuringiensis serovar konkukian (NCBI accession no. AB617494.1) referenciatörzs a mi Bacillus baktériumainktól eltérően fejlődött. Ugyanakkor egy másik referencia B. cereus ATCC 14579 (NCBI hozzáférési szám: MG708176.1) törzs, amelyet sáfránylevelekből, Eqyptből izoláltak, hasonló evolúciót mutatott, mint a mi baktériumaink (1. ábra).
 |
1. táblázat: Jellemzők és halo : Colony ratios of 13 amylase-producing bacterial strains
Click here to View table |
Optimal amylase enzyme induction duration
Mutatható volt, hogy az inkubációs időtartam, amely a legmagasabb specifikus aktivitással indukálta az amiláz termelést, mind a 3 izolátum között 2-3 nap volt, statisztikai különbségek nélkül. Úgy tűnt, hogy a Bacillus sp. 3.5AL2 termelte a legmagasabb specifikus aktivitást 0,91 ± 0,12 U/mg értékkel a 2. napon 37°C-on (3. táblázat). Így ezt a törzset és ezt a körülményt használtuk az amiláz termelés indukálására a további elemzéshez.
Az amiláz enzimaktivitás optimális pH-ja és hőmérséklete
A Bacillus sp. 3.5AL2 mutatta a legmagasabb specifikus aktivitást 37°C-on rögzített pH 7,0-nál és 60°C-on rögzített pH 7,0-nál (2. ábra). Így mindkét optimális körülményt használtuk a specifikus amiláz aktivitás meghatározására, és 1,97 ± 0,41 U/mg (4. táblázat) eredményt kaptunk.
2. táblázat: 16S rRNS analízissel azonosított tizenhárom amiláz pozitív baktériumtörzs
| Iszolátum | Accession
no. a |
Legközelebbi rokonb | Accession no.c | % Identityd | Origine |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, Kína |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilmek, Argentína |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Talaj, Koreai Köztársaság |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | tengeri üledék, USA |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Búzaszem, Isarael |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Madárembrió, Kína |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Grapevine gyökérzet, Olaszország |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Iparterület tengervize, Indonézia |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Papaya lisztbogár bélrendszer, India |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | India |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Búza rizospere, India |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Tea rizoszféra talaj, India |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Tengeri szivacs, Dél-Afrika |
aGenBank accession no. törzseink NCBI weboldalon letétbe helyezett száma (http://www.ncbi.nlm.nih.gov/pubmed)
bA BLAST keresés során a legmagasabb %-os azonossággal és a legmagasabb Max pontszámmal rendelkező legközelebbi fajok
cGenBank hozzáférési száma az NCBI weboldalon található legközelebbi rokon törzsek
dB A BLAST keresési eredmények alapján a törzsek azonossága (%) a
legközelebbi rokonokhoz képest.
eA BLAST keresési eredmények alapján a legközelebbi rokonok eredete.
 |
1. ábra: 13 amiláz-pozitív baktériumtörzs és 2 Bacillus-referenciatörzs filogenetikai fája
Click here to View figure |
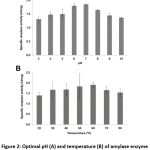 |
2. ábra: A Bacillus sp. 3 amiláz enzimaktivitásának optimális pH-ja (A) és hőmérséklete (B).5AL2
Click here to View figure |
Táblázat 3: Az amiláz enzim indukciójának optimális időtartama
|
Iszolátum |
Specifikus amiláz. aktivitás
(U/mg fehérje) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0,21 ± 0,04Ab | 0,40 ± 0,04Ca | 0,41 ± 0,04Ba |
| B. cereus 2.3AL8 | 0,45 ± 0,06Ab | 0,62 ± 0,04Ba | 0,65 ± 0,06Aa |
| Bacillus sp. 3. B.5AL2 | 0,32 ± 0,11Ab | 0,91 ± 0,12Aa | 0,86 ± 0,11Aa |
Az értékek átlagok ± SD három példányban.
A nagy- és kisbetűk jelzik a statisztikai különbségeket (p < 0,05) az oszlopban, illetve a sorban.
4. táblázat: Specifikus amiláz enzimaktivitás optimális pH-n és hőmérsékleten
| Törzs | Aktivitás (U/mg) | Optimal Temp. (°C) | Optimal pH |
| Bacillus sp. 3.5AL2 | 1,97 ± 0,41 | 60 | 7.0 |
Diszkusszió
A thai vámhatóság (2017) adatai szerint Thaiföld 2016-ban 2,625 millió baht értékben importált ipari enzimeket más országokból, és az import aránya évente 9,40%-kal nőtt. Az egyik legszélesebb körben használt enzim Thaiföldön, az amiláz, amelyet a ruházati, textil- és élelmiszeriparban alkalmaztak. Azonban hiányzik a kereskedelmi amiláz helyi előállítása, ezért ez a munka célja olyan talajbaktériumok izolálása volt a helyi erdőkből, amelyek képesek amilázt termelni ipari felhasználásra.
A keményítőben gazdag maradványok jobb potenciális forrás lehetnek, ahol amiláz-pozitív baktériumok izolálhatók16. Ezenkívül ezeket olyan helyekről lehet izolálni, mint a maniókafarmok, a talaj és a feldolgozó lisztgyárak17. Ebben a munkában 13 amiláztermelő baktériumot izoláltunk és azonosítottunk Bacillus spp. és Enterobacter sp. néven, ami hasonló a korábbi jelentésekhez18, 19, 20, ahol a Bacillus spp. volt a legtöbb amiláztermelő.
Eredményeink azt mutatták, hogy a Bacillus sp. 3.5AL2, a 13 izolátum közül a legmagasabb specifikus aktivitású izolátum, 0,91 ± 0,12 U/mg, 2 napos 37°C-on történő inkubáció mellett produkálta a legmagasabb specifikus aktivitást. Az amilázaktivitás optimális pH-értéke 7,0, illetve 60 °C volt. Mindkét optimális körülmények között a Bacillus sp. 3.5AL2 fajlagos amilázaktivitása 1,97 ± 0,41 U/mg volt. Ismeretes, hogy a magas hőmérsékleten működni képes enzimek előnyösnek számítanak az olyan ipari folyamatokban, mint a keményítő cseppfolyósítása21. Így a Bacillus sp. 3.5AL2-ből származó amiláz potenciálisan felhasználható az ilyen iparágakban.
Hasonlóképpen, a Bacillus sp. GM890 az amiláz optimális hőmérsékletét 60°C-on20, a Bacillus licheniformis AI20 a legnagyobb aktivitást 60-80°C között22 és a Bacillus sp. WA21 az amiláz számára alacsonyabb, 55°C-os optimális hőmérsékletet mutatott19.
A legtöbb keményítőbontó baktériumtörzsnél a normál növekedéshez és enzimaktivitáshoz 6,0 és 7,0 közötti pH-tartományt mutattak ki4. Hasonlóképpen, ebben a munkában a Bacillus sp. 3.5AL2 optimális pH-ja 7,0 volt, ami nem igényel sav vagy lúg hozzáadását. Megállapításunk összhangban volt a dhalipari hulladékból izolált Bacillus sp. 60 °C-os optimális hőmérsékletével23 és a B. amyloliquefaciens 7,024-es optimális pH-értékével. Mindazonáltal a Bacillus sp. WA21 az amiláz optimális pH-értékét 6,0-nál mutatta ki, ami alacsonyabb, mint az ebben a vizsgálatban talált érték19.
Ez a fajta vizsgálat nagyon fontos a thaiföldi kereskedelmi amilázgyártás kiindulópontja szempontjából. Azonban további kutatási vizsgálatokra van szükség ahhoz, hogy az amilázgyártás költséghatékony legyen. Szükség van az enzim alapos jellemzésére, a termosztabilitás, a pH-stabilitás, a különböző fémionok és a különböző szubsztrátok, különösen a thaiföldi mezőgazdasági hulladékok és koncentrációik hatásának további meghatározására.
A fent említett összes szükséges adat megszerzése után úgy gondoljuk, hogy a kereskedelmi amiláz előállítása a thaiföldi enzimiparban növekvő és széles körben elterjedt lesz minden régióban, ami viszont az ország gazdaságának hasznára válik, mivel az amiláz enzim előállításához az ország saját erőforrásaira támaszkodik.
Következtetés
Ez az első jelentés 13 amiláztermelő baktérium izolátum azonosításáról a Nasinuan Community Forest, Maha Sarakham talajából. Az összes baktériumot Bacillus spp. néven azonosították, egy Enterobacter nemzetséghez tartozó kivételével. Ezek a baktériumok felhasználhatók amiláztermelésre, és a jövőben helyi és országos szinten alkalmazhatók a mezőgazdaságban, az élelmiszer-feldolgozásban és a textiliparban. Ezáltal csökken a más országokból származó ipari enzimimport költsége, fenntarthatóvá válik a helyi enzimtermelés és javul a nemzet gazdasága.
Köszönet
A szerzők köszönetet mondanak a Mahasarakham Egyetemnek (2018-as támogatási év) az SD-nek nyújtott pénzügyi támogatásért, valamint a Mahasarakham Egyetem Műszaki Karának (2017-es támogatási év) a VL-nek nyújtott támogatásért.
Érdekellentét
A szerzők nem nyilatkoznak érdekellentétről.
- Pandey A. Glucoamylase research: An overview. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A., and Osman G. Enzymatic properties of a novel thermostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus isolate ANT-6. Process Biochem. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., and Rai, V.A. Broader view: Mikrobiális enzimek és jelentőségük az iparban, az orvostudományban és azon túl. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., and Chauhan B. Microbial α-amylases: a biotechnological perspective. Process Biochem. 38:1599-1616 (2003).
- Takasaki Y. Egy maltotetrózt és maltopentózt termelő amiláz Circulansból. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable α-amylase producing strain. Appl Microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E., and Teague W.M. Purification & characterization of commercialized, cloned megaterium α-amylase. I. rész: tisztítási & hidrolitikus tulajdonságok. Keményítő. 43:319-323 (1991).
- Takasaki Y. Egy maltotriózt termelő amiláz subtilisből. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J., and Randall R.J. Protein measurement with the folin phenol reagents. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W. és Lipman D.J. Basic local alignment search tool. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Gaurav K., and Karthik L. Optimization, production and partial purification of extracellular α-amylase from Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. A celluláz aktivitások mérése. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., and Qadeer M.A. Production of α-amylase by Bacillus licheniformis using an economical medium. Biores Technol. 87:57-61 (2003).
- Mishra S., and Behera N. Amylase activity of starch degrading bacteria is isolated from soil receiving kitchen wastes. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., and Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from starchy soils. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp. Brazil J Microbiol. 33:57-61 (2002).
- Asad W. Extracellular enzyme production by indigenous thermophilic bacteria: Bacillus sp. WA21 által előállított α-amiláz részleges tisztítása és jellemzése. Pakistan J Botany. 43:1045-1052 (2011).
- Kim T.U. Purification and characterization of a maltotetraose-forming alkaline α-amylase from an alkalophilic Bacillus strain, GM8901. Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., and Pandey A. Solid culturing of Bacillus amyloliquefaciens for alpha amylase production. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H., and Ahmed R.S. Purification, and characterization of thermostable α-amylase produced by Bacillus licheniformis isolate AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., and Mulimani V.H. Isolation and identification of α-amylase producing Bacillus from Dhal
industry waste. Indian J Biochem Biophysics. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., and Khadiga A.A.T. Production of amylase from Bacillus amyloliquefaciens under submerged fermentation using some agro-industrialby-products. Ann Agri Sci. 60:193-202 (2015).
- Tamura K., and Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(12,737 látogatás, 21 látogatás ma)