- Bevezetés
- Módszerek
- Alanyok és felépítés
- MRI felvétel és standard térfogatértékelés
- Képek előfeldolgozása
- Diszkriminatív klaszterező szövetszegmentálás
- Parciális térfogatbecslés
- Neuropszichológiai értékelés
- Statisztikai elemzés
- Eredmények
- A vizsgálati személyek jellemzői
- Parciális WML-térfogatok és egyéb MRI-leletek
- A részleges WML-térfogatok mint a kognitív teljesítmény előrejelzői
- Diszkusszió
- A szerzők hozzájárulása
- Interdekütközésre vonatkozó nyilatkozat
- A köszönetnyilvánítás
- Kiegészítő anyagok
- Abbreviations
- Lábjegyzetek
Bevezetés
Az agyi kisérbetegség (SVD) a vaszkuláris kognitív károsodás és a demencia leggyakoribb oka. A fehérállományi elváltozások (WML) az SVD központi markere az agyi képalkotáson, a lacunaris infarktusokkal, a mikrovérzésekkel és az agysorvadással együtt. Mindezek a leletek bizonyítottan befolyásolják a klinikai és kognitív kimeneteleket (Jokinen és mtsi., 2011, 2012; Muller és mtsi., 2011; Poels és mtsi., 2012). A Leukoaraiosis and Disability (LADIS) tanulmány többek között kimutatta, hogy a WML összefügg a kognitív hanyatlással, a károsodott funkcionális képességekkel, a depresszióval, valamint a járás- és egyensúlyzavarokkal (LADIS Study Group, 2011).
A mágneses rezonancia képalkotás (MRI) a standard módszer a WML értékelésében. A kvantitatív képelemzési technikák közelmúltbeli jelentős fejlődése ellenére az MRI egyik fő akadálya még mindig a véges térbeli felbontás, ami részleges térfogathatásokhoz vezet. A zajjal és az inhomogenitással együtt ez nehézségeket okoz az agyi szegmentációs technikák számára. Gyakran az egészséges és a kóros szövetek közötti határok gondos elemzése szükséges az elváltozások kiterjedésének és súlyosságának meghatározásához, implicit “döntési küszöböt” alkalmazva az elváltozások szegmentálásához. Továbbá úgy tűnik, hogy a hiperintenzitások az MRI-ben csak a betegség folyamatának végstádiumát képviselik. A WML-hez szélesebb körű szövetkárosodás is társulhat, amely a rutin MRI-n nem látható (Schmidt és mtsai., 2011). Nincs szabvány a szövetkárosodás ilyen korai szakaszainak értékelésére, mivel intenzitásértékeik nem különülnek el kellőképpen a normál szövetekétől.
A legtöbb modern szegmentálási módszer előzetes információkra támaszkodik, például átlagos agyi atlaszokra (Smith et al., 2004; Ashburner és Friston, 2005; Goebel et al., 2006) vagy manuális címkézésre (Wismüller et al., 2004; Lee et al., 2009; Cruz-Barbosa és Vellido, 2011). A közelmúltban egy új, adatvezérelt szövetszegmentálási módszert javasoltak, amely diszkriminatív klaszterezési (DC) stratégián alapul, önfelügyelt gépi tanulási megközelítésben (Gonçalves et al., 2014). Ez a módszer minimálisra csökkenti az előzetes információk használatát, és multispektrális MRI-adatokat használ. Más, csak egészséges szöveteket (Pham és Prince, 1998; Van Leemput et al., 1999; Zhang et al., 2001; Manjón et al., 2010) vagy meghatározott típusú elváltozásokat (Van Leemput et al., 2001; Zijdenbos et al., 2002; Styner et al., 2008; Cruz-Barbosa és Vellido, 2011) célzó módszerekkel ellentétben a DC lehetővé teszi a normál és kóros szövettípusok széles körének vizsgálatát. A javasolt módszer másik nagy előnye, hogy képes az egyes voxelekre vonatkozó szöveti valószínűségek becslésére, ami a WML-fejlődés megfelelő jellemzéséhez szükséges. A voxelek kategorizálhatók úgy, hogy kis (még túl halvány ahhoz, hogy egyértelműen látható legyen), közepes vagy nagy arányú WML-t tartalmaznak. Azok, amelyek kis arányú elváltozást tartalmaznak, általában kívül esnek a hagyományos szegmentálás “döntési küszöbén”, és korai stádiumú WML-re utalnak.
A jelen tanulmányban arra összpontosítottunk, hogy megfigyeljük, hogyan kapcsolódnak az elváltozások különböző stádiumai a kognitív teljesítményhez egy enyhe vagy közepesen súlyos WML-ben szenvedő idős személyekből álló mintában. A felhasznált adatok egy 3 éves követési időszakban gyűjtött MRI-mérésekből és az ezen időszakon belüli éves neuropszichológiai értékelésekből álltak. Különösen annak megállapítására voltunk kíváncsiak, hogy még a legkorábbi stádiumban lévő, normálisnak tűnő agyszövetben lévő kis részleges WML-térfogatok is képesek-e önállóan előre jelezni a jövőbeli kognitív hanyatlást, kiegészítve a hagyományos módon értékelt WML-terhelést.
Módszerek
Alanyok és felépítés
A vizsgálati alanyok a LADIS tanulmány (egy európai multicentrikus vizsgálat, amely az életkorral összefüggő WML hatását vizsgálja a funkcionális függetlenségből a fogyatékosságba való átmenet során) három központból (Amszterdam n = 21, Graz n = 18, Helsinki n = 39) származó résztvevők alcsoportja (n = 78) voltak. A LADIS protokolljáról és a minta jellemzőiről máshol részletesen beszámoltunk (Pantoni és mtsai., 2005). Röviden összefoglalva, 11 központban 639 vizsgálati alanyt vontak be a következő befogadási kritériumok szerint: (a) 65-84 éves kor, b) enyhe vagy súlyos WML a felülvizsgált Fazekas-skála szerint (Pantoni és mtsai., 2005), c) nincs vagy minimális károsodás a mindennapi élet instrumentális tevékenységei skálán (8 tételből ≤ 1 veszélyeztetett) (Lawton és Brody, 1969), és d) rendszeresen elérhető informátor jelenléte. A kizárási kritériumok a következők voltak: (a) súlyos betegség, amely valószínűleg hajlamos a követésből való kimaradásra (szív-, máj- vagy veseelégtelenség, daganatos vagy egyéb releváns szisztémás betegség), (b) súlyos, nem kapcsolódó neurológiai betegség vagy pszichiátriai zavar, (c) nem vaszkuláris eredetű leukoencephalopathiák (immunológiai-demyelinizáló, metabolikus, toxikus, fertőző), és (d) az MRI-vizsgálatra való képtelenség vagy annak elutasítása.
Az alapvizsgálat magában foglalta az agyi MRI-t és az alapos orvosi, funkcionális és neuropszichológiai vizsgálatokat. A klinikai értékeléseket 12 hónapos időközönként megismételték három egymást követő utóvizsgálat során.
Az alanyok/központok közötti érvényes összehasonlítás lehetővé tétele érdekében az egyes központokban kapott MRI-szekvenciáknak azonosnak kellett lenniük, és minden betegnek három szekvenciával kellett rendelkeznie, nagyobb artefaktumok nélkül. A vizsgálatba bevont 78 alany nem különbözött a teljes LADIS-kohorttól életkor, nem, a kiindulási Mini-Mental State Examination (MMSE) pontszám vagy a WML térfogata tekintetében, de szignifikánsan magasabb volt az iskolai végzettségük (9,3 vs. 11,7 év; t = -4,6, p < 0,001).
A vizsgálatot a LADIS-vizsgálatban résztvevő valamennyi központ etikai bizottsága jóváhagyta (LADIS Study Group, 2011). Minden alany tájékozott írásbeli beleegyezést kapott és írt alá. A LADIS vizsgálatban közreműködők a II. függelékben szerepelnek.
MRI felvétel és standard térfogatértékelés
A felhasznált axiális MRI felvételeket 1.5T berendezéssel, minden központban ugyanazt a protokollt követve, beleértve a magnetizációs transzfer felvételeket (TE = 10-14 ms, TR = 740-780 ms), T2-súlyozott gyors spin echo felvételeket (TE = 100-120 ms, TR = 4000-6000 ms) és FLAIR (fluid attenuated inversion recovery) felvételeket (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Minden szekvencia voxelmérete 1 × 1 × 5-7,5 mm3 volt, FOV = 250 és a szeletek közötti rés 0,5 mm.
A fehérállományi régiókban, beleértve az infratentoriális régiót is, a hiperintenzitások kiterjedését az axiális FLAIR-képeken félautomata volumetrikus elemzéssel (VFLAIR) értékelték egy Sparc 5 munkaállomás (SUN) segítségével (van Straaten et al., 2006). Az elváltozásokat megjelöltük, és a határokat minden egyes szeleten helyi küszöbérték meghatározásával (saját fejlesztésű Show_Images szoftver, 3.6.1 verzió) állítottuk be. Nem tettünk különbséget a szubkortikális és a periventrikuláris hiperintenzitások között. A T2-súlyozott képeken az infarktusok és a lacunák körüli hiperintenzitású területeket figyelmen kívül hagytuk. A lacune-ok számát a fehérállományban és a mély szürkeállományban FLAIR-, magnetizációval előkészített gyors akvizíciójú gradiens-echó- és T2-képek kombinációjával rögzítettük, hogy megkülönböztessük a lacune-okat a perivaszkuláris terektől és a mikrovérzésektől (Gouw és mtsai., 2008). Ezenkívül az agyi atrófiát egy sablonalapú minősítési skála szerint értékelték a FLAIR-képeken, külön a kérgi és szubkortikális régiókban (Jokinen et al, 2012).
Képek előfeldolgozása
Az egyes voxelekben található multispektrális információ minden egyes alanyban pontosan ugyanarról a helyről származik, ezért az összes rendelkezésre álló szekvenciára az SPM5 eszköztár (Friston, 2003) segítségével, affin transzformációt alkalmazva, a legalacsonyabb felbontású képet, jellemzően FLAIR képet használva sablonként, betegen belüli regisztrációt végeztünk. Továbbá az extra-meningeális szöveti voxeleket egy standard automatikus módszerrel (BET2) maszkoltuk ki (Smith et al., 2004).
Diszkriminatív klaszterező szövetszegmentálás
A gépi tanulási technikák legújabb fejlődése versenyképes eredményeket mutat a szövetszegmentálásban, gyakran felülmúlva a klasszikus régiónövesztő vagy küszöb alapú módszerekkel elért pontosságot (Styner et al., 2008). Különösen a kézi lehatároláshoz képest robusztusabbak és kevésbé szubjektívek. Az ebben a tanulmányban használt szövetszegmentálási módszer egy ilyen gépi tanulási technika volt, amely egy adatvezérelt önfelügyelt módszertanon alapul, amely egy DC stratégiában gyökerezik (Gonçalves et al., 2014). A felügyelet nélküli klaszterezési algoritmusokhoz, például a k-közelebbi szomszédokhoz hasonlóan a DC a bemeneti adatokat a többdimenziós szürkeségi eloszlási információik alapján csoportosítja. Jelen tanulmányban ezek az eloszlások háromdimenziósak voltak, amelyek megfelelnek a felhasznált szekvenciák teljes számának. A DC legfőbb előnye, hogy képes kis mennyiségű címkézett információt használni a klaszterezési hozzárendelés támogatására. Ez a tulajdonság a szegmentálási eredmények egyértelmű javulásához vezet, a hagyományos klaszterezési technikákon túl (Gonçalves et al., 2014).
A DC általános célja tehát úgy foglalható össze, hogy az adattér klaszterezett régiókra particionálja az adattér egészét, meglehetősen egységes eloszlással, és az egyes klaszterekhez tartozó összes voxelhez konzisztens címkeinformációval. Részletesebb magyarázatot az I. függelékben találunk, a teljes matematikai leírást pedig Gonçalves et al. (2014) tartalmazza.
Parciális térfogatbecslés
A DC megadja az egyes voxelek valamennyi szöveti osztályhoz való tartozásának valószínűségét, lehetővé téve a részleges térfogatinformáció becslését. Mivel vizsgálatunkat a léziós voxelekre kívántuk összpontosítani, csak azokat elemeztük, ahol a jelenlévő léziós szövetek aránya releváns.
Ebben a vizsgálatban három különböző léziós kategóriát azonosítottunk, ami megfelelő mennyiségű térfogatbecslést eredményezett: azon voxelek térfogatát, amelyek NAGY (VDC100), KÖZEPES (VDC66) vagy KIS (VDC33) valószínűséggel léziósak. A VDC100 és a VDC66 azok a térfogatok, amelyekben a voxelekben lévő fő szövetnek >66%, illetve < 66% a valószínűsége arra, hogy lézió legyen. Mivel mind a VDC100, mind a VDC66 térfogat többségében léziós szövetet tartalmaz, a VFLAIR1 összegével közelíthető: VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. Ezért a DC használatával a látható lézió térfogatának lehető legjobb becslését a VDCHARD segítségével érhetjük el. Az utolsó kategória, a VDC33 azon voxelek térfogatának felel meg, ahol az elváltozás a második legvalószínűbb szövettípus, valószínűsége ≥ 33%. Megjegyzendő, hogy ezt a térfogatot a szokásos szegmentációs módszerek, például a VFLAIR-t becslő módszerek nem tekintik léziónak, mivel ott soha nem a lézió a fő szövettípus.
A jelen szegmentációs módszer korai stádiumú léziók felismerésére való képességét a betegek egy alcsoportján (n = 19), nyomon követő MRI-adatokkal igazoltuk, vö. kiegészítő anyagok: I. függelék). Ott kimutattuk, hogy a kis részleges WML-térfogatok jelzik a teljesen kifejlődött léziók lehetséges jövőbeli helyeit.
Neuropszichológiai értékelés
A LADIS-vizsgálat kognitív tesztbattériája az MMSE-t (Folstein és mtsi., 1975), a Vascular Dementia Assessment Scale-Cognitive Subscale (VADAS) (Ferris, 2003), a Stroop-tesztet (MacLeod, 1991) és a Trail making tesztet (Reitan, 1958) tartalmazta. Jelen célokra az MMSE és a VADAS összpontszámát használtuk a kognitív funkciók globális mérésére. Ezenkívül három pszichometrikusan robusztus összetett mérést alkottunk a specifikus kognitív területek értékelésére az egyes altesztek átlagolt standard pontszámainak felhasználásával, a korábban leírtak szerint (Moleiro és mtsai., 2013): (1) sebesség és motoros kontroll = z-pontszámok (A pálya készítése + labirintus + számjegyek törlése)/3; (2) végrehajtó funkciók = z-pontszámok /4; és (3) memória = z-pontszámok (azonnali szófelidézés + késleltetett felidézés + szófelismerés + számjegytartomány)/4.
A neuropszichológiai tesztváltozókban a hiányzó értékek aránya 0 és 6,4% között változott a kiinduláskor, és 24,4 és 32,1% között az utolsó követéses értékeléskor. Ez az adatvesztés a vizsgálati alanyok halála (n = 2), a neuropszichológiai követéses értékelésből való kimaradás (utolsó éves látogatás, n = 17) vagy a teljes tesztcsomag kitöltésének képtelensége (n = 6) miatt következett be.
Statisztikai elemzés
A longitudinális kognitív teljesítmény előrejelzőit lineáris kevert modellek (korlátozott maximális valószínűségű becslés) segítségével elemezték, amelyek képesek kezelni a hiányzó értékeket és az összetett kovariancia-struktúrákat. Az értékelési évet (kiindulási, 1., 2. és 3.) alanyon belüli változóként használtuk, és strukturálatlan kovarianciastruktúrát fogadtunk el. A kognitív teszteredményeket függő változóként határoztuk meg. A részleges léziós térfogatokat (VDC33, VDC66 és VDC100) egyenként prediktorként vizsgáltuk. Minden modellben az életkor, a nem és az iskolai végzettség évei kovariátorként szerepeltek. A modelleket megismételtük a VFLAIR mint további kovariáns hozzáadásával, hogy kiderítsük a részleges térfogatmérések prediktív értékét a konvencionálisan értékelt WML-térfogat mellett. Hasonlóképpen a vizsgálati központot is hozzáadták potenciális zavaró tényezőként, de mivel nem volt lényeges hatása az eredményekre, kihagyták a végső elemzésekből. A keverékmodellek linearitási feltételezését esetleg veszélyeztető ferde eloszlások miatt mindhárom részleges térfogatmérésre és a VFLAIR-re logaritmikus transzformációt alkalmaztunk. Az eredményeket az IBM SPSS Statistics 22 vegyes modullal elemeztük. A statisztikai szignifikanciát minden elemzésnél p < 0,05-nél állapítottuk meg.
Eredmények
A vizsgálati személyek jellemzői
A vizsgálati személyek kiindulási jellemzőit az 1. táblázat tartalmazza. A felülvizsgált Fazekas-skála szerint 28 (35,9%) alanynál enyhe, 26 (33,3%) közepes és 24 (30,8%) súlyos WML volt.

1. táblázat. A vizsgálati alanyok kiindulási jellemzői, n = 78.
Parciális WML-térfogatok és egyéb MRI-leletek
Az 1. táblázat a hagyományos szegmentációs módszerrel kapott térfogatokat, a DC-vel becsült részleges léziós térfogatokat és a két szegmentációs módszert összehasonlító Dice hasonlósági együtthatót mutatja. Az 1. ábra az eredeti FLAIR-kép (1A), a hagyományos módon becsült hiperintenzitású térfogat, a VFLAIR (1B), valamint a VDC100 (1C), VDC66 (1D) és VDC33 (1E) részleges WML-térfogatokra kapott eredmények összehasonlítását mutatja be. Az 1F-1J képkockák a megfelelő képeket mutatják az 1A képkocka fehér téglalapjával jelölt nagyított területen. Az 1H-J képkockákon látható az elváltozás gócai körüli fejlődés, a középen lévő teljes kiégéstől a köztes stádiumig és a széleken lévő kis arányú elváltozásig. Megjegyzendő, hogy a VDC33-nak minősített voxelek nem szerepelnek a VFLAIR-ben, de jelzik a jövőbeli léziók lehetséges helyeit. A 2. ábra hasonló eredményeket mutat be egy magasabb, centrum semiovale szinten. A DC szegmentációs eljárás három különböző szekvenciát használt (FLAIR, T2, T1). Itt csak a FLAIR-t mutatjuk be szemléltetés céljából.
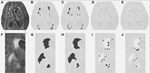
1. ábra. Fehérállományi elváltozások (WML) középszintű magasságban. (A) FLAIR kép egy adott alany esetében. (B) Konvencionálisan becsült WML. (C-E) A javasolt szegmentáló algoritmus segítségével becsült WML a teljes, a középső és a kis arányú lézióra. (F-J) Hasonló képek az (A) fehér kerettel ábrázolt, nagyított részhez.
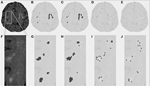
2. ábra. Fehérállományi elváltozások (WML) a centrum semiovale-ban. (A) FLAIR-kép egy adott alany esetében. (B) Konvencionálisan becsült WML. (C-E) A javasolt szegmentációs algoritmussal becsült WML, teljes, köztes és kis arányú elváltozás esetén. (F-J) Hasonló képek az (A) fehér kerettel ábrázolt nagyított részhez.
A teljes felhasznált adathalmaz esetében a három részleges WML térfogatmérték szignifikánsan korrelált egymással: VDC33*VDC66 r = 0,87; VDC33*VDC100 r = 0,47; VDC66*VDC100 r = 0,47 (p < 0,001). Szignifikánsan korreláltak a VFLAIR-rel is: VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023), illetve VDC100 r = 0,87 (p < 0,001). Az intézkedések azonban nem voltak szignifikánsan kapcsolatban a lacunaris infarktusok jelenlétével (nincs/kevés/ sok) vagy a globális agyi atrófia pontszámmal (kortikális és szubkortikális) (p > 0,05).
A 3. ábra a hagyományos szegmentáció (VFLAIR) és a DC (VDCHARD) közötti közös és eltérő szegmentációkat azonosítja az 1. ábrán szereplő alany esetében. A két szegmentáció között egyértelmű átfedés van, amit a zöld pixelek nagy száma mutat. Az ábrán látható alany esetében a VFLAIR és a VDCHARD között kis különbség van.
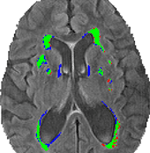
3. ábra. A szegmentálási módszerek összehasonlítása. Ez a kép a félautomata volumetrikus elemzés (VFLAIR) és a diszkriminatív klaszterezés (VDCHARD) segítségével kapott szegmentációt mutatja az 1. ábrán látható alany esetében. A zölddel ábrázolt régiók megfelelnek a két megközelítés közötti átfedő szegmentációnak. Pirossal vannak ábrázolva a hagyományos módszerrel csak elváltozásként besorolt régiók, míg a kék a DC által csak elváltozásként besorolt voxeleknek felel meg.
Egy alany teljes szöveti osztályozásának becslése a DC használatával egy Intel® Core™ i5-4590 CPU@ 3,30 GHz-es processzorral és 16 GB RAM-mal rendelkező PC-n körülbelül 25 percet vett igénybe. A címkék becslése az említett számítógépen körülbelül 70 percet vett igénybe. Az utóbbi becslés javítása jelentősen egyszerűsítené az eljárást.
A részleges WML-térfogatok mint a kognitív teljesítmény előrejelzői
A részleges WML-térfogatok és a longitudinális kognitív teljesítmény közötti kapcsolatokat a 2. táblázat foglalja össze. Az életkor, a nem és az iskolai végzettség szerint korrigált lineáris kevert modellek szignifikáns negatív összefüggést mutattak a VDC33 és a végrehajtó funkciók összetett pontszáma között. Először is, a VDC33 szignifikáns főhatással társult a végrehajtó teljesítmény általános szintjéhez (a négy időbeli értékelés átlagában kapott pontszámok). Másodszor, a VDC33 és az idő (értékelési év) közötti kölcsönhatás jelezte a VDC33 szignifikáns előrejelző értékét a végrehajtó teljesítmény változására a 3 éves követés során. Konkrétan, a VDC33 magasabb terhelése a kiinduláskori rosszabb teljesítményhez és a végrehajtó funkciók meredekebb csökkenéséhez kapcsolódott minden egyes következő értékelési évben. A VFLAIR további kiigazítása után ezek az eredmények változatlanok maradtak. Ezenkívül gyenge kapcsolat volt a VDC33 és a VADAS összpontszám között, de ez az eredmény már nem volt szignifikáns a VFLAIR kontrollálása után.A VDC33-nak nem volt szignifikáns fő hatása vagy kölcsönhatása az idővel az MMSE, a VADAS, a feldolgozási sebesség vagy a memóriafunkciók tekintetében.
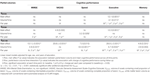
2. táblázat. A részleges fehérállomány-elváltozások térfogata és a kognitív teljesítmény közötti kapcsolat a 3 éves követés során.
A VDC66 szignifikáns főhatásokkal állt kapcsolatban, amelyek a VADAS és a végrehajtó funkciók rosszabb általános teljesítményszintjét jelezték. A VDC66 és az idő közötti interakció csak a feldolgozási sebesség esetében volt szignifikáns. Az eredmények vizsgálata az egyes időpontokban szignifikáns kiindulási összefüggést mutatott (VADAS, végrehajtó funkciók), valamint longitudinális változást az első (VADAS, végrehajtó funkciók), a második (MMSE, végrehajtó funkciók) és a harmadik (végrehajtó funkciók) követési évre. A VFLAIR kontrollja minimális hatással volt ezekre az eredményekre (2. táblázat).
Végezetül, a VDC100 szignifikáns főhatásokkal járt valamennyi neuropszichológiai pontszámban. A VDC100*idő interakciók szignifikáns kapcsolatot jeleztek a nyomon követés során bekövetkezett változással az öt kognitív mérésből négyben. Ebben a szakaszban az elváltozások szisztematikusan társultak a kognitív teljesítményhez már a kiindulási szakaszban. Ezen túlmenően a teljesítmény meredekebb csökkenése volt nyilvánvaló az első és az utolsó nyomon követési értékelés között, a különböző kognitív mérések bizonyos eltéréseivel. Ezen eredmények többsége a VFLAIR további kontrollálása után is fennmaradt, annak ellenére, hogy a VDC100-zal való magas korrelációja ellenére (2. táblázat).
A VDC33 és a VDC66 ellenére a VFLAIR a VADAS és a végrehajtó funkciók teljes teljesítményének szignifikáns előrejelzője maradt a követési időszak alatt. A VFLAIR-nek azonban nem volt a VDC100-at kiegészítő független prediktív értéke a kognitív mérések egyikénél sem.
Diszkusszió
Ez a tanulmány a részleges WML longitudinális kognitív hatását vizsgálta, a normálisnak tűnő fehérállomány leghalványabb elváltozásaitól a teljesen kifejlődött elváltozásokig. A vizsgálat egy új, DC-n alapuló, önfelügyelt, multispektrális MRI-szövetszegmentációs módszert használt (Gonçalves és mtsai., 2014), és évente megismételt neuropszichológiai értékeléseket végzett a 3 éves követés során. A különböző szövettípusokat az összes rendelkezésre álló MRI-szekvencia egyidejű felhasználásával azonosították. A WML-t ezután a részleges térfogatok szerint kis, közepes és teljes lézióként kategorizáltuk.
A hagyományos manuális szövetszegmentációval ellentétben, ahol a döntés egy implicit szürkeárnyalat-küszöbérték alapján történik, a javasolt módszer hozzáférést biztosít a “küszöbérték alatti” információkhoz az elváltozásokkal kapcsolatban. Ez lehetővé teszi az elváltozás progressziójának jobb értékelését (minőségi információ), valamint a szubvoxel volumetriát (mennyiségi információ). Léteznek más módszerek is, amelyek a szöveti arányokról nyújtanak információt (Van Leemput et al., 2003; Manjón et al., 2010). Ezek azonban bizonyos előfeltételeket használnak, amelyek alkalmatlanná teszik őket a WML kimutatására, például azt a feltételezést, hogy egy voxel nem tartalmazhat kettőnél több szövettípust.
A jelen vizsgálat fő megállapítása az volt, hogy még a legkisebb részleges WML-térfogat, a VDC33 is szignifikánsan összefüggött a rosszabb végrehajtó teljesítménnyel már a kiinduláskor, és előre jelezte a végrehajtó funkciók jövőbeli romlását a 3 éves követés során. Ez a hatás független volt a demográfiai tényezőktől és nevezetesen a FLAIR-képeken konvencionálisan értékelt hiperintenzitási térfogattól is. A vizsgálati alanyok egy alcsoportjában emellett kimutattuk, hogy a VDC33 valószínűleg a normálisnak tűnő fehérállomány legkorábbi változásait képviseli, mivel a kiinduláskor történő észlelésük jelezte a teljesen kifejlődött elváltozások jövőbeli helyét a követés után (I. függelék).
A köztes stádiumú elváltozások, a VDC66, függetlenül társultak a kiterjedtebb kognitív hanyatlással, beleértve a feldolgozási sebesség és a végrehajtó funkciók, valamint a globális kognitív funkciók változásait. Sőt, a teljes stádiumú elváltozások, a VDC100, még kifejezettebb, az összes értékelt kognitív területre kiterjedő hatásokkal álltak összefüggésben, mind a kiindulási, mind az utánkövetés során. Nem meglepő, hogy a VDC100 a kognitív hanyatlás erős előrejelzője. Mivel a VDC100 magasan korrelált a VFLAIR-rel, amely korábban erős összefüggést mutatott a kognitív változásokkal (Jokinen et al., 2011; Kooistra et al., 2014), meglehetősen hasonló előrejelző erővel kell rendelkeznie.
A jelen kutatás újszerű és legfontosabb eredménye, hogy a döntési küszöb alatt észlelt elváltozások térfogata már lehetővé teszi az egyes kognitív pontszámok előrejelzését. A kognitív hanyatlás legkorábbi jeleit kifejezetten a végrehajtó funkciókban találtuk, amelyek feltételezhetően alapvetően a fehérállomány prefrontális-szubkortikális kapcsolatainak integritására támaszkodnak (O’sullivan et al., 2001), A végrehajtó funkciók olyan kognitív kontrollfolyamatokat foglalnak magukban, mint a mentális rugalmasság, a gátlás és a komplex célvezérelt viselkedéssel kapcsolatos tervezés. Ezek a funkciók döntő fontosságúak az egyén funkcionális képességei szempontjából a mindennapi életben (Tomaszewski Farias et al., 2009).
A cikkben bemutatott eredmények alátámasztják azt a hipotézist, hogy a WML hiperintenzitások csak “a jéghegy csúcsát” jelentik, míg valójában a fehérállomány károsodása SVD-ben fokozatosan, az agy szélesebb területeit érintő folyamatként alakul ki (Schmidt et al., 2011; Maillard et al., 2013). Diffúziós képalkotó vizsgálatok kimutatták, hogy a finom mikroszerkezeti változások, még a normálisnak tűnő agyszövetben is, összefüggnek a kognitív károsodással, és előre jelzik a rossz kognitív és klinikai kimenetelt a követés során (Schmidt és mtsi., 2010; Jokinen és mtsi., 2013). A mikroszerkezeti integritás különösen a WML közelében csökken, amint azt a frakcionális anizotrópia mutatja (Maillard és mtsai., 2011). Ez a “WMH penumbra”-nak nevezett jelenség összefügghet a vizsgálatunkban megfigyelt korai stádiumú részleges WML térfogatokkal. Ugyanakkor az elváltozás korai kezdetei a teljesen kifejlődött WML-től bizonyos távolságban is előfordulhatnak, amint azt az I. függelék részletesen bemutatja. Tudomásunk szerint ezeknek a szubliminális fókuszos elváltozásoknak a kognitív kimenetellel való kapcsolatát korábban még nem mutatták ki.
A jelen minta idősebb alanyok vegyes csoportjából áll, egyenlően rétegezve a WML minden súlyossági fokára, az enyhétől a súlyosig. A résztvevőket különböző környezetben, különböző beutalási okok alapján toborozták, reprezentálva a klinikai gyakorlatban előforduló WML-es betegek sokféleségét (LADIS Study Group, 2011). A vizsgálati alanyok e heterogenitása azonban elhomályosíthatja a képalkotó leletek és a kognitív hanyatlás közötti legfinomabb hatásokat. Az öregedéssel és a cerebrovaszkuláris betegségekkel foglalkozó longitudinális vizsgálatokra jellemzően néhány adat elveszett, mert a vizsgálati alanyok kiestek a követésből, vagy nem tudták befejezni a teljes kiértékelést.
Korlátozásként a LADIS képalkotási protokollt eredetileg nem a jelenlegi kvantitatív szegmentációs módszerhez tervezték, így az eredeti képalkotási adatoknak csak egy részét lehetett felhasználni. Továbbá a képzaj, a felbontás és a mozgási artefaktumok mind olyan tényezők, amelyek befolyásolhatják egy olyan multicentrikus vizsgálat eredményét, mint az itt bemutatott. Ez különösen igaz a részleges térfogathatások kezelésénél. E korlátozások ellenére, és a fent említett zavaró tényezők némelyikének korrigálása után képesek voltunk az elváltozás progressziójára utaló finom jeleket kimutatni, olyan voxelek alapján, amelyek kis valószínűséggel léziónak minősültek.
A jelen kéziratban bemutatott eredmények megbízhatóságának javítása érdekében nagyobb kohorszot is figyelembe lehetett volna venni. A központok közötti konzisztenciával kapcsolatos aggályok és a képalkotó beállítások különböző időpontokban történő változása miatt szigorúbb irányelveket kellene alkalmazni az alkalmazott MRI-szekvenciák tekintetében.
A tanulmány erősségei közé tartozik egy új, robusztus, önfelügyelt és adatvezérelt képelemzési módszer, amely lehetővé teszi a szövettípusok azonosítását és a kóros agyi elváltozások számszerűsítését egy nagyon korai szakaszban, ahol a hagyományos MRI-értékelés nem lenne hasznos. A vizsgálat előnyére váltak a részletes neuropszichológiai értékelések is, amelyeket 3 éves követési időközönként végeztek.”
Végeredményben a normálisnak tűnő fehérállomány korai változásai már a progresszív romlásra és a rossz kognitív kimenetelre utalnak. Ebben a szakaszban elsősorban a végrehajtó funkciók érintettek, de a kognícióra gyakorolt káros hatás globálisabbá válik, amikor az elváltozások fokozatosan teljes értékű WML-vé alakulnak, ami végül a hagyományos MRI-szöveti szegmentáción is kimutatható. Ezek az eredmények megerősítik a javasolt multispektrális MRI-szövetszegmentációs módszert, mint olyan ígéretes eszközt, amely additív értékkel bír az SVD kockázatának és a klinikailag jelentős progresszív kognitív hanyatlásnak a felismerésében.
A szerzők hozzájárulása
A kéziratot minden szerző kritikusan átdolgozta a fontos szellemi tartalom miatt. Ezen túlmenően az egyes szerzők legközpontibb munkája a tanulmányhoz a következő volt: HJ; Felelős vizsgáló és levelező szerző, a tanulmány tervezése és koncepciójának kidolgozása, neuropszichológiai és klinikai adatgyűjtés, statisztikai elemzés és értelmezés, a kézirat szerkesztése és befejezése. NG; Felelős vizsgálatvezető, a tanulmány tervezése és koncepciójának kidolgozása, az MRI szegmentációs módszer kidolgozása, az MRI-adatok elemzése, a kézirat szerkesztése és befejezése. RV; az MRI szegmentációs módszer kidolgozása, az MRI-adatok elemzése, a tanulmány tervezése és koncepciójának kidolgozása. JL; Szakértelem a statisztikai elemzésben és értelmezésben. FF; A LADIS vizsgálat megtervezése, az MRI-módszerekért felelős. RS; A LADIS-vizsgálat tervezése, felelős az MRI-módszerekért. FB; a LADIS-vizsgálat tervezése, felelős az MRI-módszerekért. SM; a neuropszichológiai tesztek összeállítása, neuropszichológiai és klinikai adatgyűjtés. AV; neuropszichológiai és klinikai adatgyűjtés. DI; A vizsgálat koordinátora, a LADIS irányítóbizottság tagja, a LADIS vizsgálat tervezése. LP; A LADIS vizsgálat koordinálása és tervezése. TE; A LADIS irányítóbizottság tagja, a LADIS vizsgálat tervezése, a vizsgálat koncepciója és tervezése. HJ és NG egyenlő mértékben járultak hozzá a munkához.
Interdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A köszönetnyilvánítás
A Leukoaraiosis and Disability Study-t az Európai Unió támogatta (QLRT-2000-00446 támogatás). HJ munkáját a Helsinki Egyetemi Központi Kórház Klinikai Kutatóintézetének és az Orvosi Kutatási Alapnak, valamint az Ella és Georg Ehrnrooth Alapítványnak az ösztöndíjai támogatták. NG munkáját a Fundação para a Ciência e Tecnologia SFRH/BD/36178/2007 számú támogatása támogatta.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők a következő címen: https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Abbreviations
DC, discriminative clustering; FLAIR, fluid-attenuated inversion recovery; LADIS, Leukoaraiosis and Disability Study; MMSE, Mini-Mental State Examination; MRI, magnetic resonance imaging; SVD, small vessel disease; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale; VDC33, az elváltozás kis részét tartalmazó voxelek térfogata; VDC66, az elváltozás közepes részét tartalmazó voxelek térfogata; VDC100, az elváltozás teljes részét tartalmazó voxelek térfogata; VDCHARD = VDC100 + VDC66; VFLAIR, a FLAIR-képek hagyományos, félautomata elemzésével mért WML-térfogat; WML, fehérállományi elváltozás.
Lábjegyzetek
1. ^VFLAIR, a FLAIR-képeken hagyományos félautomata elemzéssel mért WML térfogat.
2. ^VDCHARD, azon voxeleknek megfelelő térfogat, ahol a szövetek többsége elváltozás.
Ashburner, J., and Friston, K. J. (2005). Egységes szegmentálás. Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., and Vellido, A. (2011). Az emberi agydaganatok félig felügyelt elemzése részlegesen címkézett MRS-információkból sokrétű tanulási modellek segítségével. Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S012906571100262626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). A megismerés általános mérései. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini-mentális állapot. gyakorlati módszer a betegek kognitív állapotának osztályozására a klinikus számára. J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). “Statistical parameter mapping. a practical guide.” in Neuroscience Databases, szerk. R. Kötter (New York, NY: Springer), 237-250. Elérhető online a következő címen: http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., and Formisano, E. (2006). A funkcionális képelemző versenyadatok elemzése a brainvoyager QX segítségével: az egy alanyra vonatkozó elemzéstől az agykérgi összehangolt csoportos általános lineáris modellelemzésig és az önszerveződő csoportos független komponenselemzésig. Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., and Vigário, R. (2014). Önfelügyelt MRI szövetszegmentálás diszkriminatív klaszterezéssel. Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. (2008). A fehérállományi hiperintenzitások progressziója és az új lacunák előfordulása 3 év alatt: a Leukoaraiosis and Disability study. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. (2011). Az incidens lacunes befolyásolja a kognitív hanyatlást: a LADIS tanulmány. Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. (2012). Az agyi atrófia felgyorsítja a kognitív hanyatlást agyi kisérbetegségben: a LADIS tanulmány. Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. (2013). A diffúziós változások előrejelzik a kognitív és funkcionális kimeneteleket: a LADIS vizsgálat. Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Vaszkuláris agyi elváltozások, agyi atrófia és kognitív hanyatlás. az artériás betegségek második manifesztációi – mágneses rezonancia (SMART-MR) tanulmány. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011: A LADIS (Leukoaraiosis And DISability) tanulmány egy évtizede: mit tudtunk meg a fehérállomány-változásokról és a kisérbetegségekről? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., and Brody, E. M. (1969). Idősek értékelése: a mindennapi élet önfenntartó és instrumentális tevékenységei. Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). MR-képek szegmentálása teljesítménytranszformációs megközelítéssel. IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Fél évszázadnyi kutatás a stroop-hatásról: integratív áttekintés. Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. (2013). A FLAIR és a diffúziós MRI-jelek független előrejelzői a fehérállományi hiperintenzitásoknak. Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. (2011). Fehér anyag hiperintenzitású penumbra. Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., and Robles, M. (2010). A részleges térfogati együtthatók javított becslése zajos agyi MRI-ből térbeli kontextus felhasználásával. Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. (2013). A LADIS vizsgálat neuropszichológiai értékelő akkumulátorának megerősítő faktorelemzése: longitudinális elemzés. J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., and Geerlings, M. I. (2011). Agysorvadás és kogníció: kölcsönhatás a cerebrovaszkuláris patológiával? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., and Markus, H. S. (2001). Bizonyítékok az agykérgi “szétkapcsolódásra” mint az életkorral összefüggő kognitív hanyatlás mechanizmusára. Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. (2005). Az életkorral összefüggő agyi fehérállomány-változások hatása a fogyatékosságba való átmenetre – a LADIS tanulmány: indoklás, tervezés és módszertan. Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., and Prince, J. L. (1998). Részleges térfogatbecslés és a fuzzy C-means algoritmus. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Az agyi mikrovérzések rosszabb kognitív funkcióval járnak: a rotterdami szkenneléses vizsgálat. Neurology 78, 326-333. doi: 10.1212/WNL.0b013e318242452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). A nyomkeresési teszt érvényessége mint a szerves agykárosodás mutatója. Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. (2010). Diffúzió-súlyozott képalkotás és kogníció a leukoariosis and disability in the elderly study-ban. Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. (2011). Heterogenitás az életkorral összefüggő fehérállomány-változásokban. Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. (2004). Fejlemények a funkcionális és strukturális MR-képek elemzésében és FSL-ként való megvalósításában. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. (2008). “3D szegmentáció a klinikumban: egy nagy kihívás II: MS léziók szegmentálása,” MIDAS Journal, MICCAI 2008 Workshop. Elérhető online a következő címen: http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). A memória és a végrehajtó működés longitudinális változásai összefüggnek a mindennapi élet instrumentális tevékenységeinek longitudinális változásával idősebb felnőtteknél. Clin. Neuropsychol. 23, 446-461. doi: 10.1080/13854040802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (1999). Az agy MR-felvételeinek automatizált, modellalapú szöveti osztályozása. IEEE Trans. Med. Imaging 18, 897-908. doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., and Suetens, P. (2001). Sclerosis multiplex léziók automatizált szegmentálása kiugró modellek detektálásával. IEEE Trans. Med. Imaging 20, 677-688. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). Egységesítő keretrendszer agyi MR-képek részleges térfogat-szegmentálására. IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). A fehérállományi hiperintenzitások pontozási módszerének hatása a klinikai adatokkal való korrelációra: a LADIS vizsgálat. Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., and Ritter, H. (2004). Teljesen automatizált orvosbiológiai képszegmentálás önszerveződő modelladaptációval. Neural Netw. 17, 1327. doi: 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., and Smith, S. (2001). Agyi MR-képek szegmentálása rejtett Markov-véletlenmező modell és az elvárás-maximáló algoritmus segítségével. IEEE Trans. Med. Imaging 20, 45-57. doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002). A háromdimenziós MRI-adatok automatikus csővezetékes elemzése klinikai vizsgálatokhoz: alkalmazás a sclerosis multiplexre. IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar