- Introduction
- Anyagok és módszerek
- A résztvevők
- Kutatási eljárások, EEG-adatgyűjtés és elemzés
- Eredmények
- Tagadók
- Resting State EEG
- Fp1 csatorna teljesítményspektrális sűrűségének (PSD) összehasonlítása
- Fp1 csatorna nyugalmi EEG teszt/vizsgálat összehasonlítása
- Diszkusszió
- Author Contributions
- Finanszírozás
- Interdekütközési nyilatkozat
- Megköszönések
Introduction
A neurodegeneratív betegségek hatalmas globális, kielégítetlen orvosi igényeket képviselnek, és új, betegségmódosító terápiák kifejlesztését igénylik. Tekintettel e rendellenességek alattomos természetére és számos diagnosztikai teszt magas költségeire, jelentős szükség van széles körben elérhető, megbízható és olcsó biomarkerekre, amelyekkel a neurodegeneratív folyamatok progresszióját a gyógyszerfejlesztésre alkalmas időkeretben nyomon lehet követni. Ebben az összefüggésben az EEG-ben figyelemre méltó lehetőségek rejlenek. Bár az EEG érzékeny az ismert életmódbeli tényezőkre és gyógyszerekre, számos jelentős előnye van. Az EEG tükrözi a szinaptikus aktivitást, amely a neurodegeneratív folyamatok funkcionális hatásának közös nevezője. Az EEG nem invazív, hordozható, biztonságos és olcsó technológia, amely széles körben elfogadott és viszonylag rövid adatgyűjtési időt igényel. A kvalitatív EEG-t rutinszerűen használják a klinikai gyakorlatban az epilepszia diagnosztizálására. A közelmúltban a kvantitatív EEG biomarker (qEEG) és a klinikai értékelés integrációját javasolták a figyelemhiányos/hiperaktivitási zavar (ADHD) értékelésére, és az FDA-tól (Food and Drug Administration) II. osztályú minősítést kapott az ADHD klinikai értékelésének támogatására (Lenartowicz és Loo, 2014; Snyder et al., 2015). A qEEG vizsgálat alatt áll a neurodegeneratív betegségek klinikai vizsgálatokban végpontként való felhasználására. Az adatelemzés, az értelmezés és a jobb térbeli felbontás terén a közelmúltban elért előrelépések azonban növelték az EEG mint a neurodegeneratív betegségek progressziójának megbízható, pontos biomarkere potenciálját. Számos jelentett megfigyelési nyugalmi állapotú qEEG-elemzés alátámasztja potenciális értékét, mint biomarkert az Alzheimer-kórban előforduló neurodegeneráció neurális szignatúráinak kimutatására (Babiloni et al., 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), Parkinson-kór (Sarnthein és Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al., 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) és a frontotemporális demencia (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
Az évek során az EEG hardvertechnológiája is fejlődött, és számos vezeték nélküli többcsatornás rendszer jelent meg, amelyek a hagyományos, nehézkes rendszereknél egyszerűbb, kényelmesebb és kényelmesebb kivitelben szolgáltatnak jó minőségű EEG- és fiziológiai jeleket. A hagyományos EEG-rendszerek hosszadalmas összeszerelési és alkalmazási időt igényelnek, ami általában a beteg fejbőrének lehorzsolásával jár. A felhelyezési idő és a kényelmetlenség miatt ezek a hagyományos rendszerek kihívást jelentenek a demenciában szenvedő népességcsoportok számára, ahol a hosszadalmas klinikai eljárásokkal való együttműködés gyakran nehézségekbe ütközik. Számos jelenleg rendelkezésre álló vezeték nélküli rendszer azonban 20 perc vagy annál rövidebb idő alatt alkalmazható, a felhelyezés során nem okoz kellemetlenséget, és a felvételek során is kényelmesen illeszkedik. A jeldetektálás és a kvantitatív elemzési technikák fejlődésével kombinálva a vezeték nélküli rendszerek ideális jelöltek a potenciálisan kihívást jelentő demens populációk, például a viselkedési variáns frontotemporális demencia viszonylag gyors, tolerálható klinikai értékelésére, amelyet markáns viselkedés- és személyiségváltozások jellemeznek.
A közelmúltban a fogyasztói viselhető technológiák piaca is növekedett, ami a személyes használatra, például meditációra és relaxációs tréningre alkalmas, korlátozott csatornájú rendszerekhez vezetett. Elképzelhető, hogy ezek a rendszerek, bár korlátozott lefedettségük ellenére, kiválasztott klinikai vizsgálatokban is felhasználhatók. Ezeknek a fogyasztói rendszereknek a klinikai vizsgálatokban való alkalmazását azonban még nem vizsgálták széles körben, és az ismételt mérések pontosságát és megbízhatóságát nem sikerült megalapozottan megállapítani. Továbbá nem világos, hogy a korlátozott csatornás adatgyűjtés elegendő adatot és anatómiai lefedettséget biztosít-e a neurodegeneratív betegségekben szenvedő betegek idegi jellemzőinek értékeléséhez.
A jelenlegi vizsgálat célja a fogyasztói EEG-rendszerek klinikai vizsgálatokban rejlő lehetőségeinek kezdeti értékelése volt két orvosi minőségű, többcsatornás vezeték nélküli EEG-rendszer, a B-Alert X24 és az Enobio 20, valamint két fogyasztói, korlátozott csatornás rendszer, a Muse és a Mindwave könnyű használhatóságának, pontosságának és megbízhatóságának összehasonlításával.
Anyagok és módszerek
A résztvevők
A vizsgálati populáció öt egészséges résztvevőből állt, akik megfeleltek a vizsgálatra való jogosultságnak (1. táblázat). Az alanyokat kizárták, ha kórtörténetük, kísérő gyógyszereik és életmódjuk (alkohol- és koffeinfogyasztásuk, valamint dohányzási státuszuk) áttekintése után nem minősültek egészségesnek. Konkrétan kizárták a vizsgálatból, ha a kórtörténetükben epilepszia vagy más alvási, neurológiai vagy pszichiátriai rendellenesség szerepelt, vagy olyan gyógyszereket szedtek, illetve olyan életmódot folytattak, amelyről ismert, hogy befolyásolja az EEG-jeleket, például dohányzás és jelentős alkohol- és koffeinfogyasztás.

1. táblázat. A vizsgálati populáció demográfiai adatai és kiindulási jellemzői.
A vizsgálatban résztvevők mindegyikétől írásbeli beleegyező nyilatkozatot szereztünk be a Chesapeake intézményi felülvizsgálati bizottsága által az emberi alanyokkal végzett kísérleti vizsgálatokra előírt irányelvek szerint.
Kutatási eljárások, EEG-adatgyűjtés és elemzés
A táplálékbevitelhez és a cirkadián variációkhoz kapcsolódó lehetséges EEG-jelváltozások elkerülése érdekében minden látogatás reggel történt egy standard alacsony szénhidrát- és magas fehérjetartalmú reggelit követően (az étkezés utáni álmosság minimalizálása érdekében) az Advanced Brain Monitoring (ABM) kutatólaboratórium vizsgálati helyszínén. Ezenkívül a résztvevőket arra kérték, hogy a vizsgálatot megelőző este kerüljék az alkoholtartalmú italokat, valamint a vizsgálat reggelén koplaljanak és kerüljék a koffeint.
Az EEG-adatokat két külön látogatás során, ~1 hét különbséggel két többcsatornás (20 csatorna) orvosi EEG-rendszerrel, a B-Alert (Advanced Brain Monitoring, ABM) és az Enobio (Neuroelectrics) (1. ábra, 2. táblázat), valamint két korlátozott csatornás fogyasztói rendszerrel, a Muse (Interaxon, 2 csatorna) és a Mindwave (Neurosky, 1 csatorna) (1. ábra, 2. táblázat) gyűjtötték a következő sorrendben: Muse, Mindwave, B-Alert, Enobio. A B-Alert X24 EEG-rendszer és az Enobio mindkettő CE orvosi tanúsítvánnyal rendelkező 20 csatornás vezeték nélküli rendszer, amelyet a szabványos nemzetközi 10-20-as montázsban alkalmaznak, és 256 Hz-es mintavételi frekvenciával veszik fel az EEG-jelet. Ezenkívül a B-Alert-et az FDA engedélyezte az orvostechnikai eszközként való használatra.
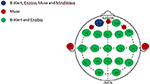
1. ábra. A több- és korlátozott csatornás EEG-rendszerek anatómiai csatornaeloszlása. A közös és egyedi csatornák ábrázolása a négy vizsgált EEG-rendszer között. Mind a négy EEG-rendszer közös csatornája, az Fp1 (kék); a Muse rendszer egyedi csatornái (piros); a többcsatornás rendszerek, a B-Alert és az Enobio közös csatornái (zöld).

2. táblázat. EEG-rendszerek összehasonlítása.
A B-Alert a masztoidokat használja referenciacsatornaként. Az Enobio használható masztoid-referenciával, fülcsipesszel vagy más fejbőrhelyeket használva. A Mindwave szintén rendelkezik referenciával a fülcsúcson, a Muse pedig három referenciacsatornával a homlokon. Mindegyik rendszer tartalmazott jelminőség-ellenőrzést, azonban az orvosi EEG-rendszerekkel ellentétben mindkét fogyasztói rendszer száraz elektródákkal rendelkezik, és nincs impedancia-ellenőrzés.
Ezeket a technológiákat az alapján választották ki, hogy képesek a végfelhasználók számára nyers EEG-kimeneteket biztosítani praktikus és nem költséges hozzáférésen keresztül.
Tíz perc nyugalmi állapotú EEG-t rögzítettek nyitott szemmel (EO), a számítógép képernyőjén megjelenített kereszt szimbólum vizuális fixálásával (5 perc), valamint csukott szemmel (EC) 5 percig.
Mivel mind a négy rendszer csak az FP1 csatornán osztozik (1. ábra), az EEG-mintákat (nyers és tisztított), a teljesítményspektrális sűrűségeket (PSD) és a teszt/retest megbízhatósági összehasonlításokat a vizsgálatban értékelt négy EEG-rendszer között az Fp1 elektródára összpontosítva végeztük el mind EO, mind EC körülmények között.
Az egyes rendszerekből származó EEG-adatokat a MATLAB (Mathworks) programba töltöttük be, egyedi függvények segítségével. A szünetek és utasítások alatt rögzített EEG-adatokat az elemzés előtt elvetettük. Az EEG teljesítményspektrális sűrűségét minden egyes 1 s epochára vonatkozóan Welch módosított periodogram módszerével számoltuk ki, 1 s hosszúságú Hamming-ablak kúposításával. A PSD-ket a nyugalmi EEG-n számoltuk ki a nyitott és a csukott szemű időszakok alatt. Az egyenlő egységek (μV) lehetővé tétele érdekében 1,25 (Muse), 0,25 (MindWave) vagy 1000 (Enobio 20) korrekciós tényezőt alkalmaztunk. Az összes Fp1 csatorna PSD-adatait átlagoltuk az öt alanyra vonatkozóan minden egyes látogatásnál. A teszt-retesztelést a Vist1/Visit2 kiszámításával és ábrázolásával végeztük.
Eredmények
Tagadók
A résztvevők mind egészséges önkéntesek voltak, átlagéletkoruk 27 év, mindannyian jobbkezesek és nemdohányzók voltak, és túlnyomórészt férfiak (60%). Demográfiai és alapjellemzőiket az 1. táblázat foglalja össze.
Resting State EEG
Az EEG-adatokat mind a négy vizsgált rendszerből sikeresen gyűjtötték. A várakozásoknak megfelelően a száraz elektródák és a csatornák korlátozott száma miatt a fogyasztói EEG-rendszerek beállítási ideje lényegesen rövidebb volt. Ugyanakkor nem volt megfigyelhető különbség az alanyok toleranciájában és elfogadottságában a négy rendszer között.
A nyers EEG-adatok mintáit EO (2. ábra) és EC (3. ábra) körülmények között gyűjtötték és értékelték az egyes rendszerekből. A Muse és a Mindwave hajlamosabb volt a szem pislogása és a frontális régióban a szemnyitással járó izommozgás miatti artefaktumokra (2. ábra).
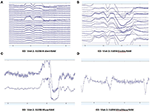
2. ábra. A B-Alert (A) és az Enobio (B) Muse (C) és MindWave (D) EO nyers adatainak kivonata ugyanazon résztvevőn belül ugyanazon látogatás során.
3. ábra. A B-Alert (A) és az Enobio (B) Muse (C) és MindWave (D) EC nyers adatainak kivonata ugyanazon résztvevőn belül ugyanazon látogatás során.
Fp1 csatorna teljesítményspektrális sűrűségének (PSD) összehasonlítása
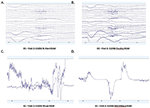
Az Fp1 csatorna átlagos PSD-jét, amely mind a négy EEG-rendszerben közös az 1. és a 2. látogatásra, kiszámítottuk és ábrázoltuk mind az EO (4A,B ábra), mind az EC (4C,D ábra) körülményekre. Az EO állapotban a B-alert és az Enobio spektrumok megközelítőleg azonosak voltak, míg a Mindwave kissé megnövekedett, de hasonló görbét követett. Szélessávú teljesítménynövekedés volt megfigyelhető a Muse rendszerrel felvett PSD-k esetében. Hasonlóképpen, az EC állapotban (4C., D. ábra) a B-Alert, az Enobio és a Mindwave PSD-k hasonlóak voltak, azonban a Muse spektrumoknál megnövekedett szélessávú teljesítményt figyeltek meg, amelyek szintén nagyobb variációval rendelkeztek, mint a többi rendszer esetében. A B-Alert, az Enobio és a Mindwave rendszerekkel felvett spektrumokban minden egyes látogatáskor 8-12 Hz-es csúcsok (alfa-sáv) voltak láthatóak. Míg a Muse teljesítményspektrumában a 2. látogatáson egyértelmű alfa-csúcs volt, az 1. látogatás spektrumában nem volt csúcs megfigyelhető.
4. ábra. Fp1 teljesítményspektrális sűrűségek (PSD-k) mind a négy EEG-rendszerből az EO-állapotban az 1. látogatáskor (A) és a 2. látogatáskor (B), valamint az EC-állapotban az 1. látogatáskor (C) és a 2. látogatáskor (D).
Fp1 csatorna nyugalmi EEG teszt/vizsgálat összehasonlítása
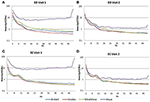
Az EC-állapotban a teljesítményspektrális arány 0,975 és 1,025 között volt a B-Alert, Enobio és Mindwave esetében (5A ábra). A Muse rendszer PSD-arányai nagyobb szórást mutattak, mint a másik három rendszeré, 1,125 és 1,225 közötti arányokkal. Az EO-állapotban az Enobio esetében a lassú delta (1-3 Hz), théta (3-7 Hz) és lassú alfa (8-10) hullámokban, a B-Alert és a Mindwave esetében pedig a gyorsabb béta (13-30 Hz) és gamma (25-40 Hz) hullámokban mutatkozott némileg nagyobb eltérés. Az arányok azonban még mindig 0,975 és 1,05 között voltak. Az EC-állapothoz hasonlóan a Muse teszt/reteszt esetében is nagyobb volt a szórás, az arányok elérhették az 1,2-t (5B ábra).
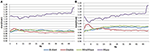
5. ábra. Teszt-reteszt arányok EC (A) és EO (B) állapotban.
Diszkusszió
Ez a tanulmány összehasonlította az orvosi és fogyasztói EEG-rendszerek kvantitatív EEG-jelét és teszt-reteszt megbízhatóságát annak érdekében, hogy értékelje azok lehetséges alkalmazását a klinikai kutatásban és a klinikai vizsgálatokban. Az újonnan népszerűsített fogyasztói EEG-rendszereket alacsony költségük, széleskörű hozzáférhetőségük és a kihívást jelentő populációkon végzett otthoni vizsgálatokban rejlő lehetőségük miatt értékelték. A fogyasztói EEG-rendszerek népszerű alkalmazásai közé tartozik a meditáció és a relaxációs tréning, valamint a szorongással vagy fájdalommal való megbirkózás. A legújabb vizsgálatok a játékokon túlmutató hasznosságukat is vizsgálják: A NeuroSky képesnek bizonyult az 1. fázisú alvás kezdetének észlelésére (Van Hal et al., 2014), és érdeklődés mutatkozott a fogyasztói EEG agyi számítógépes interfészeken belüli értékelése iránt is (Bialas and Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). Egyszerűbb (például 6 csatornás) EEG-rendszerek alkalmazását is vizsgálják sürgősségi környezetben (Jakab et al., 2014). Egy korábbi értékelés, bár összetettebb fejhallgatót használt, azt mutatta, hogy a kereskedelemben kapható több vezetékes fogyasztói EEG-rendszerek, mint például az Emotiv EPOC 16 elektródás sapka, szintén értékesek lehetnek a klinikai állapotok értékelésében (Schiff et al., 2016).
Ez a tanulmány bizonyítékot szolgáltatott arra, hogy meglehetősen jó minőségű EEG-adatok sikeresen gyűjthetők fogyasztói EEG-kkel. Különbségek voltak azonban a 8-13 Hz-en megfigyelt alfa-csúcs teljesítménynövekedésében, a tesztek újratesztelésében és alakjában. A Mindwave összességében hasonló Fp1 teljesítményspektrumot mutatott, mint az orvosi rendszerek, enyhe szélessávú növekedéssel a B-Alert és az Enobio felett. A Muse széles sávú növekedést mutatott a teljesítményspektrumokban, ami a száraz elektródával szerzett adatokban lévő artefaktumot tükrözheti.
A fogyasztói EEG-rendszerek lényegesen kényelmesebb és gyorsabb beállítást mutattak, ami optimális a szórakoztató és önsegítő alkalmazásokban való rendeltetésszerű használatukhoz. Az adatminőségüket azonban összességében negatívan befolyásolta a száraz elektródával kapcsolatos műtárgyérzékenység. A várakozásoknak megfelelően az adatminőség különösen az EO során romlott. Az impedancia-vizsgálati képesség hiánya és a frontális régióra történő alkalmazás, amely különösen hajlamos a szem pislogására és a szemnyitással járó izommozgásra, valószínűleg szintén hozzájárult ehhez a relatív artefaktumhoz. Ezenkívül a fogyasztói EEG-rendszerek által végzett értékelés természetüknél fogva korlátozott és a néhány csatorna által lefedett egyetlen anatómiai agyi régióra korlátozódik, ami kizárja a több hálózatra kiterjedő értékelést.
A száraz elektródák hajlamosabbak lehetnek arra is, hogy idővel kényelmetlenséget okozzanak, és nagyobb a kockázata annak, hogy rosszul helyezik el őket a homlokon, ami pontatlan jelgyűjtéshez és teszteléshez/újrateszteléshez vezet. Az orvosi minőségű berendezésekhez képest a teszt/visszateszt megbízhatósága alacsonyabb volt a fogyasztói EEG-rendszereknél. A megbízhatóságot az összes rendszer esetében teszt-reteszt adatgyűjtéssel mértük (5. ábra). Míg a B-Alert, az Enobio és a Mindwave viszonylag jól teljesített, a Muse megbízhatósága viszonylag alacsony volt. Továbbá, míg a Muse esetében egyértelmű alfa-csúcsot mutattak ki a 2. vizsgálaton (4. ábra), az alfa-csúcs hiánya az 1. vizsgálaton a konzisztencia hiányára utal, ami műtermékből adódhat. Az agyi aktivitás konzisztens, megbízható mérései kulcsfontosságúak a klinikai vizsgálatokban a betegség progressziójának nyomon követése és a kísérleti terápiás szerek hatékonyságának értékelése során. Bár a fogyasztói rendszerek hasznosak lehetnek a gyors értékeléshez, amikor az idő korlátozott, a fogyasztói EEG ezen korlátai akadályozhatják a kutatási és klinikai vizsgálatokban való alkalmazásukat, és a klinikai vizsgálatokban farmakodinamikai végpontként való alkalmazáshoz magas teszt-reteszt megbízhatósággal rendelkező orvosi minőségű rendszer ajánlott.
Az orvosi és fogyasztói EEG-rendszerek kísérleti körülmények közötti összehasonlítása végül rávilágított a teljesítménybeli különbségekre és különösen a használat specifikus korlátaira, amelyek akadályozhatják a fogyasztói rendszerek alkalmazását a kutatási és klinikai vizsgálatokban. Másrészt az orvosi többvezetékes rendszerek kevésbé ideálisak szórakoztató célokra, amelyek gyors beállítást és adatfeldolgozást igényelnek minimális számú elektródáról. E tanulmány fő korlátja a vizsgálati populáció kis méretében és az adatgyűjtéshez használt rendszerek sorrendjének randomizálásának hiányában rejlik. Az adatokat a rendszerek azonos sorrendjében szereztük be annak érdekében, hogy elkerüljük az adatgyűjtés időpontjának hatásait, amelyek a cirkadián ritmusok miatt hatással lehetnek az EEG-re. Az EEG teljesítménymérések azonban nagyon megbízhatónak és megismételhetőnek bizonyultak az egyének számára, ha standard EEG-rendszereket használnak. Emiatt a kiválasztott mintanagyságot informatívnak tekintettük.
Összefoglalva, az EEG-adatok sikeresen gyűjthetők mind a négy vizsgált rendszerrel, beleértve a fogyasztói EEG-rendszereket is, a használhatóság, az adatminőség és a megbízhatóság különböző korlátaival, amelyek az optimális alkalmazásukat irányítják, beleértve a klinikai vizsgálati beállításokat is. A jelenlegi fogyasztói EEG-rendszerekkel kapcsolatos műtárgyakra való érzékenység és a teszt/reteszt megbízhatóságának változékonysága orvosi minőségű EEG-rendszerek használatát javasolja a megbízható klinikai keresztmetszeti és longitudinális EEG-adatgyűjtéshez.
Author Contributions
ER és AV: részt vett a projekt koncepciójában és tervezésében, az adatok elemzésében és értelmezésében, valamint a kézirat elkészítésében. SW, CB és GR: részt vettek a projekt koncepciójában és tervezésében, végrehajtásában, az adatok elemzésében és értelmezésében, valamint a kézirat elkészítésében. Minden szerző részt vett a kézirat megfogalmazásában, megírásában és átdolgozásában, és mindannyian elolvasták és jóváhagyták a kézirat végleges változatát.
Finanszírozás
Ezt a vizsgálatot a Biogen támogatta.
Interdekütközési nyilatkozat
ER és AV: Biogen alkalmazott. SW és CB: Advanced Brain Monitoring, Inc alkalmazottja. GR: Neuroelectrics alkalmazott.
Megköszönések
Megköszönjük a vizsgálatban résztvevőknek az idejüket és a tanulmányhoz való hozzájárulásukat. A Biogen csapata részt vett a vizsgálat tervezésében, az adatok elemzésében és értelmezésében, a jelentés megírásában, valamint a cikk publikálásra való benyújtásáról szóló döntésben.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). A nyugalmi állapotú elektroenkefalográfiás ritmusok kérgi forrásai a Parkinson-kórral összefüggő demenciában és az Alzheimer-kórban. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). “Development of EEG biomarkers for Alzheimer’s disease,” in GTC Biomarkers Summit (San Diego, CA).
Bialas, P., and Milanowski, P. (2014). Egy nagyfrekvenciás, állandósult állapotú, vizuálisan kiváltott potenciálon alapuló agyi számítógépes interfész fogyasztói EEG-fejhallgatóval. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). Kvantitatív EEG és LORETA: értékes eszközök az FTD és az AD megkülönböztetésében? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., and ChiehLee, T. (2015). Az elektroenkefalográfia frekvenciateljesítménye és koherenciája korrelál az Alzheimer-kór súlyosságával: multicentrikus elemzés Tajvanon. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). A kvantitatív EEG-markerek összefüggése az Alzheimer-kór súlyosságával a prospektív demenciaregiszter Ausztriában (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). Az EEG domináns frekvenciacsúcs megkülönbözteti az Alzheimer-kórt és a frontotemporális lebeny degenerációt. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Újszerű vezeték nélküli elektroenkefalográfiás rendszer minimális előkészítési idővel a sürgősségi és kórház előtti ellátásban való használatra. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., and Jo, S. (2015). Egy alacsony költségű, nem invazív hibrid interfész mennyiségi értékelése EEG és szemmozgás alapján. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). “Deep networks using auto-encoders for PD prodromal analysis,” in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Az EEG használata az ADHD diagnosztizálásához. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011). Az anatómiai szubsztrátum és a fejbőr EEG-markerek korrelálnak a kognitív károsodásban és az Alzheimer-kórban szenvedő személyeknél. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). A frontotemporális demencia és az Alzheimer-kór között a LORET által feltárt különbségek a kvantitatív EEG-ben. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). A nyugalmi állapotú EEG funkcionális konnektivitásának vizsgálata frontotemporális lebeny degenerációban. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., and Soria-Frisch, A. (2016). “EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients,” in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). Magas thalamocorticalis theta koherencia Parkinson-kóros betegeknél. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Alacsony költségű, felhasználóbarát elektroenkefalográfiás rögzítő rendszer a hepatikus enkefalopátia értékelésére. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., and Johnson, R. (2015). “A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Egy EEG biomarker integrálása a klinikus ADHD értékelésébe. Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). “Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017). Ott tartunk már? Kereskedelmi minőségű agy-számítógép interfész értékelése számítógépes alkalmazások vezérléséhez agyi bénulással élő személyek által. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., and Bossemeyer, R. (2014). Alacsony költségű EEG-alapú alvásérzékelés. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., and Verma, A. (2016). “Identification of neurophysiological biomarkers of MCI using resting state, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar