Az intracelluláris jelzések, például a sejt DNS-ének károsodása, elsősorban az intrinzikus útvonalon keresztül irányítják az apoptózist. Az intrinzikus apoptózis-útvonal, amely konzervált jelzőfehérjéket foglal magában, fizikailag kapcsolódik a mitokondriumokhoz, és gerincesekben érzékeny a mitokondriális oxidatív stresszre. Az útvonalat a mitokondriális membránhoz kötött Bcl család tagjai befolyásolják, köztük a Bax és a Bcl-2 gén, amelyek pro-, illetve anti-apoptotikus szabályozó fehérjékként működnek.
Az intrinzikus apoptózis útvonal áttekintése
Az intrinzikus apoptózis útvonalat például kemoterápia és/vagy sugárkezelés indítja el. Számos exogén és endogén inger, például DNS-károsodás, iszkémia és oxidatív stressz hatására aktiválódik. Ezenkívül fontos szerepet játszik a fejlődésben és a károsodott sejtek eliminációjában.
Az intrinzikus útvonalban a pro-apoptotikus jelátvitel funkcionális következménye a mitokondriális membrán perturbációja és a citokróm c felszabadulása a citoplazmába, ahol komplexet vagy apoptoszómát képez az apoptotikus proteáz aktiváló faktor 1 (APAF1) és a kaszpáz-9 inaktív formájával. Ez a komplex hidrolizálja az adenozin-trifoszfátot a kaszpáz-9 hasítása és aktiválása érdekében. Az iniciátor kaszpáz-9 ezután hasítja és aktiválja a végrehajtó kaszpáz-3/6/7-et, ami a sejt apoptózisához vezet. Ez teljesen különbözik az extracelluláris jelektől, amelyeket általában az immunrendszer citotoxikus sejtjei generálnak, és az apoptózist elsősorban az extrinsic útvonalon keresztül váltják ki.
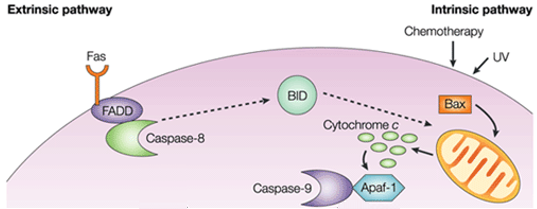
1. ábra. Az extrinsic és az intrinsic útvonal közötti különbség.
Az intrinsic apoptózis útvonal folyamata és szabályozása
Az intrinsic apoptózis útvonal az apoptózist a kaszpáz-3 közvetlen aktiválásával vagy a bid (BH3 interakciós domén halál agonista) hasításával indukálja, ami mitokondriális diszfunkciót, majd citokróm c felszabadulását és a kaszpáz-9 és kaszpáz-3 aktiválását eredményezi. A kaszpáz-3 elősegíti a tipikus apoptózis jellemzőit, beleértve a DNS-fragmentációt és a sejthalált számos szövetben.
A B-sejtes limfóma 2 (Bcl-2) fehérjecsalád szorosan szabályozza az intrinzikus útvonal aktiválódását. A follikuláris limfómában található, és először azonosították, mint a sejthalálban részt vevő egyik gént, amely vagy a pro-apoptotikus, vagy az anti-apoptotikus apoptózist aktiválja. Az egyik alcsoportba tartozó fehérjék, köztük a Bid, Bad, Bim, Bmf, Puma és Noxa egyetlen Bcl-2 homológia 3 domént tartalmaznak (csak BH3 fehérjék) és pro-apoptotikus aktivitással rendelkeznek. Két másik fehérjealcsoport több BH-doménnel rendelkezik. Az első alcsoport, beleértve a Bcl-2 asszociált X fehérjét (Bax), a Bcl-2 homológ antagonista/gyilkos (Bak) és a Bcl-2 család apoptózis szabályozóját (Bok), pro-apoptotikus; a másik alcsoport, beleértve a Bcl-2-t, Bcl-XL-t és Mcl-1-et, anti-apoptotikus. A mitokondriális útvonalat részben a mitokondriális membránhoz kötött Bcl család tagjai befolyásolják, beleértve mind a Bax pro-apoptotikus szabályozó fehérjéket, mind a Bcl-2 antiapoptotikus szabályozó fehérjéket.
A pro-apoptotikus molekulák a külső mitokondriális membrán permeabilizációját okozzák, ami a citokróm c kiáramlásához vezet, amely a citoszolban az adaptor Apaf-1-hez és a kezdeményező kaszpáz-9-hez kötődve az apoptoszóma komplexet alkotja. Ez stimulálja a kaszpáz-9-et, amely viszont aktiválja az effektor kaszpázokat. A mitokondrium egy Smac/DIABLO nevű fehérjét is felszabadít a citoszolba. A Smac/DIABLO közvetve elősegíti az apoptózist azáltal, hogy blokkolja az anti-apoptotikus fehérjék egy csoportjának, az úgynevezett apoptózis-inhibitor fehérjéknek (IAP) a hatását.
A Bcl-2 és Bcl-XL anti-apoptotikus fehérjék gátolják a citokróm c felszabadulását, míg a Bax, Bak és Bid, mind pro-apoptotikus fehérjék, elősegítik annak felszabadulását a mitokondriumból. A citokróm c és a dezoxiadenozin-trifoszfát (dATP) az APAF-1-hez kötődve multimer komplexet alkot, amely toborozza és aktiválja a pro-kaszpáz-9-et, egy apoptózist közvetítő végrehajtó proteázt, amely viszont aktiválja a kaszpáz kaszkádot, ami a sejt apoptózisához vezet. E folyamat során a kaszpáz-2, a kaszpáz-8, a kaszpáz-9 és a kaszpáz-10 vesz részt az apoptózis elindításában. A kaszpáz-3, a kaszpáz-6 és a kaszpáz-7 részt vesz az apoptózisban. A kaszpáz-3 és a kaszpáz-7 szabályozza a DNS-javítás gátlását és elindítja a DNS-lebontást. Ezenkívül a kaszpáz-6 szabályozza a lamina és a citoszkeleton szétesését.
Intrinsic Apoptosis Pathway in Pathophysiology
A legtöbb kemoterápiás és célzott rákterápia a pro-halál jelátvitel generálásával öli meg a tumorsejteket, amely a programozott sejthalál intrinsic apoptotikus útját indítja el. Az apoptotikus kaszkádban a vissza nem térő pont a mitokondriális külső membrán permeabilizációja (MOMP); ha ez megtörtént, a mitokondriális permeabilizáció apoptoszóma kialakulásához vezet, amely elősegíti a kaszpáz aktivációt, és ezt követően kiváltja az apoptotikus sejthalál egyéb jellemzőit. A MOMP beindítására vonatkozó sejtszintű döntést a BCL-2 család pro- és anti-apoptotikus molekulái közötti kényes egyensúly szabályozza.
A kemoterápiás rezisztencia egyik oka, hogy a tumorsejtek az intrinzikus apoptotikus útvonal hibái (pl. a p53 változásai) miatt nem lépnek apoptózisba. A kezelés jelentős javulása ellenére számos rákos megbetegedés gyógyulási aránya továbbra is szuboptimális. A citotoxikus kemoterápia elterjedése a rákok egy részhalmazának gyógyító terápiáját eredményezte, bár az intrinzikus kezelési rezisztencia nehezen megjósolható az egyes betegek esetében. A molekulárisan célzott terápiák hulláma a gyógyszerkapacitást aktiváló mutációkra összpontosított, és így a betegek meghatározott alcsoportjaira korlátozódik. Az apoptózis intrinzikus mitokondriális útvonala az új terápiák egyik ígéretes célpontja, és ennek az útvonalnak a sikeres megcélzása megváltoztathatja a különböző rákbetegségek terápiájának terápiáját
.