Tanulási célok
- Relegálja az elemek elektronkonfigurációit a periódusos rendszer alakjához.
- Meghatározni egy elem várható elektronkonfigurációját a periódusos rendszerben elfoglalt helye alapján.
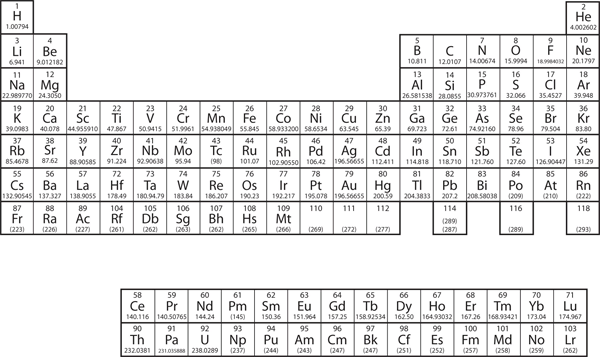
Az “Atomok, molekulák és ionok” című 3. fejezetben bemutattuk a periódusos rendszert, mint az ismert kémiai elemek rendszerezésének eszközét. A periódusos rendszert a 8.11. ábra “A periódusos rendszer” mutatja be. Az elemek atomi szám (a protonok száma az atommagban) szerint vannak felsorolva, és a hasonló kémiai tulajdonságokkal rendelkező elemek oszlopokba vannak csoportosítva.
8.11. ábra A periódusos rendszer
Miért olyan a periódusos rendszer felépítése, amilyen? A válasz meglehetősen egyszerű, ha értjük az elektronkonfigurációkat: a periódusos rendszer alakja az alhéjak elektronokkal való kitöltését utánozza.
Kezdjük a H-val és a He-vel. Elektronkonfigurációjuk 1s1, illetve 1s2; a He esetében az n = 1 héj van betöltve. Ez a két elem alkotja a periódusos rendszer első sorát (lásd a 8.12. ábra “Az 1”).
8.12. ábra Az 1s alhéj
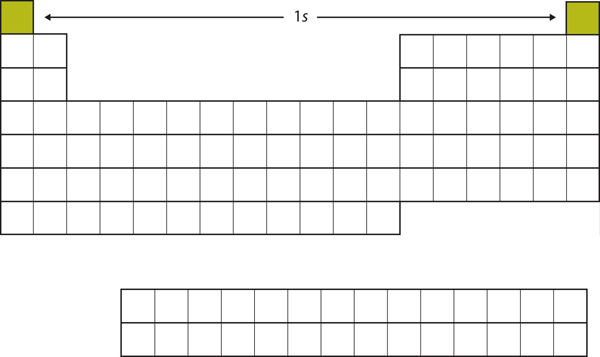
H és He az 1s alhéj betöltését jelenti.
A következő két elektron a Li és Be esetében a 2s alhéjba kerülne. A 8.13. ábra “A 2” mutatja, hogy ez a két elem szomszédos a periódusos rendszerben.
8.13. ábra A 2s alhéj
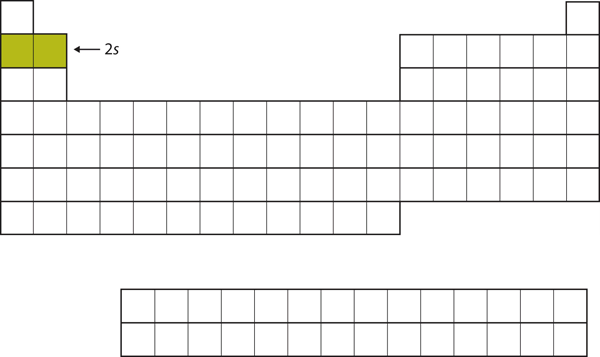
A Li és Be esetében a 2s alhéj töltődik be.
A következő hat elem esetében a 2p alhéjba kerülnek elektronok. A periódusos rendszer jobb oldalán ez a hat elem (B-től Ne-ig) van csoportosítva (8.14. ábra “A 2”).
8.14. ábra A 2p alhéj
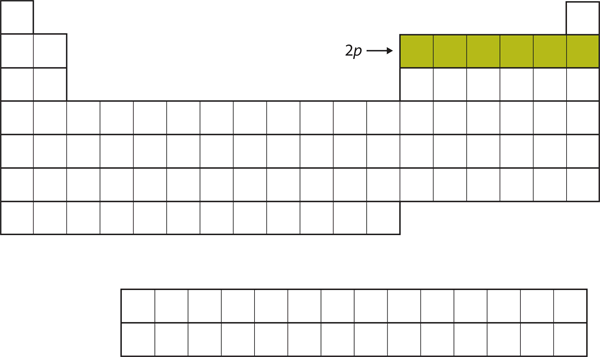
B-től Ne-ig a 2p alhéjat töltik be elektronokkal.
A következő betöltött alhéj a 3s alhéj. Azok az elemek, amikor ez az alhéj van betöltve, a Na és az Mg, ismét a periódusos rendszer bal oldalán vannak (8.15. ábra “A 3”).
8. ábra.15 A 3s alhéj
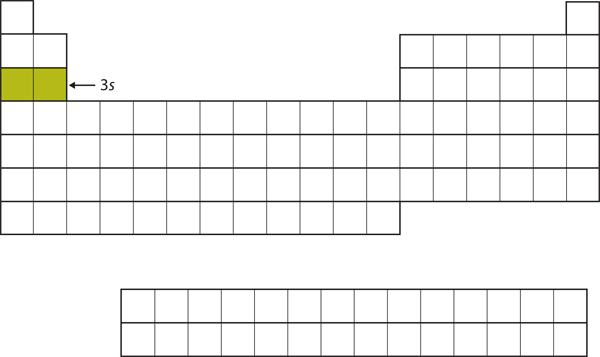
Most a 3s alhéj van betöltve.
A következő hat elemmel a 3p alhéj van betöltve (8.16. ábra “A 3”).
8.16. ábra A 3p alhéj
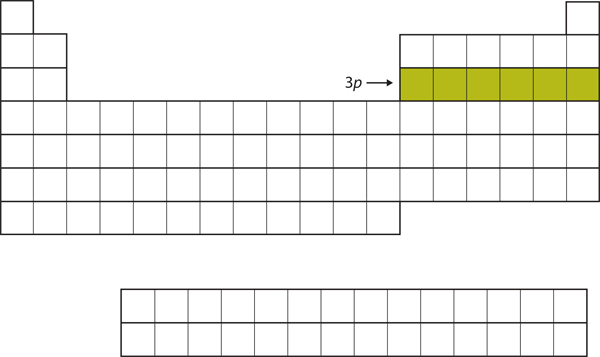
A következő lépésben a 3p alhéjat töltik fel elektronokkal.
A következő lépésben a 3d alhéj helyett az elektronok a 4s alhéjba kerülnek (8. ábra.17 “A 4-es”).
8.17. ábra A 4s alhéj
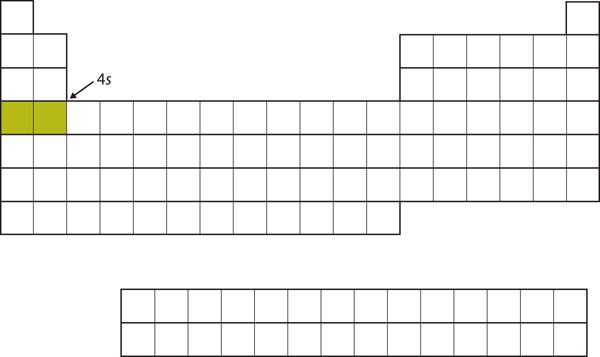
A 4s alhéjat a 3d alhéj előtt töltik meg. Ez tükröződik a periódusos rendszer szerkezetében.
A 4s alhéj kitöltése után a 3d alhéj legfeljebb 10 elektronnal töltődik fel. Ez magyarázza a periódusos rendszer középső, 10 elemet tartalmazó szakaszát (8.18. ábra “A 3”).
8.18. ábra A 3d alhéj
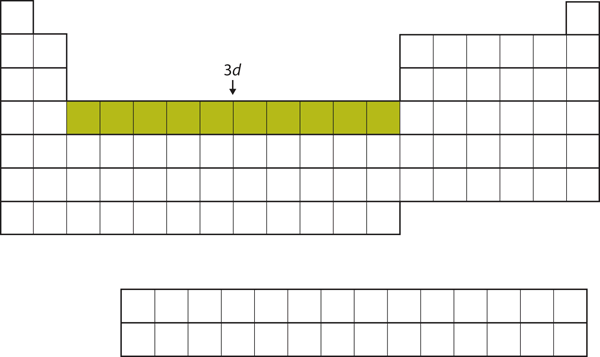
A periódusos rendszer középső szakaszában a 3d alhéj van kitöltve.
És így tovább. Ahogy haladunk végig a periódusos rendszer sorain, a táblázat általános alakja körvonalazza, hogy az elektronok hogyan foglalják el a héjakat és alhéjakat.
A periódusos rendszer bal oldalán lévő első két oszlopban az s alhéjakat foglalják el. Emiatt a periódusos rendszer első két sorát s-blokknak nevezzük. Hasonlóképpen a p blokk a periódusos rendszer jobb szélső hat oszlopa, a d blokk a periódusos rendszer középső 10 oszlopa, míg az f blokk az a 14 oszlopos szakasz, amelyet általában a periódusos rendszer fő részétől leválasztva ábrázolnak. Lehetne a főtörzs része is, de akkor a periódusos rendszer meglehetősen hosszú és nehézkes lenne. A 8.19. ábra “Blokkok a periódusos rendszerben” mutatja a periódusos rendszer blokkjait.
8.19. ábra Blokkok a periódusos rendszerben
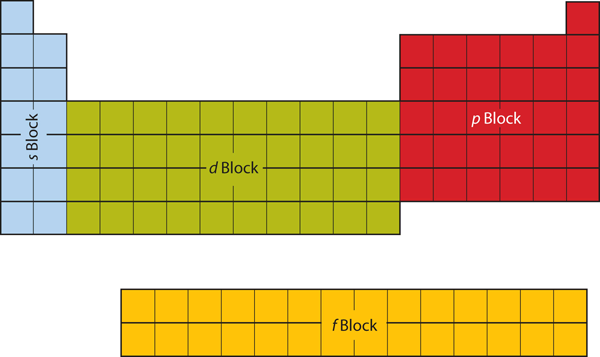
A periódusos rendszer blokkokra van osztva attól függően, hogy az adott szakaszba tartozó atomok melyik alhéjat töltik ki.
A legmagasabb számozású héjban lévő elektronokat, valamint az utolsó kitöltetlen alhéjban lévő esetleges elektronokat valenciaelektronoknak nevezzük; a legmagasabb számozású héjat nevezzük valenciahéjnak. (A belső elektronokat magelektronoknak nevezzük.) A valenciaelektronok nagymértékben irányítják az atom kémiai működését. Ha csak a valenciahéj elektronkonfigurációját nézzük, azt találjuk, hogy minden oszlopban a valenciahéj elektronkonfigurációja azonos. Vegyük például a periódusos rendszer első oszlopában található elemeket: H, Li, Na, K, Rb és Cs. Elektronkonfigurációjuk (a nagyobb atomok esetében rövidítve) a következő, a valenciahéj elektronkonfigurációját kiemelve:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Valenciahéjukban mindegyiküknek hasonló az elektronkonfigurációja: egyetlen s elektron. Mivel egy elem kémiájának nagy részét a valenciaelektronok befolyásolják, azt várnánk, hogy ezeknek az elemeknek hasonló a kémiája – és így is van. Az elektronok elrendeződése az atomokban nemcsak a periódusos rendszer alakját magyarázza, hanem azt is, hogy a periódusos rendszer azonos oszlopában lévő elemek kémiai tulajdonságai hasonlóak.
A periódusos rendszer többi oszlopára ugyanez a koncepció vonatkozik. Az egyes oszlopokban lévő elemeknek ugyanaz a valenciahéj elektronkonfigurációja, és az elemek bizonyos kémiai tulajdonságai is hasonlóak. Ez szigorúan igaz az s és p blokkok összes elemére. A d és f blokkokban, mivel az alhéjak elektronokkal való feltöltésének sorrendje alól vannak kivételek, a hasonló valenciahéjak nem abszolút érvényesek ezekben a blokkokban. Azonban sok hasonlóság van ezekben a blokkokban, így a kémiai tulajdonságok hasonlósága várható.
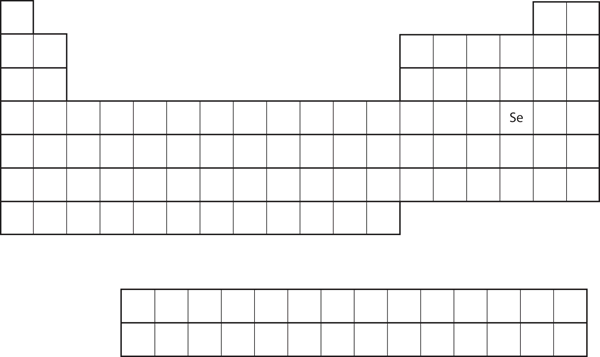
A valenciahéj elektronkonfigurációjának hasonlósága azt jelenti, hogy egy atom elektronkonfigurációját kizárólag a periódusos rendszerben elfoglalt helye alapján tudjuk meghatározni. Tekintsük a 8.20. ábra “Szelén a periódusos rendszerben” című ábráján látható Se-t. A p blokk negyedik oszlopában található. Ez azt jelenti, hogy elektronkonfigurációjának p4 elektronkonfigurációval kell végződnie. Valóban, a Se elektronkonfigurációja a várakozásoknak megfelelően 4s23d104p4.
8.20. ábra Szelén a periódusos rendszerben
8. példa
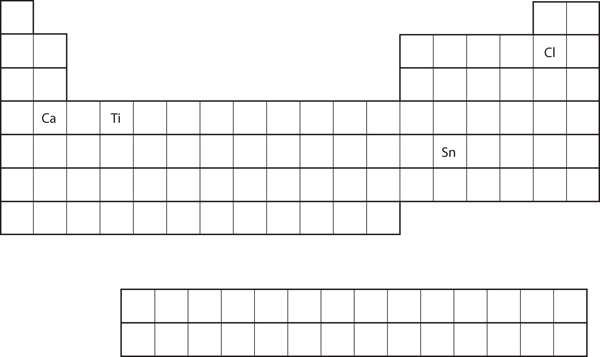
Az elemnek a periódusos rendszerben elfoglalt helyéből jósoljuk meg az egyes atomok valenciahéj elektronkonfigurációját. Lásd a 8.21. ábrát “Különböző elemek a periódusos rendszerben”.
- Ca
- Sn
Feloldás
- Ca az s blokk második oszlopában található. Azt várnánk, hogy az elektronkonfigurációja s2-vel végződjön. A kalcium elektronkonfigurációja 4s2.
- Sn a p blokk második oszlopában található, így azt várnánk, hogy elektronkonfigurációja p2-re végződjön. Az ón elektronkonfigurációja 5s24d105p2.
Teszteld magad
Az elemnek a periódusos rendszerben elfoglalt helye alapján jósoljuk meg az egyes atomok valenciahéj elektronkonfigurációját. Lásd a 8.21. ábrát “Különböző elemek a periódusos rendszerben”.
- Ti
- Cl
Válasz
- 4s23d2
- 3s23p5
A 8. ábra.21 Különböző elemek a periódusos rendszerben
Élelmiszer és ital alkalmazás: Mesterséges színek
A tárgyak színe más mechanizmusból ered, mint a neon és más kisülési fények színei. Bár a színes fények előállítják a színeiket, a tárgyak azért színesek, mert előnyösen visszatükröznek egy bizonyos színt a rájuk világító fehér fényből. Egy piros paradicsom például azért élénkpiros, mert visszaveri a piros fényt, miközben a szivárvány összes többi színét elnyeli.
Sok étel, például a paradicsom, erősen színezett; valójában az a gyakori kijelentés, hogy “először a szemeddel eszel”, annak hallgatólagos elismerése, hogy az étel vizuális vonzereje ugyanolyan fontos, mint az íze. De mi a helyzet a feldolgozott élelmiszerekkel?
Sok feldolgozott élelmiszerhez ételszínezéket adnak. Kétféle ételszínezék létezik: természetes és mesterséges. A természetes ételszínezékek közé tartozik a karamellizált cukor a barnához; az annatto, a kurkuma és a sáfrány a narancs vagy a sárga különböző árnyalataihoz; a répából származó betanin a lilához; és még a kármin is, egy mélyvörös színezék, amelyet a közép- és dél-amerikai kaktuszokon élősködő kis rovarból, a cochinealból vonnak ki. (Így van: lehet, hogy bogárlevet eszik!)
Egyes színezékek mesterségesek. Az Egyesült Államokban az Élelmiszer- és Gyógyszerügyi Hivatal jelenleg csak hét vegyületet hagy jóvá mesterséges színezékként élelmiszerekben, italokban és kozmetikumokban:
- FD&C kék #1: Brilliant Blue FCF
- FD&C kék #2: Indigotin
- FD&C zöld #3: Vörös #3: Eritrozin
- FD&C Vörös #40: Allura Red AC
- FD&C Sárga #5: Sárga #6: Sunset Yellow FCF
Az alacsonyabb számozású színek már nincsenek forgalomban, vagy különböző okokból kivonták őket a forgalomból. Ezek a mesterséges színezékek jellemzően nagy molekulák, amelyek bizonyos fényszíneket nagyon erősen elnyelnek, így már nagyon alacsony koncentrációban is hasznosak az élelmiszerekben és kozmetikumokban. Egyes kritikusok azt állítják, hogy a lakosság egy kis része (különösen a gyermekek) még ilyen kis mennyiségben is érzékeny a mesterséges színezékekre, és használatuk korlátozását vagy megszüntetését sürgetik. A mesterséges színezékekkel és azok viselkedésre gyakorolt hatásaival kapcsolatos hivatalos vizsgálatok azonban nem voltak meggyőzőek vagy ellentmondásosak. Ennek ellenére a legtöbb ember továbbra is élvezi a mesterséges színezéket tartalmazó feldolgozott élelmiszereket (mint amilyenek a mellékelt ábrán láthatóak).

Mesterséges ételszínezékek számos élelmiszertermékben, például feldolgozott élelmiszerekben, cukorkákban és tojásfestékekben találhatók. Még az állateledelek is tartalmaznak mesterséges ételszínezéket, bár valószínűleg az állatot ez nem érdekli!
Forrás: Mesterséges ételfesték:
Főbb tanulságok
- A periódusos rendszer alakjáért az elektronok elrendeződése felelős az atomokban.
- Az elektronkonfigurációk megjósolhatók az atomnak a periódusos rendszerben elfoglalt helye alapján.
GYakorlatok
-
A periódusos rendszerben hol foglalnak el s alhéjakat az elektronok?
-
A periódusos rendszerben a d alhéjakat hol foglalják el elektronok?
-
Melyik blokkban található a Ra?
-
Melyik blokkban található a Br?
-
Melyek a periódusos rendszer második oszlopában található elemek valenciahéj elektronkonfigurációi?
-
Melyek a periódusos rendszer utolsó előtti oszlopában található elemek valenciahéj elektronkonfigurációi?
-
Melyek a p blokk utolsó oszlopában lévő elemek valenciahéj elektronkonfigurációi?
-
Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
Melyek a p blokk első oszlopában található elemek valenciahéj elektronkonfigurációi?
a) Sr
b) S
10. Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
a) Fe
b) Ba
11. Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
a) V
b) Ar
12. Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
a) Cl
b) K
13. Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
a) Ge
b) C
14. Az elemnek a periódusos rendszerben elfoglalt helye alapján jósolja meg az egyes atomok elektronkonfigurációját.
a) Mg
b) I
Válaszok
az első két oszlop
az s blokk
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22s22p63s23p64s23d3
b) 1s22s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22s22p2