Tanulmányi célok
A fejezet végére Ön képes lesz arra, hogy..:
- A gázok különböző tulajdonságai közötti matematikai összefüggések azonosítása
- A kombinált gáztörvény és a kapcsolódó gáztörvények használata a különböző gáztulajdonságok értékeinek kiszámítására meghatározott körülmények között
A XVII. és különösen a XVIII. században, a természet megértésének vágyától és attól a törekvéstől vezérelve, hogy olyan léggömböket készítsenek, amelyekben repülni tudnak (1. ábra), számos tudós megállapította a gázok makroszkopikus fizikai tulajdonságai, azaz a nyomás, a térfogat, a hőmérséklet és a gáz mennyisége közötti összefüggéseket. Bár méréseik a mai mércével mérve nem voltak pontosak, meg tudták határozni e változók (pl. nyomás és hőmérséklet, nyomás és térfogat) párjai közötti matematikai összefüggéseket, amelyek egy ideális gázra érvényesek – egy olyan hipotetikus konstrukcióra, amelyet a valós gázok bizonyos körülmények között megközelítenek. Végül ezeket az egyes törvényeket egyetlen egyenletben – az ideális gáztörvényben – egyesítették, amely a gázok gázmennyiségeit viszonyítja egymáshoz, és alacsony nyomáson és mérsékelt hőmérsékleten meglehetősen pontos. Megvizsgáljuk az egyes összefüggések legfontosabb fejleményeit (pedagógiai okokból nem egészen történelmi sorrendben), majd ezeket az ideális gáztörvényben foglaljuk össze.

1. ábra. 1783-ban történt az első (a) hidrogénnel töltött ballonrepülés, (b) emberes hőlégballonrepülés és (c) emberes hidrogénnel töltött ballonrepülés. Amikor az (a) ábrázolt hidrogénnel töltött ballon leszállt, Gonesse megrémült falusiak állítólag vasvillákkal és késekkel megsemmisítették. Az utóbbi indítását állítólag 400 000 ember nézte meg Párizsban.
Nyomás és hőmérséklet: Gay-Lussac törvénye
Képzeljük el, hogy egy nyomásmérőhöz rögzített merev tartályt megtöltünk gázzal, majd a tartályt úgy zárjuk le, hogy a gáz ne tudjon kiszökni. Ha a tartályt lehűtjük, a benne lévő gáz szintén lehűl, és megfigyelhető, hogy a nyomása csökken. Mivel a tartály merev és szorosan lezárt, a gáz térfogata és molszáma is állandó marad. Ha a gömböt melegítjük, a benne lévő gáz melegebb lesz (2. ábra), és a nyomás nő.

2. ábra. A hőmérséklet hatása a gáznyomásra: Amikor a melegítőlap ki van kapcsolva, a gömbben lévő gáz nyomása viszonylag alacsony. A gáz melegedésével a gömbben lévő gáz nyomása növekszik.
Ez a hőmérséklet és a nyomás közötti összefüggés bármely állandó térfogatba zárt gázminta esetében megfigyelhető. A 3. ábrán egy példa kísérleti nyomás-hőmérséklet adatokra látható egy levegőmintára vonatkozóan ilyen körülmények között. Azt találjuk, hogy a hőmérséklet és a nyomás lineárisan összefügg, és ha a hőmérséklet a Kelvin-skálán van, akkor a P és a T egyenesen arányos (ismét, ha a térfogatot és a gázmolokat állandónak tartjuk); ha a hőmérséklet a Kelvin-skálán egy bizonyos tényezővel nő, a gáznyomás ugyanezzel a tényezővel nő.
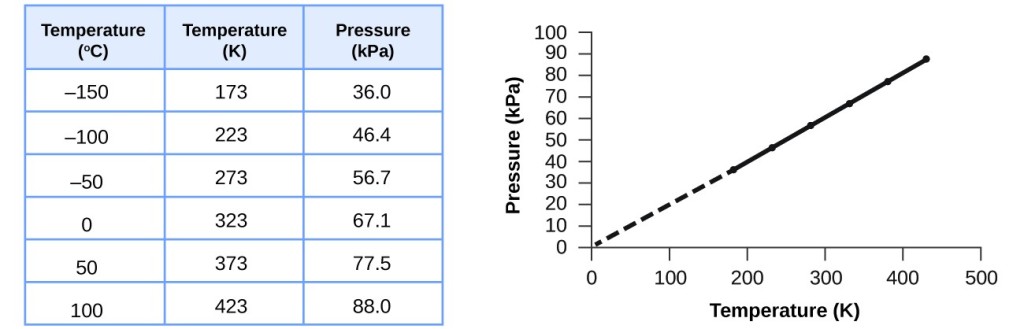
3. ábra. Állandó térfogat és levegőmennyiség esetén a nyomás és a hőmérséklet egyenesen arányos, feltéve, hogy a hőmérséklet kelvinben van megadva. (Alacsonyabb hőmérsékleten nem lehet méréseket végezni a gáz kondenzációja miatt.) Ha ezt a vonalat alacsonyabb nyomásokra extrapoláljuk, akkor -273 °C-on éri el a 0 nyomást, ami a kelvin skálán 0, és a lehető legalacsonyabb hőmérséklet, amit abszolút nullának nevezünk.
Guillaume Amontons volt az első, aki empirikusan megállapította a gáz nyomása és hőmérséklete közötti összefüggést (~1700), majd Joseph Louis Gay-Lussac határozta meg az összefüggést pontosabban (~1800). Emiatt a gázok P-T összefüggését Gay-Lussac törvénye vagy Amontons törvénye néven ismerjük. Mindkét néven azt mondja ki, hogy egy adott mennyiségű gáz nyomása egyenesen arányos a hőmérsékletével a Kelvin-skálán, ha a térfogatot állandó értéken tartjuk. Matematikailag ez így írható le:
\nagy P\propto T
\nagy P=\text{konstans}\times T
\nagy P=k\times T
ahol ∝ azt jelenti “arányos”, k pedig egy arányossági állandó, amely a gáz azonosságától, mennyiségétől és térfogatától függ.
\large\frac{{P}_{1}}{{T}_{1}}=\frac{{P}_{2}}{{T}_{2}}
Ez az egyenlet hasznos nyomás-hőmérséklet számításoknál egy állandó térfogatú, zárt gáz esetében. Megjegyezzük, hogy a hőmérsékleteknek a kelvin skálán kell lenniük minden gáztörvény számításhoz (a 0 a kelvin skálán és a lehető legalacsonyabb hőmérsékletet abszolút nullának nevezzük). (Vegyük észre azt is, hogy legalább háromféleképpen írhatjuk le, hogyan változik egy gáz nyomása a hőmérséklet változásával: Használhatunk értéktáblázatot, grafikont vagy matematikai egyenletet.)
Térfogat és hőmérséklet: Charles törvénye
Ha egy lufit megtöltünk levegővel és lezárjuk, akkor a lufi légköri nyomáson, mondjuk 1 atm, meghatározott mennyiségű levegőt tartalmaz. Ha a lufit hűtőszekrénybe tesszük, a benne lévő gáz kihűl, és a lufi összezsugorodik (bár mind a gázmennyiség, mind a nyomás állandó marad). Ha nagyon lehűtjük a lufit, akkor nagyon összezsugorodik, és amikor felmelegszik, újra kitágul.
Ez a videó azt mutatja be, hogy egy gáz térfogata a hűtés és a melegítés hatására csökken, illetve nő.
A hőmérsékletnek egy adott mennyiségű, állandó nyomáson lévő zárt gáz térfogatára gyakorolt hatására vonatkozó példák általánosságban igazak: A térfogat a hőmérséklet növekedésével nő, a hőmérséklet csökkenésével pedig csökken. A 4. ábra tartalmazza és grafikonon ábrázolja a térfogat-hőmérséklet adatokat egy 1 atm-os metángáz 1-molos mintájára.

A 4. ábra. A térfogat és a hőmérséklet lineárisan összefügg 1 mól metángáz esetében 1 atm állandó nyomáson. Ha a hőmérséklet kelvinben van megadva, akkor a térfogat és a hőmérséklet egyenesen arányos. Az egyenes 111 K-nál megáll, mert a metán ezen a hőmérsékleten cseppfolyósodik; ha extrapoláljuk, metszi a grafikon origóját, ami az abszolút nulla hőmérsékletet jelenti.
Az adott mennyiségű gáz állandó nyomáson mért térfogata és hőmérséklete közötti összefüggést Charles törvényének nevezik Jacques Alexandre César Charles francia tudós és léghajózás úttörőjének elismeréseként. Charles törvénye kimondja, hogy egy adott mennyiségű gáz térfogata egyenesen arányos a hőmérsékletével a Kelvin-skálán, ha a nyomás állandó.
Matematikailag ez a következőképpen írható fel:
\nagy V\propto T
\nagy V=\text{konstans}\cdot T
\nagy V=k\cdot T
mivel k egy arányossági állandó, amely a gáz mennyiségétől és nyomásától függ.
\nagy\frac{{V}_{1}}{{T}_{1}}=\frac{{V}_{2}}{{T}_{2}}
Térfogat és nyomás: Boyle törvénye
Ha egy légmentes fecskendőt részben megtöltünk levegővel, a fecskendő állandó hőmérsékleten, mondjuk 25 °C-on meghatározott mennyiségű levegőt tartalmaz. Ha lassan benyomjuk a dugattyút, miközben a hőmérsékletet állandóan tartjuk, a fecskendőben lévő gáz kisebb térfogatúvá tömörül, és a nyomása nő; ha kihúzzuk a dugattyút, a térfogat nő, a nyomás pedig csökken. Ez a példa a térfogat adott mennyiségű zárt gáz nyomására gyakorolt hatására általánosságban igaz. Ha csökkentjük egy zárt gáz térfogatát, akkor nő a nyomása, ha pedig növeljük a térfogatát, akkor csökken a nyomása. Valójában, ha a térfogat egy bizonyos tényezővel nő, a nyomás ugyanilyen tényezővel csökken, és fordítva. Egy szobahőmérsékletű levegőminta térfogat-nyomás adatait az 5. ábra grafikonja mutatja.

5. ábra. Ha egy gáz kisebb térfogatot foglal el, nagyobb nyomást gyakorol; ha nagyobb térfogatot foglal el, kisebb nyomást gyakorol (feltételezve, hogy a gáz mennyisége és a hőmérséklet nem változik). Mivel P és V fordítottan arányosak, az 1/P vs. V grafikon lineáris.
A P-T és V-T összefüggésekkel ellentétben a nyomás és a térfogat nem egyenesen arányosak egymással. Ehelyett a P és a V fordított arányosságot mutat: A nyomás növelése a gáz térfogatának csökkenését eredményezi. Matematikailag ez leírható:
\nagy P\propto 1\text{/}V\text{ vagy }P=k\cdot 1\text{/}V\text{ vagy }P\cdot V=k\text{ vagy }{P}_{1}{V}_{1}={P}_{2}{V}_{2}
mivel k egy állandó. Grafikusan ezt az összefüggést az az egyenes mutatja, amely a nyomás \nagy\balra(\frac{1}{P}\jobbra) inverzének és a térfogatnak (V), illetve a térfogat \nagy\balra(\frac{1}{V}\jobbra) és a nyomás (V) inverzének ábrázolásakor adódik. A görbe vonalakkal ellátott grafikonok nehezen olvashatók le pontosan a változók alacsony vagy magas értékeinél, és nehezebben használhatók az elméleti egyenletek és paraméterek kísérleti adatokhoz való illesztéséhez. Ezen okok miatt a tudósok gyakran próbálják megtalálni a módját annak, hogy “linearizálják” az adataikat. Ha a P-t a V függvényében ábrázoljuk, hiperbolát kapunk (lásd a 6. ábrát).
Az adott mennyiségű gáz térfogata és nyomása közötti összefüggést állandó hőmérsékleten először Robert Boyle angol természetfilozófus publikálta több mint 300 évvel ezelőtt. Ezt a ma Boyle-törvényként ismert állításban foglalja össze: Egy adott mennyiségű gáz térfogata állandó hőmérsékleten fordítottan arányos azzal a nyomással, amely alatt mérik.
Kémia a gyakorlatban: Légzés és Boyle törvénye
Mit csinálsz percenként körülbelül 20-szor egész életedben, szünet nélkül, és gyakran anélkül, hogy tudatában lennél? A válasz természetesen a légzés, vagyis a légzés. Hogyan működik? Kiderül, hogy itt a gáztörvények érvényesek. A tüdőd felveszi a szervezetednek szükséges gázt (oxigén), és megszabadul a hulladékgáztól (szén-dioxid). A tüdő szivacsos, rugalmas szövetből áll, amely légzés közben kitágul és összehúzódik. Belégzéskor a rekeszizom és a bordaközi izmok (a bordák közötti izmok) összehúzódnak, ezáltal kitágul a mellüreg, és a tüdő térfogata megnő. A térfogatnövekedés nyomáscsökkenéshez vezet (Boyle törvénye). Ennek hatására a levegő a tüdőbe áramlik (magas nyomásról alacsony nyomásra). Kilégzéskor a folyamat megfordul: A rekeszizom és a bordaizmok ellazulnak, a mellüreg összehúzódik, és a tüdő térfogata csökken, ami a nyomás növekedéséhez vezet (ismét Boyle törvénye), és a levegő kiáramlik a tüdőből (magas nyomásról alacsony nyomásra). Ezután újra és újra ki- és belélegzel, és újra és újra megismétlődik ez a Boyle-törvény szerinti ciklus egész hátralévő életedben (7. ábra).
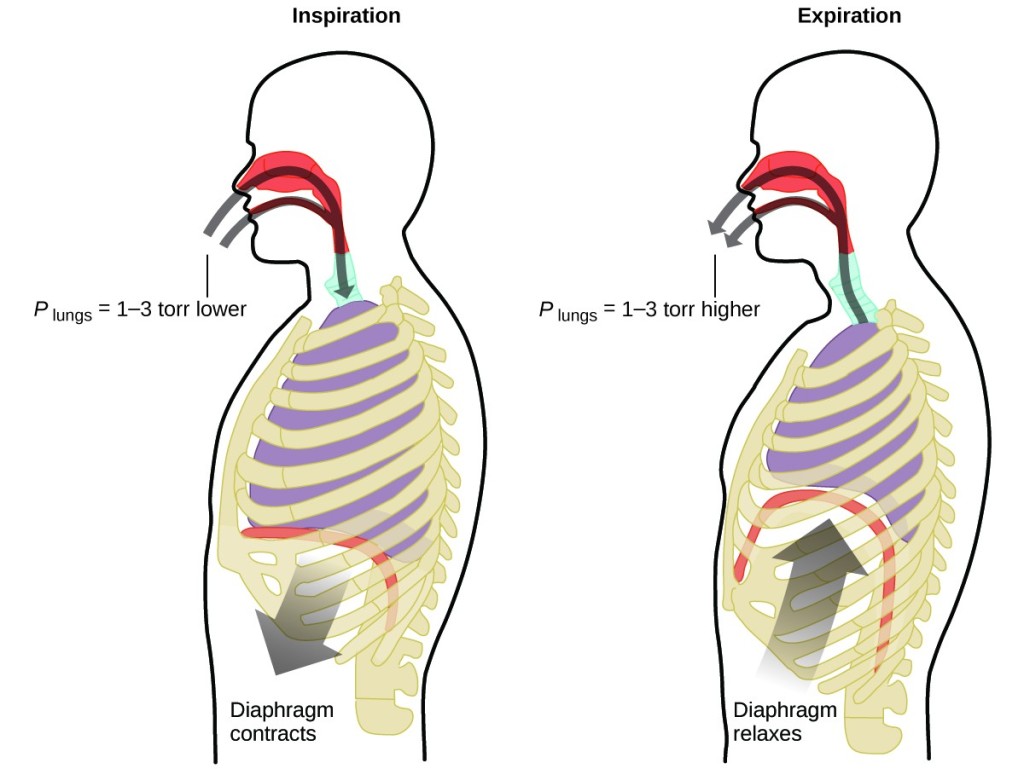
7. ábra. A légzés azért történik, mert a tüdő térfogatának tágulása és összehúzódása kis nyomáskülönbségeket hoz létre a tüdő és a környezet között, aminek következtében a levegő beszívódik a tüdőbe és kiszorul a tüdőből.
Gázmólok és térfogat: Avogadro törvénye
Az olasz tudós, Amedeo Avogadro 1811-ben felállított egy hipotézist a gázok viselkedésének magyarázatára, amely szerint minden gáz azonos térfogata, azonos hőmérséklet és nyomás mellett mérve, azonos számú molekulát tartalmaz. Idővel ezt az összefüggést számos kísérleti megfigyelés alátámasztotta, amit Avogadro törvénye fejezett ki: Egy zárt gáz esetében a térfogat (V) és a mólok száma (n) egyenesen arányos, ha a nyomás és a hőmérséklet egyaránt állandó.
Egyenlet formájában ez a következőképpen írható fel:
\large\begin{array}{ccccc}V\propto n& \text{or}& V=k\times n& \text{or}& \text{or}& \frac{{V}_{1}}{{n}_{1}}=\frac{{V}_{2}}{{n}_{2}}\end{array}
A többi változópárra is meghatározhatók matematikai összefüggések, mint például P versus n és n versus T.
Glosszárium
abszolút nulla: az a hőmérséklet, amelyen a Charles-törvény szerint a gáz térfogata nulla lenne.
Avogadro törvénye: egy gáz térfogata állandó hőmérsékleten és nyomáson arányos a gázmolekulák számával
Boyle törvénye: adott számú molnyi gáz térfogata állandó hőmérsékleten tartva fordítottan arányos azzal a nyomással, amely alatt mérjük
Charles törvénye:
Gay-Lussac-törvény: adott számú molnyi gáz térfogata egyenesen arányos a kelvin-hőmérsékletével, ha a nyomást állandóan tartjuk
Gay-Lussac-törvény: (más néven Amontons-törvény) adott számú molnyi gáz nyomása egyenesen arányos a kelvin-hőmérsékletével, ha a térfogat állandó