BEVEZETÉS
A heterozigóta familiáris hiperkoleszterinémia (FH) gyakori genetikai rendellenesség, amely korai ateroszklerotikus kardiovaszkuláris betegséggel (ASCVD) jár. A kezeletlen FH-ban szenvedő gyermekeknél 20 éves kor után fokozott a korai ASCVD kockázata.1 Az alacsony sűrűségű lipoprotein-koleszterin (LDL-C) szintjének súlyos emelkedése már magzati korban elkezdődik, és az artériák falának tartós LDL-C-expozíciójához vezet, ami felgyorsítja a koleszterin lerakódását és az érgyulladást, és hajlamosít az ateroszklerózis korai megindulására, különösen a koszorúerekben és az aortában.
A sztatinok és más lipidcsökkentő terápiák (LLT-k) hatékonyan csökkentik az LDL-C-t, gyermekek és serdülők esetében biztonságosak, és már fiatal korban helyreállítják az endothelfunkciót.2-4 Nemrégiben javasolták a gyermekek általános szűrését 2 éves kortól és 8 éves kor előtt5,6 a kezelést igénylő egyének felderítésére. Ez a megközelítés azonban elméleti megfontolásokon alapul, és a való életben nem bizonyított.
Mindemellett keveset tudunk a 18 évesnél fiatalabb FH-betegek jellemzőiről, az ezeknél a betegeknél alkalmazott LLT-ről és a valós életben elért lipidcélokról. Az információhiány még nagyobb a követési adatok esetében. A nemzeti regiszterek segítségével rendelkezésre bocsáthatók ezek a kulcsfontosságú információk, amelyek szükségesek az FH ellátási modelljeinek, a terápiás protokolloknak és az egészségügyi politikának a javításához.7,8 A SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) célja a prognosztikai tényezők és az ASCVD kialakulását és a mortalitást befolyásoló mechanizmusok jobb megismerése volt az FH-populációban.
A célunk az volt, hogy elemezzük a betegek jellemzőit és értékeljük az LLT- és lipidcélokat a felvételkor és a követés során a SAFEHEART-ba bevont 18 évnél fiatalabb FH-betegeknél, valamint hogy meghatározzuk azokat a tényezőket, amelyek megjósolják e célok elérésének valószínűségét.
MÓDSZEREKTanulmány felépítése és populáció
A SAFEHEART egy nyitott, multicentrikus, országos, hosszú távú prospektív kohorszvizsgálat egy molekulárisan meghatározott FH-populációban Spanyolországban. Az FH-családokból származó résztvevők toborzása 2004-ben kezdődött és jelenleg is tart. A felvételi kritériumok az FH genetikai diagnózisával rendelkező indexes esetek és 15 évnél idősebb, FH genetikai diagnózissal rendelkező rokonaik, valamint az FH genetikai diagnózisa nélküli rokonaik (kontrollcsoport) voltak. Mindazonáltal a 15 évnél fiatalabb résztvevőket is bevonták, ha szüleik ezt kérték. A vizsgálatot a helyi etikai bizottságok jóváhagyták. Minden jogosult személy és/vagy legalább 1 szülőjük vagy törvényes gyámjuk írásbeli beleegyezését adta. A résztvevők nyomon követéséért egy madridi (Spanyolország) koordináló központ volt felelős. A betegekkel és/vagy szüleikkel évente felvették a kapcsolatot egy standardizált telefonhívás segítségével, hogy rögzítsék az életmódbeli szokások és a gyógyszerek lényeges változásait, valamint a kardiovaszkuláris eseményeket vagy egyéb egészségügyi problémákat. Azok a résztvevő orvosok, akik a betegeket és a családokat felvették ebbe a regiszterbe, képzésben részesültek, és a legjobb gyakorlatra vonatkozó iránymutatásokat éves találkozókon erősítették meg, amelyeken a terület szakértő orvosai vettek részt; emellett egy elektronikus alapú programot és telefonos tanácsadást alkalmaztak, és szükség esetén egy webalapú képzési programot is bevetettek a kezelés további támogatására. A kezelési döntéseket kizárólag az egyes betegek orvosa hozta meg.
Klinikai és laboratóriumi mérések
A demográfiai és klinikai jellemzőket a máshol leírtak szerint rögzítették.9 A vénás vérmintákat 12 órás koplalás után vették. A szérum-, plazma- és DNS-mintákat aliquotáltuk és -80°C-on tartósítottuk. A szérum összkoleszterin, trigliceridek és nagy sűrűségű lipoprotein koleszterin (HDL-C) szintjét egy központi laboratóriumban mértük enzimatikus módszerekkel. A szérum LDL-C-koncentrációt a Friedewald-képlet segítségével számították ki. A teljes vérből standard módszerekkel DNS-t izoláltunk, és az FH-t DNS-mikroarray segítségével genetikailag diagnosztizáltuk.10 Az LDL-C célértékeket a legújabb ajánlások és célkitűzések szerint határoztuk meg. Az alacsony sűrűségű lipoprotein-koleszterin
mg/dl volt az elsődleges cél.11 A 14 évesnél fiatalabb betegek esetében az alternatív cél az LDL-C mg/dl volt egyéb kardiovaszkuláris kockázati tényezők (dohányzás, HDL-C mg/dl, lipoprotein (a) > 50mg/dl vagy LDL-C > 250mg/dl) vagy korai kardiovaszkuláris betegség hiányában az ősöknél vagy a nagyszülőknél.6 A korai ismerős ASCVD-t úgy definiálták, mint az első esemény bekövetkezését 55 éves kor előtt férfiaknál és 65 éves kor előtt nőknél.Lipidcsökkentő terápia osztályozása
A maximális statin adagot 40-80mg/d atorvasztatinnak vagy 20-40mg/d rosuvastatinnak határozták meg, amelyeket nagy intenzitású statin adagoknak tekintettek. A maximális kombinált terápiát maximális sztatinadagként és 10 mg/d ezetimibként határozták meg. A maximális LLT-t úgy határozták meg, mint bármely olyan LLT-t, amely várhatóan legalább 50%-os csökkenést eredményez az LDL-C kiindulási szintjében: simvastatin 20, 40 vagy 80 mg/d plusz ezetimib 10 mg/d; pravastatin 40 mg/d ezetimib 10 mg/d-vel kombinálva; fluvastatin 80 mg/d plusz ezetimib 10 mg/d; atorvastatin 40 vagy 80 mg/d ezetimib 10 mg/d-vel vagy anélkül; atorvastatin 10 vagy 20 mg/d plusz ezetimib 10 mg/d; rosuvastatin 20 vagy 40 mg/d ezetimib 10 mg/d-vel vagy anélkül; rosuvastatin 10 mg/d plusz ezetimib 10 mg/d; és pitavastatin 4 mg/d ezetimib 10 mg/d-vel kombinálva.12,13
Genetikai elemzés
Az alacsony sűrűségű lipoprotein-koleszterinreceptor (LDLR) mutációit az LDL-receptor fehérje működésére gyakorolt ismert hatásuk alapján null (receptor-negatív) és defektív (receptor-defektív) mutációkba soroltuk a korábban leírtak szerint.14 A fehérje teljes hiányához vagy csonkolódásához (funkcióvesztéshez) vezető, in vitro funkcionális elemzéssel vagy számítógépes szimulációs elemzéssel kimutatott változatok receptor-negatívnak minősültek. Ezek a változatok a következők voltak: a) korai stop kodont okozó pontmutációk; b) az LDL-C receptorgén ligandumkötő doménjében lévő ötödik ciszteinben gazdag ismétlődést érintő miszense mutációk (2A osztályú mutáció); c) frame shiftet és korai stop kodont okozó kis deléciók vagy inszerciók; és d) nagy átrendeződések. Receptor-defektív mutációk voltak a fennmaradó infravörös pontmutációk és kis infravörös deléciók és inszerciók. Minden olyan mutációt, amelynek funkcionalitását in vitro vizsgálatokkal vagy számítógépes szimulációs elemzéssel nem tudtuk elemezni, “ismeretlen funkcionalitásúnak” minősítettünk, mivel nem lehettünk biztosak abban, hogy a receptorra gyakorolt hatás negatív vagy defektív; azonban patogénnek tekintettük őket, mivel az összes, 1 ilyen mutációt hordozó egyénnél hiperkoleszterinémia alakult ki, míg a mutáció nélküli rokonoknál a koleszterinszint normális volt.14
Statisztikai elemzés
A statisztikai elemzéseket az SPSS 18.0 verziójával (SPSS Inc, Chicago, Illinois, Egyesült Államok) végeztük. A változók eloszlásának normalitását a Kolmogorov-Smirnov-teszttel elemezték. A mennyiségi adatokat mediánként és interkvartilis tartományként (IQR), a minőségi adatokat pedig abszolút számként és százalékban fejeztük ki. Két populációt határoztunk meg: a belépési populációt (n = 241) és a követési populációt (más néven kohorsz), amely azokat a betegeket foglalta magában, akiknek a követéskor teljes plazma lipidprofiljuk volt (n = 217). A belépési és az utánkövetés közötti összes összehasonlítást a kohorszvizsgálatban végezték el. A minőségi változók közötti gyakorisági összehasonlításokat a chi-négyzet teszt segítségével végeztük el. A bináris változók változásait a McNemar-teszttel elemeztük. A mennyiségi változók mediánértékeit a Mann-Whitney-féle nemparametrikus teszttel vagy a Wilcoxon párosított előjeles rangsorpróbával hasonlítottuk össze. A kohorszvizsgálatban forward bináris logisztikus regressziós elemzést végeztek a sztatinhasználattal összefüggő változók meghatározására. Az egyváltozós elemzésekben statisztikailag szignifikáns változókat, valamint a priori előrejelző és zavaró tényezőket vettük figyelembe: életkor, nem, valamint az elsődleges/szakorvosi környezetben történő követés. Egy másik forward bináris logisztikus regressziós analízist végeztünk a kohorszvizsgálatban, kizárva azokat a betegeket, akik a belépéskor elérték a célt, hogy meghatározzuk az LDL-C
mg/dl eléréséhez kapcsolódó változókat. Az egyváltozós elemzésekben statisztikailag szignifikáns változókat, valamint a priori prediktorokat és zavaró tényezőket vettük figyelembe: életkor, nem, mutáció típusa (null vagy hibás), ezetimib alkalmazása, valamint elsődleges/szakrendelésen történő követés. A különbségeket statisztikailag szignifikánsnak tekintették P EREDMÉNYEK
Mostanáig 4141 résztvevőt vettek fel a SAFEHEART regiszterbe; 392-en 18 évnél fiatalabbak. Közülük 241-nél igazolták molekulárisan az FH-t, 217-et teljes lipidprofillal követtek nyomon (90,0%) (1. ábra). Huszonnégy beteget kihagytak az elemzésből, mivel a követéskor nem volt teljes lipidprofil. A nyomon követés 40 beteg esetében (18,4%) az alapellátásban történt. A követési idő mediánja 4,69 év volt (IQR, 2,48-6,38 év).
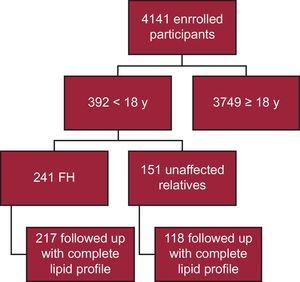
A vizsgálat sematikus folyamatábrája. FH, familiáris hiperkoleszterinémia.
A felvételkor (a belépő populáció) 129 FH-beteg (53,5%) volt férfi. A medián életkor 15,0 év volt (IQR, 14,0-16,0 év). A 2 legfiatalabb beteg 8 éves volt. Előzményes ASCVD nem volt egyetlen betegnél sem, és korai familiáris ASCVD 40 betegnél (16,6%) volt jelen. Az alapjellemzőket az 1. táblázat mutatja be. A kohorszbetegek és a nem követett betegek között a felvételkor fennálló alapjellemzők összehasonlítása az 1. táblázatban látható. A 2 csoport között nem találtunk szignifikáns különbségeket. Egyetlen betegnek sem volt ASCVD, magas vérnyomás vagy diabetes mellitus a kórtörténetében. A követés nélküli csoport nagyobb hányadát kezelték az alapellátásban, bár a különbség statisztikailag nem volt szignifikáns. A kohorszban szignifikánsan csökkent az összkoleszterin, az LDL-C, a trigliceridek és a nem-HDL-C plazmakoncentrációja; a HDL-C szignifikáns növekedése is megfigyelhető volt az utánkövetéskor (2. táblázat).
A belépő populáció kiindulási jellemzői
| FH betegek utánkövetéssel Medián (IQR)/száma. (%) |
FH betegek követés nélkül Medián (IQR)/száma. (%) |
P | |
|---|---|---|---|
| Szám | 217 | 24 | |
| Nem (férfi) | 117 (53,9%) | 12 (50%) | .72 |
| Kor, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Premature familiar ASCVD | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Aktív dohányos | 13 (6,0%) | 2 (8,3%) | .65 |
| Xanthoma | 1 (0,5%) | 0 (0,0%) | .99 |
| Corneal arcus | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Derékkörfogat, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Összkoleszterin, mg/dl | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dl | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | ,71 |
| HDL-C, mg/dl | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dl | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 |
| Non-HDL-C, mg/dl | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp(a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Az alapellátásban kezelt | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, atheroscleroticus cardiovascularis betegség; BMI, testtömegindex; FH, familiáris hypercholesterinaemia; HDL-C, nagy sűrűségű lipoprotein koleszterin; LDL-C, kis sűrűségű lipoprotein koleszterin; Lp(a), lipoprotein (a); IQR, interkvartilis tartomány; TG, trigliceridek.
Plazma lipid- és lipoproteinkoncentrációk (kohorsz)
| Kohorsz a belépéskor | Kohorsz a követéskor-up | P | |
|---|---|---|---|
| Koleszterin össz, mg/dl | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dl | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dl | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dl | 62,0 (49,0-80,2) | 70,0 (54,5-91.0) | .004 |
| Non-HDL-C, mg/dl | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, nagy sűrűségű lipoprotein koleszterin; LDL-C, kis sűrűségű lipoprotein koleszterin; TG, trigliceridek.
Az értékek medián (interkvartilis tartomány).
Funkcionális mutációk
Az LDL-C receptor génekben mutációval rendelkező 212 beteget (97,7%) és az apolipoprotein B génekben mutációval rendelkező 5 beteget (2,3%) azonosítottunk. Az LDL-C-receptorgének mutációi közül 95 (43,8%) nullmutációnak, 92 (42,4%) hibás mutációnak és 25 (11,5%) ismeretlen funkcionalitású mutációnak minősült.
Lipidcsökkentő terápia és a cél elérése
A 3. táblázat a különböző LLT-sémák alkalmazását mutatja a belépéskor és a követéskor. Az eredmények a sztatinok (44,2% a belépéskor és 68,2% a követéskor), az ezetimib (8,7% a belépéskor és 15,2% a követéskor), a maximális sztatinadag (3,3% a belépéskor és 13,9% a követéskor) és a maximális LLT (7,9% a belépéskor és 23,6% a követéskor) használatának jelentős növekedését mutatják. A leggyakrabban felírt sztatin a belépéskor (25,3%) és az utánkövetéskor (30.5%) az atorvasztatin volt. A rozuvasztatin felírása nőtt (a felvételkori 6,0%-ról 20,3%-ra az utánkövetéskor). A sztatinterápia medián időtartama 7,0 év volt (5,0-9,0 év). A menarche életkora 12,0 év (12,0-13,0 év) volt a sztatinnal kezelt lányoknál és 12,0 év (11,0-13,0 év) a sztatinnal nem kezelt lányoknál (P = .77). Sem a májtranszaminázok, sem a kreatin-foszfokináz emelkedését nem figyelték meg. Fibrátokat és epesav-szekesztránsokat csak 15 betegnél alkalmaztak a felvételkor (7,0%) és 3 betegnél a követéskor (1,5%). Ezetimib monoterápiát sztatin nélkül 18 betegnél alkalmaztak a felvételkor (8,3%) és 24 betegnél a követéskor (11,1%). A kezeléshez való ragaszkodás tekintetében 10 beteg (4,6%) számolt be arról, hogy a követés során havonta legalább 1 napon nem szedett gyógyszert. A többváltozós elemzés során egyetlen változó sem állt független kapcsolatban a sztatinhasználattal.
Lipidcsökkentő terápiák és az LDL-C cél elérése (kohorsz)
| A belépéskor-/folytatáskor-up- | At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ | P | |
|---|---|---|---|---|---|
| Statinokat kapó betegek | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| A maximális sztatinadagot kapó betegek | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Ezetimibetegek | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| A maximális kombinált terápiát kapó betegek | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Páciensek maximális LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, alacsony sűrűségű lipoprotein koleszterin; LLT, lipidcsökkentő kezelés.
Az értékek n (%). – = nincs jelen; + = jelen van.
Az LLT osztályozását lásd a szövegben.
A plazma LDL-C koncentrációja átlagosan 12,5%-kal csökkent, és a követéskor 138,0 mg/dl-es mediánértéket ért el. Az FH-ra vonatkozó legújabb nemzetközi ajánlásokban meghatározott alacsony sűrűségű lipoprotein-koleszterin célértékeket a belépéskor 20,3%, az utánkövetéskor pedig 41,5% érte el (3. táblázat és 2. ábra). Amikor a 14 évesnél fiatalabb betegek esetében az LDL-C
mg/dl alternatív célt vették figyelembe, 48 betegből 8 (16,7%) és 6 betegből 1 (16,7%) érte el a célt a felvételkor, illetve az utánkövetéskor. A többváltozós elemzésben az egyetlen változó, amely független kapcsolatban állt az LDL-C cél elérésével, a sztatinhasználat volt (esélyhányados, 13,83; 95%-os konfidenciaintervallum, 2,98-64,15). Az egészségügyi szolgáltató típusa (szakorvos vagy háziorvos), az életkor, a nem, a lipoprotein(a)-szint és a mutáció típusa nem állt összefüggésben az LDL-C cél elérésével.
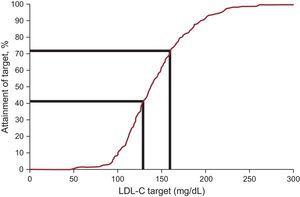
Kezelési célok 18 évnél fiatalabb familiáris hiperkoleszterinémiás betegeknél: az LDL-C célt elérő betegek aránya. LDL-C, alacsony sűrűségű lipoprotein-koleszterin.
DISZCUSSION
Ebben a tanulmányban a SAFEHEART regiszterbe felvett, 18 évesnél fiatalabb, molekulárisan meghatározott FH-betegek longitudinális kohorszában a jellemzőkről, az LLT alkalmazásáról és az LDL-C cél eléréséről számolunk be. Az FH-betegek ezen egyedülálló regisztere a spanyolországi valós életből származó adatokon alapul, mind a szakellátásban, mind az alapellátásban. Eredményeink azt mutatják, hogy a
mg/dl-es LDL-C-kezelési célt a betegek mindössze 20,3%-a érte el a felvételkor és 41,5%-a a követéskor, a betegek 68,2%-a pedig LLT-t kapott. A sztatinhasználat volt az egyetlen olyan tényező, amely független kapcsolatban állt az LDL-C cél elérésével. Tudomásunk szerint egyetlen más munka sem mutatta ki a cél elérését 18 évesnél fiatalabb FH-betegeknél, és ez a tanulmány az első, amely nagy populációban számolt be erről.
A közelmúltban egy brit regiszter15 207 FH-ban szenvedő gyermeket elemzett, és a gyermekek 64%-ánál mutációkat azonosított, és megállapította, hogy 48%-uk LLT-t kapott; 35%-os LDL-C-csökkenést értek el. A szerzők azonban nem számoltak be célelérési eredményekről. Egy másik jelentés, amely egy kis alanyi mintát (n = 89) elemzett, 43%-os LDL-C-csökkenést mutatott ki a hosszú távú követés során.16 Ez a nagyobb mértékű csökkenés valószínűleg a kombinált terápia gyakoribb alkalmazásának (56%) köszönhető. Nem mutattak ki objektív elérési eredményeket. Egy másik, 207 hollandiai betegről szóló retrospektív cikkben a betegeknek csak 26%-a részesült LLT-ben, és ismét nem közöltek eredményeket az LDL-C cél elérésével kapcsolatban.17
Ez a longitudinális vizsgálat kimutatta, hogy a 18 évnél fiatalabb FH-betegek LDL-C-szintje idővel változhat az LLT módosításának és az orvosoktatásnak köszönhetően. A sztatinokat szedő betegek aránya, a maximális sztatin dózis és a maximális LLT szignifikánsan nőtt a követés során. Érdekes módon adataink arra utalnak, hogy kohorszunk nem torzított, mivel nem volt statisztikailag szignifikáns különbség a nem követett betegek és a kohorsz között.
Az FH korai diagnózisa és kezelése alapvető fontosságú, különösen gyermekek és serdülők esetében, hogy megelőzzük az ASCVD kialakulását felnőttkorban. Az FH szűrését gyermekeknél érdemes és 8 éves kor előtt el kell végezni, mert a hiperkoleszterinémiás gyermekeknél fokozott a korai ASCVD kockázata. Ezen túlmenően a szűrés azonosíthatja a legnagyobb kockázatnak kitett gyermekeket, és gyorsíthatja az LLT megkezdését, amely bizonyítottan hatékonyan visszafordítja az ateroszklerotikus folyamatot és csökkenti az ASCVD kockázatát. Az FH-ban szenvedő gyermekeknél általában nincs klinikai ASCVD. Mindazonáltal a jövőbeli kockázat megléte alátámasztja az LLT alkalmazását, miközben a sztatinok az FH kezelésének sarokkövei.18
A gyermekkori FH-ban az LLT biztonságossága és tolerálhatósága mindig ellentmondásos, bár a jelentések szerint hasonlóak a felnőttekéhez.5,19,20 A közelmúltban Ramaswami és munkatársai15 a mi eredményeinkhez hasonlóan nem számoltak be biztonsági aggályokról. Mindazonáltal szigorú felügyelet ajánlott, különösen azoknál a betegeknél, akik nagyobb sztatinadagokat kapnak. A serdülő lányoknak azt is tanácsolni kell, hogy függesszék fel a sztatinterápiát, ha terhességet fontolgatnak. Mindazonáltal, bár több adatra van szükség a hosszú távú LLT-kezelés alatt álló gyermekek biztonságossági kérdéseiről, a közelmúltban végzett hosszú távú követéses munkák kiváló biztonsági profilt mutattak.21 Ezt a megállapítást közvetve a mi adataink is alátámasztják, mivel a betegek nagy aránya kezdte meg az LLT-kezelést a követés során, és kevés volt a lemorzsolódás. Eredményeink egyértelműen a sztatinokat, a magas sztatinadagot és a maximális LLT-t alkalmazó betegek megnövekedett arányát mutatják, a gyógyszeres kezelést elhagyó betegek alacsony aránya mellett. Ezek az adatok megerősítik a sztatinok biztonságosságát, adherenciáját és tolerálhatóságát, még magas dózisban történő alkalmazás esetén is, a 18 évesnél fiatalabb FH betegek esetében.22 Továbbá, eredményeink összhangban vannak korábbi jelentésekkel, amelyek szerint nincs hatásuk a szexuális érésre.23 Mindezek az eredmények megerősítik a “minél fiatalabb, annál jobb” koncepciót a sztatinok elkezdésének ideális életkorát illetően ezeknél a fiatal FH betegeknél.22
Eredményeink a 18 évnél fiatalabb FH-betegek nagy számát mutatják, és a korábbi tanulmányokkal15,16 összhangban arra utalnak, hogy a felnőtt FH-betegek hajlandóak közvetlen családtagjaikat is bevonni a szűrési és nyilvántartási tevékenységekbe. Ez a tény azt tükrözi, hogy ezek a betegek milyen komolyan veszik a problémájukat, és hogy orvosuk tanácsai milyen hatással lehetnek életmódjuk megváltoztatására. A felnőtt betegek ilyen hozzáállása hozzátartozóik egészséges életmódjának alapját képezi.24
Bár a 18 évesnél fiatalabb FH betegek esetében a leggyakoribb cél a 130 mg/dl alatti LDL-C szint, a 14 évesnél fiatalabb, nemdohányzó, HDL-C ≥ 40 mg/dl, lipoprotein (a) mg/dl, LDL-C mg/dl és LDL-C mg/dl értékű, valamint az ősöknél vagy nagyszülőknél korai kardiovaszkuláris betegség nélküli betegek esetében alternatív megközelítés is alkalmazható.6 Más legújabb irányelvek az LDL-C 50%-os csökkentését javasolják a kezelés előtti szinthez képest, de az ≥ 10 éves gyermekek esetében, különösen, ha további kardiovaszkuláris kockázati tényezők, köztük emelkedett lipoprotein(a) is fennállnak, az LDL-C célértékének mg/dl-nek kell lennie.11 Eredményeink is azt mutatják, hogy ezeknek a betegeknek milyen nehézséget jelent a lipidcélok elérése.25 Ráadásul az LDL-C célérték elérése hasonló volt, akár szakorvosok, akár alapellátó orvosok kezelték a betegeket. Így az FH-ban szenvedő gyermekbetegek esetében az alapellátásban olyan ellátási szintet lehet elérni, amely összehasonlítható a szakorvosi ellátással. E cél érdekében fontos hangsúlyozni azt a támogatást, amelyet a klinikusok regisztereken és célzott képzési programokon keresztül kapnak. A regiszterek optimalizálhatják a 18 évesnél fiatalabb FH-betegek kezelését azáltal, hogy lehetővé teszik az alap- és szakellátás integrációját, és az egészségügyi hatóságokat is támogathatják a döntéshozatalban.8,26
Korlátozások és erősségek
A 18 évesnél fiatalabb FH-betegek e nagy követéses vizsgálatában a beavatkozás változatlanul a beteg orvosa által nyújtott beavatkozás volt. Ebben a regiszterben hiányzik a megbízható kiindulási lipidprofil, mivel néhány beteg a felvételkor már kezelésben részesült. Továbbá az eredményeket több körülmény, például az eltérő életmód és a különböző kardiovaszkuláris kockázati tényezőkkel való társulás is módosíthatta, ami módosíthatta az eredményeket.
Összefoglalás
A SAFEHEART regiszter adatai azt mutatják, hogy a 18 évesnél fiatalabb FH betegek nagy részének magas az LDL-C szintje, és nem érik el az ajánlott LDL-C célértékeket. A követés során az LLT intenzitásának növekedését és az LDL-C-szintek szignifikáns csökkenését találtuk. A sztatinhasználat volt az egyetlen független előrejelzője az LDL-C cél elérésének. Ezenkívül a nyomon követés során nem észleltünk biztonsági aggályokat. Ezek az eredmények azt jelzik, hogy sok FH-betegnél nem megfelelő a kontroll, és hogy még mindig van lehetőség a kezelés javítására. Továbbá, ennek az FH-populációnak a nyomon követése hozzájárulhat az élethosszig tartó LLT biztonságosságára és a terápia megkezdésének optimális életkorára vonatkozó ismeretekhez, hogy megelőzzük az ASCVD kialakulását felnőttkorban.
FORRÁSZÓ
Ezt a munkát a Fundación Hipercolesterolemia Familiar G03/181-es, az Instituto de Salud Carlos III FIS PI12/01289-es és a Centro Nacional de Investigación Cardiovascular 08-2008-as ösztöndíja támogatta.
Érdekütközéses összeférhetetlenségek
Nincs bejelentett.
- –
A kezeletlen heterozigóta familiáris hiperkoleszterinémiában szenvedő gyermekeknél 20 éves kor után fokozott a korai ASCVD kockázata.
- –
A sztatinok és más lipidcsökkentő terápiák hatékonyan csökkentik az LDL-C-t és biztonságosak gyermekeknél és serdülőknél.
- –
Keveset tudunk a 18 évesnél fiatalabb FH betegek jellemzőiről, az ezeknél a betegeknél alkalmazott lipidcsökkentő terápiákról és a valós életben elért lipidcélokról.
- –
Ez az információs deficit még nagyobb a követési adatok esetében.
MIT TETT EZ A Vizsgálat?
- –
A 18 évesnél fiatalabb FH betegek nagy hányada nem éri el az ajánlott LDL-C célértékeket.
- –
A követés során az LLT intenzitásának növekedését és az LDL-C szint jelentős csökkenését találtuk.
- –
A sztatinhasználat volt az egyetlen független előrejelzője az LDL-C cél elérésének, és a követés során nem észleltünk biztonsági aggályokat.
- –
Ezek az eredmények megerősítik a “minél fiatalabb, annál jobb” koncepciót.