Bevezetés
Az ß-amiloid és a foszforilált tau-fehérjék az Alzheimer-kór (AD) patológiai jellemzői, amelyek felhalmozódnak és kiszámíthatóan terjednek az elosztott neurális hálózatokban, progresszív anyagcsere-rendellenességeket, neuronális károsodást és sejthalált okozva. Az idegrendszeri képalkotás megkönnyíti e kóros változások részletes értékelését a kognitív hanyatlás miatt kivizsgálás alatt álló betegeknél. Korábban az Alzheimer-kór végleges diagnózisa csak e fehérjeaggregátumok post mortem megfigyelésével és neuroanatómiai stádiumbeosztásával volt lehetséges. A molekuláris képalkotás legújabb vívmányai azonban lehetővé teszik az amiloid- és tau-lerakódások láthatóvá tételét élő emberi agyban, és közelebb vittek bennünket az Alzheimer-kór végleges in vivo diagnózisához.
Szerkezeti képalkotás
Az Amerikai Neurológiai Akadémia (AAN) irányelvei a kognitív panaszokkal küzdő személyek diagnosztikai vizsgálatáról1 nem kontrasztos CT vagy MRI segítségével történő strukturális agyi képalkotást javasolnak minden olyan személy esetében, akinek pozitív a klinikai anamnézise és objektív kognitív változásai vannak. Ebben az összefüggésben az agyi képalkotás elsődleges szerepe a nem degeneratív strukturális elváltozások kizárása, amelyek 5%-a nem feltétlenül nyilvánvaló a klinikai anamnézis vagy a fizikális vizsgálat2 alapján, és amelyek potenciálisan kezelhetők. Az AAN javasolja továbbá a vaszkuláris demencia (VaD), a Lewy-testes demencia (DLB) és a frontotemporális demencia (FTD) klinikai kizárását. A strukturális képalkotás javíthatja a diagnosztikai bizonyosságot, és a klinikai esetek 19%-28%-ában megváltoztatja a klinikai diagnózist, valamint a klinikai esetek 15%-ának kezelését.2
A strukturális atrófia értékelésénél a CT és az MRI a választandó képalkotó eljárások. Az atrófia betegségspecifikus mintázatait alaposan leírták és validálták ezekkel a módszerekkel. Bár az atrófia CT-n is megfigyelhető, az eredendően alacsonyabb térbeli felbontás és az alacsonyabb szürke/fehérállomány kontraszt miatt a neurodegeneratív változásokra vonatkozó, potenciálisan hasznos, finom megfigyelések elmaradnak. Ezért a klinikusok gyakran támaszkodnak az MRI-re a strukturális változások mintázatának és súlyosságának értékelésében, a kognitív hanyatlás nem neurodegeneratív okainak kizárásában, valamint a fehérállomány-változások súlyosságának és kiterjedésének értékelésében, amint azt alább részletesebben tárgyaljuk.
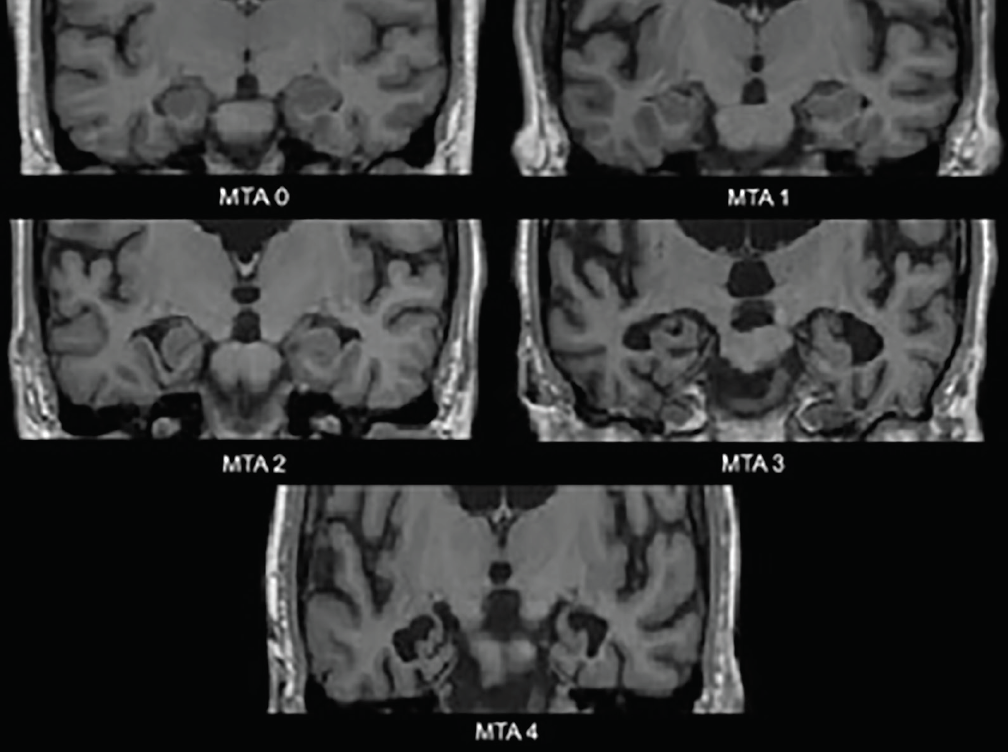
A Alzheimer-kórban a legkorábbi neurodegeneratív változások a mediális temporális lebenyekben – a hippokampuszban, az entorhinális kéregben és a parahippokampális gyrusban – jelentkeznek. Az atrófia megindulásával a chorioidea hasadék és az oldalsó kamra temporális szarva kitágul; ezeket a változásokat a koronális síkban lehet a legjobban értékelni. Az ezeken a struktúrákon alapuló, általánosan használt vizuális értékelési skála – a mediális temporális atrófia (MTA-skála) (1. ábra) – klinikailag3 és neuropatológiailag4 validált. Az ezt a skálát vagy az általa értékelt struktúrákat alkalmazó különböző tanulmányok jelentős képességet mutattak arra, hogy megkülönböztessék az Alzheimer-kórban szenvedőket az életkoruknak megfelelő kontrollcsoporttól4 vagy a DLB-ben4 vagy vaszkuláris kognitív károsodásban (VCI) szenvedőktől.5 A mediális temporális atrófia az amnesztikus enyhe kognitív károsodásból (MCI) az Alzheimer-demenciába való átmenetet is előre jelzi.3
Click to view larger
1. ábra. Medialis temporális atrófia (MTA) skála szerinti értékelések. MTA 0-nincs vagy minimálisan tágul a chorioidea hasadék; MTA 1 – a chorioidea hasadék enyhe kiszélesedése; MTA 2 – a chorioidea hasadék további kiszélesedése, amely beleolvad az oldalkamra temporális szarvába, a hippokampusz-képződés magasságának enyhe csökkenése; MTA 3 – a hippokampusz-képződés magasságának mérsékelt csökkenése, az oldalkamra temporális szarvának markáns megnagyobbodása; MTA 4 – a hippokampusz-képződés magasságának súlyos csökkenése, az oldalkamra temporális szarvának markáns megnagyobbodása.
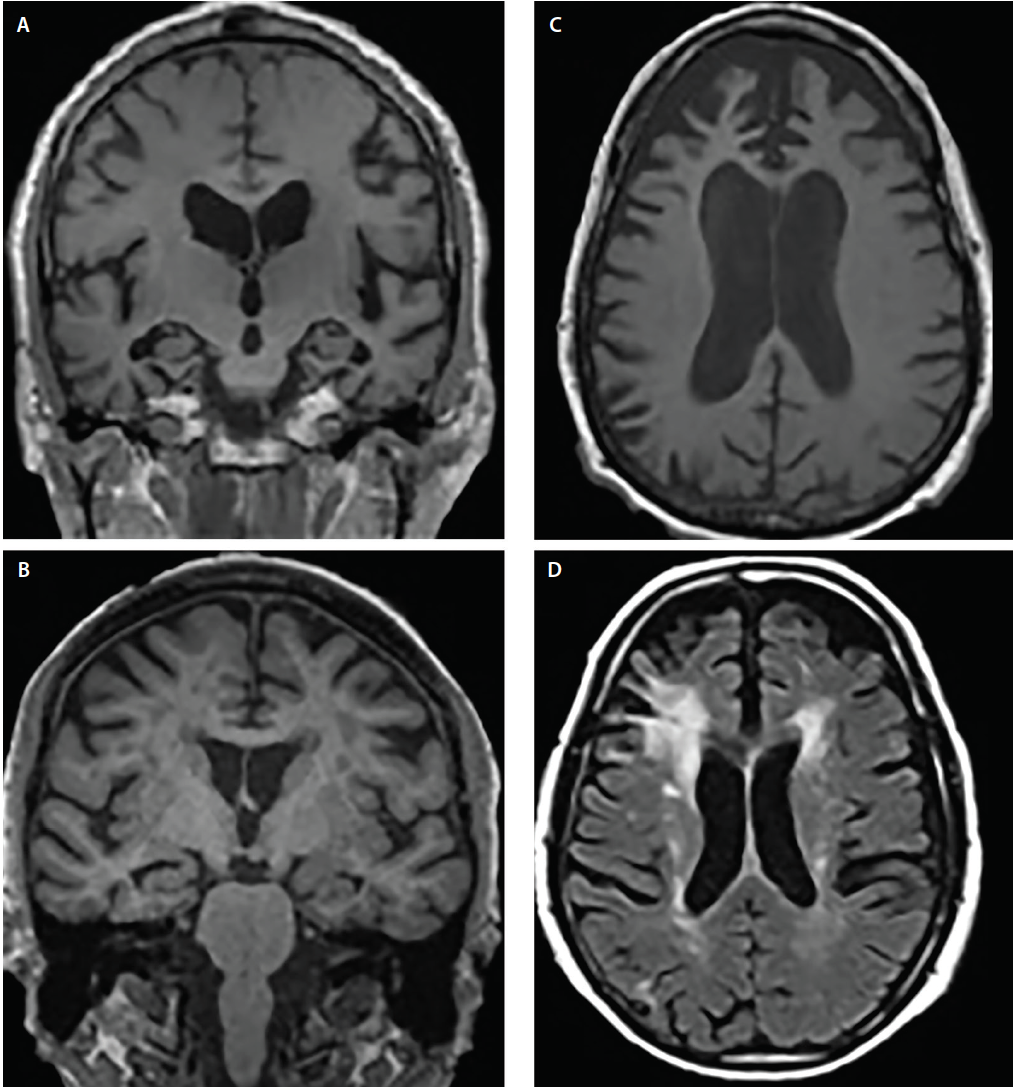
A demenciás szindrómák jellemzően kanonikus atrófiamintázatot6 mutatnak, amelyek megfelelnek a kognitív és viselkedési tüneteknek; az érintett struktúrák azonban átfedhetnek. Például az AD és a DLB egyaránt a medialis temporális lebeny érintettségét mutatja, de számos képalkotó és neuropatológiai vizsgálat kimutatta, hogy az AD-hoz képest a DLB jelentősen kevésbé hajlamos a medialis temporális struktúrákra4,5 (2. ábra).
Click to view larger
2. ábra. Az Alzheimer-kór (AD) (A), a Lewy-testes demencia (DLB) (B), a frontotemporális demencia (FTD) (C) és a vaszkuláris demencia (VaD) (D) strukturális atrófia mintázatai. A koronális T1-súlyozott MRI általános agykérgi atrófiát, de különböző mértékű hippokampusz-atrófiát mutat AD-ben (A) és DLB-ben (B). Az axiális T1-súlyozott MRI a bvFTD atrófiáját mutatja, a medialis és laterális prefrontális agykérgeket érintő fokális preferenciával (C). A tengelyirányú T2-súlyozott MRI konfluens periventrikuláris sapka- és halo fehérállomány-hypointenziókat (WMH-k) mutat, amelyek a corona radiatát érintik és a laterális prefrontális neokortexbe terjednek, enyhe szórt WMH-kat és WMH-kat a subependymalis kamrai bélésen és a septum pellucidumon VaD-ben (D).
Az Alzheimer-kór és a frontotemporális lebeny degeneráció (FTLD) egyaránt átfedő atrófiás területeket mutat, beleértve a prefrontális, orbitofrontális és anterior insuláris kérgeket, valamint az elülső és mediális temporális lebeny területeit.6 Egymáshoz viszonyítva azonban az AD szignifikánsan több atrófiát mutat az oldalsó parietális és occipitális agykérgekben, míg az FTLD több atrófiát mutat a frontális lebenyekben (2. ábra).6
A diagnosztikus képalkotás lehető legjobb kihasználása érdekében fontos az összes agyterület szisztematikus felmérése, a strukturális atrófia és az anatómiai kíméletesség régióinak észlelése. Egy nagy, multicentrikus vizsgálat nemrégiben értékelte 6 vizuális értékelési skála képességét 186 kórosan igazolt AD, DLB és FTLD eset helyes osztályozására.6 Ez a vizsgálat kimutatta, hogy több betegségspecifikus régió egyidejű értékelése jelentősen jobb megkülönböztetést biztosított, mint egyetlen területre való összpontosítás.4
A kognitív károsodásban szenvedő személyek vizsgálatakor fontos szempont az érrendszeri károsodás. Az iszkémiás elváltozás gyakori a normál öregedés során, és a gyakori társbetegségek (pl. magas vérnyomás, cukorbetegség és hiperkoleszterinémia) felgyorsítják. A kognitív károsodás érrendszeri hozzájárulására gyakran akkor következtetnek, ha T2-súlyozott vagy FLAIR (fluid attenuated inversion recovery) szekvenciákon jelentős fehérállomány-hiperintenzitást (WMH), agykérgi stroke-ot vagy stratégiailag elhelyezkedő lacune-okat észlelnek. A bazális ganglionok lacunáris stroke-jai és a centrum semiovale és a corona radiata WMH-jai a krónikus kisérrendszeri iszkémiás károsodást jelzik (2. ábra). Ezzel szemben a periventrikuláris sapkák gyakran nem iszkémiás eredetűek, és szubependimális gliózist tükröznek.7 Számos WMH súlyossági skála létezik (pl. a Fazekas-skála)7 , amelyek klinikai körülmények között használhatók. Ezek a pontozási algoritmusok mind egyetértenek abban, hogy a kiterjedt konfluens WMH és a szubkortikális lacunaris infarktusok – legalábbis részben – valószínűleg hozzájárulnak a kognitív hanyatláshoz.7
A diffúziós tenzor képalkotás (DTI) egy új MRI-szekvencia, amely érzékeny a víz szöveti diffúziójára, és amely a fehérállomány integritását értékeli, mivel az axonok felépítése korlátozza a víz áramlását. Az átlagos diffúziós képesség és a frakcionált anizotrópia méréseit gyakran használják a neurodegeneratív elváltozások jellemzésére a DTI-n. Az előbbi a diffúzió nagyságát méri, az utóbbi pedig azt, hogy a víz előnyben részesíti-e az egészséges axonokban elvárt egyetlen irányban történő áramlást. Mind az MCI, mind a demenciában szenvedő AD-populációkban következetesen csökkent átlagos diffúziós képességről és csökkent frakcionált anizotrópiáról számoltak be.8 Számos tanulmány azonosított DTI-változásokat olyan tünetmentes egyéneknél is, akiknél fennáll az AD kialakulásának kockázata9 , ami arra utal, hogy ezek a változások a betegség korai szakaszában jelentkeznek. A fehérállomány integritásának felmérése mellett a DTI a traktográfiás algoritmusok segítségével az agykérgi régiók közötti bruttó strukturális összeköttetések modellezésére is használható. Ez a módszer egyre nagyobb teret nyer az Alzheimer-kór területén, mivel bizonyítékok utalnak arra, hogy az amiloid és a tau patológiája az agyi kapcsolatokon keresztül terjedhet.10 Bár a DTI a fehérállomány integritásának mérésére alkalmas, a mozgásra való érzékenysége és más technikai korlátok – legalábbis egyelőre – korlátozzák klinikai alkalmazását.
Funkcionális képalkotás
Az agyi hipometabolizmus könnyen megfigyelhető neurodegeneratív rendellenességeknél, és segíthet a differenciáldiagnózisban. A neuronok működése a vérből származó oxigéntől és glükóztól függ, amelyek szállítását a regionális értágulat segíti elő. A 18F-fluorodeoxiglükóz pozitronemissziós tomográfia (FDG-PET) közvetve tükrözi az agykérgi aktivitás mértékét, és a glükóztól való metabolikus függőséget kihasználva könnyen alkalmazható a neurodegeneratív elváltozások megjelenítésére.
Az Alzheimer-kór jellegzetes hipometabolikus agykérgi szignatúrája a hátsó cinguláris (PCC); a precuneus; a temporális, a parietális és a későbbi stádiumokban a frontális agykérgek korai változásaiból áll. Ez a mintázat már korán, akár preszimptomatikusan is megnyilvánul,11 és klinikailag hasznos az AD és az FTD megkülönböztetésében.12 Az AD-tól eltérően az FTD metabolikus szignatúrája frontális, elülső temporális, bazális gangliáris és talamikus hipometabolizmust mutat, a hátsó asszociációs agykérgek viszonylagos kímélete mellett.13 Klinikai szempontból bizonytalan helyzetekben a klinikusok ezeket a metabolikus szignatúrákat használhatják az AD és az FTD elkülönítésére.12 Hasonlóképpen, bár a DLB neokortikális metabolikus szignatúrája zavaró átfedést mutathat az AD-éval, a DLB eseteiben occipitális hipometabolizmus is előfordulhat.14
A Center for Medicare & Medicaid Services “ésszerűnek és szükségesnek” tartja az FDG-PET-et csak azok esetében, akik mind az AD, mind az FTD kritériumainak megfelelnek, és akiknél az AAN irányelvek1 szerinti teljes diagnosztikai vizsgálat nem állapította meg véglegesen az etiológiát.15
A funkcionális MRI (fMRI) szintén képes az agyi aktivitás mérésére olyan szekvenciák alkalmazásával, amelyek érzékenyek az oxigénezett/deoxigénezett hemoglobin időbeli változásaira az agyi aktivitás következtében. Ilyen módon az fMRI az FDG-PET-hez kapcsolódik, mivel a hemoglobin változásait az agyi aktivitáshoz szükséges glükóz-anyagcsere hajtja. A régiók közötti időbeli függőségek felhasználhatók a funkcionális konnektivitásra való következtetésre (azaz arra, hogy mely régiók kommunikálnak aktívan). Az FDG-PET-hez képest az fMRI jobb térbeli felbontást kínál, ami lehetővé teszi a konnektivitás pontosabb feltérképezését. Az fMRI másik előnye, hogy a felvételek egy feladat végrehajtása közben vagy nyugalmi állapotban is elvégezhetők. Az előbbi a specifikus aktív állapotok által vezérelt konnektivitási mintázatokat azonosítja, míg az utóbbi a nyugalmi állapotban jelenlévő, alapértelmezett üzemmódú hálózat (DMN) néven ismert konnektivitási mintázatokat azonosítja. A DMN-t funkcionális csomópontok, a PCC és a precuneus határozzák meg, amelyek egy dorzális mediális alrendszerhez és egy mediális temporális alrendszerhez kapcsolódnak.16 Az amiloid lerakódás feltehetően a DMN funkcionális csomópontjaiban kezdődik. Ismert, hogy a DMN érintett az Alzheimer-kórban.16 Ezzel szemben az FTD-ben a DMN megkímélt, míg a salience vagy a figyelemhálózatok érintettek.17 Jelenleg az fMRI technológia kutatási alkalmazásokra korlátozódik, de aktívan kutatják a releváns klinikailag alkalmazható algoritmusok kifejlesztésének lehetőségeit.
Molekuláris képalkotás
Az Alzheimer-kór végleges diagnózisának kritériuma a postmortem neuropatológiai agyvizsgálat. Az AD klinikai diagnózisa még tapasztalt demenciaszakértők kezében is csak a 70,9% és 87,3% közötti elbizonytalanító szenzitivitást és a 44,3% és 70,8% közötti specificitást éri el.18 Az Alzheimer-kór klinikai diagnosztikai pontosságának javulásához leginkább az Alzheimer-kórhoz kapcsolódó ß-amiloid és foszforilált tau aggregátumokhoz specifikus affinitással rendelkező, sugárral jelölt PET képalkotó tracerek kifejlesztése járult hozzá (3. ábra), amelyek lehetővé teszik az alapjául szolgáló neuropatológia in vivo kimutatását (táblázat), ami korábban csak post mortem volt lehetséges.
Click to view larger
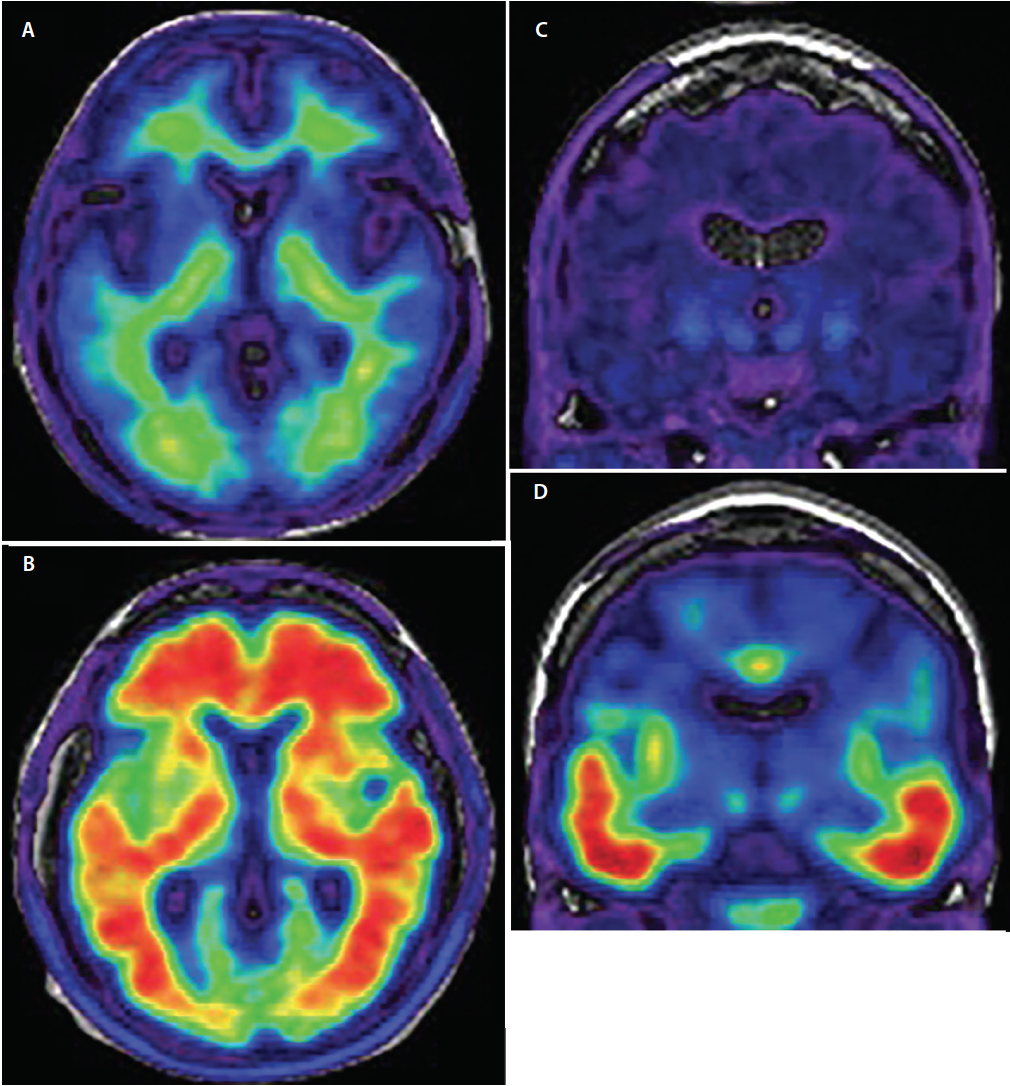
3. ábra. Axiális amiloid-PET amiloid-negatív (A) és amiloid-pozitív felvételek (B). Az amiloid-negatív felvételeken (A) a radiotracer jel alacsony intenzitást mutat, és a nem specifikus fehérállományi kötődésre korlátozódik. A szürke/fehérállomány határvonal megmarad. Az amiloid pozitív felvételeken (B) a radiotracer jel nagy intenzitású, és diffúzan kiterjed a szürkeállomány agykérgi régióira, elfedve a szürke-fehérállomány határátmenetet. Koronális tau-PET, amely tau negatív (C) és tau pozitív (D) felvételeket mutat. A tau-negatív felvételeken minimális, nem specifikus, alacsony intenzitású radiotracer jel van a medialis temporális, a bazális előagy és a basalis ganglionok régióiban. A tau-pozitív felvételeken (D) a radiotracer jel nagyobb intenzitású, és a neurofibrilláris csomók ismert fejlődési pályáját követve az alsó és oldalsó temporális agykérget érinti.
Amyloid pozitron emissziós tomográfia
Amyloid, és újabban a tau képalkotás forradalmasította az AD patológiájának megjelenítésére vonatkozó képességeinket még a preszimptomatikus stádiumokban is.19 Az amiloid PET képalkotó nyomjelzők validak és megbízhatóak az AD patológiájának in vivo kimutatására a betegség különböző stádiumaiban. Ezek a képalkotó nyomjelzők az amiloid fehérje specifikus konformációs motívumait kötik meg, és olyan nyomjelző felvételét eredményezik, amely szoros korrelációt mutat a postmortem amiloid lerakódással.20
A tau-val összehasonlítva, az amiloid patológia diffúzabban eloszló regionális mintázatban kezdődik, a frontális, temporális és occipitális lebeny bazális részeitől a dorzális neokortikális asszociációs területekig terjed, és csak a késői szakaszban érinti az elsődleges érzékelő és motoros kérget.21 A nyomjelzőanyag-felvétel legjelentősebb területei a frontális, a parietális és az oldalsó temporális agykérgek (3. ábra), ahol a felvétel 1,5-2-szer nagyobb az AD-ben szenvedőknél, mint a kontrollcsoportokban22 vagy más demenciában szenvedőknél.23
Az amiloid PET-felvételeket az AD amiloid-eloszlásának jellegzetes területein az agykérgi nyomjelzőanyag-felvétel szempontjából értékelik. A pozitív felvételek a szürke/fehérállomány megkülönböztetésének elvesztését mutatják, mivel a nyomjelző felvétele kiterjed a neokortexre. A negatív felvételek megtartják a szürke/fehér anyag megkülönböztetést, és csak a fehér anyag célponton kívüli kötődését mutatják.24 Az amiloid PET képalkotó minták megbízhatóan előre jelzik a kognitív hanyatlást mind egészséges embereknél, mind MCI-ben szenvedőknél.20
A 18F-florbetapir, a 18F-florbetaben és a 18F-flutemetamol klinikai alkalmazását az Élelmiszer- és Gyógyszerügyi Hivatal (FDA) engedélyezte.20 A biztosítók azonban nem fogadták el a technológiát a költségek és a klinikai túlhasználat kockázata miatt, betegségmódosító terápiák és bizonyított költségelőny hiányában. Egy metaanalízis szerint a pozitív amiloid PET-vizsgálat 95%-os érzékenységgel és 57%-os specificitással jelzi az MCI-ből AD-vé válást.25
A költségek, a kockázat és a haszon közötti bizonytalan kapcsolat vezetett az amiloid képalkotás megfelelő használatára vonatkozó kritériumok kidolgozásához, amelyek az amiloid PET vizsgálat szükségességét a megmagyarázhatatlan MCI, az atipikus AD és a korai kezdetű demencia esetén írják elő.26 A szakértők az amiloid képalkotás nem megfelelő indikációit is azonosították, amelyek közé tartozik a kognitív aggályok önálló értékelése az alapos klinikai, kognitív, laboratóriumi és strukturális neuroimaging vizsgálat előtt; objektív kognitív károsodás hiányában; az AD nagy valószínűségű előfordulása esetén (azaz klinikai egyenlőség hiányában); és a demencia súlyosságának stádiumbeosztása.
A képalkotó dementia-evidence for amyloid scanning (IDEAS) tanulmány – a Center for Medicare and Medicaid Services folyamatban lévő tanulmánya – jelenleg validálja a megfelelő felhasználási kritériumokat, és értékeli a PET által meghatározott amiloidstátusz hatását a betegség kezelésére és a hosszú távú kimenetelre az MCI-ben vagy atipikus előfordulásban szenvedő Medicare-ellátottak esetében. Az időközi elemzés kimutatta, hogy az amiloid PET beépítése a klinikai vizsgálatba az MCI-ben szenvedők 60,2%-ánál és a demenciában szenvedők 63,5%-ánál a betegség kezelésének megváltoztatását eredményezte.27 A hosszú távú eredmények meghatározása még folyamatban van.
Tau pozitronemissziós tomográfia
A Tau a második fehérje, amely lerakódik az Alzheimer-kórban szenvedők agyában. A Tau PET képalkotó nyomjelzők jelenleg fejlesztés alatt állnak, és már most ígéretesnek tűnnek. Az amiloid PET-hez hasonlóan a tau PET-nyomjelzők a foszforilált tau bizonyos konformációs motívumait célozzák. A tau nyomjelzők specifitását post mortem validálták,28 és a megfigyelt tau PET-jel szorosan megegyezik a neurofibrilláris csomók anatómiai eloszlásával, amelyet jelenleg az Alzheimer-kór neuropatológiai diagnózisához használnak.29 A tau-patológia legkorábbi, tau PET-képalkotással láthatóvá tehető szakaszai az entorhinális kéregben és a hippokampuszban található neurofibrilláris csomók lerakódásai. Ezután a tau lerakódások az inferior és laterális temporális (3. ábra), majd a parietális és occipitális, végül pedig a frontális agykérgekben válnak kimutathatóvá, követve a tau lerakódásnak az agyban való jól bevált Braak és Braak-féle patológiai szakaszolását.21 A tau nyomjelzők nem mentesülnek a diagnosztikai korlátoktól, és további fejlesztés alatt állnak klinikai szerepük pontosabb meghatározása érdekében. Tekintettel azonban arra, hogy a tau nyomjelzőhöz való kötődés dinamikusan változik az Alzheimer-kór teljes klinikai lefolyása során, ez a képalkotó mód valószínűleg jelentős szerepet fog játszani a betegség súlyosságának in vivo stádiumbeosztásában.30
Jövőbeli irányok
Mivel az Alzheimer-kór patológiája akár 20 évvel a demencia diagnózisa előtt is könnyen kimutatható19 , és kiszámítható szakaszos eloszlást követ, a kutatás jelenleg a korai, tünet előtti felismerésre és a diagnosztikai pontosság javítására összpontosít biomarkerek alkalmazásával (táblázat).31 A javasolt amiloid-tau-neurodegenerációs (ATN) kutatási keretrendszer, amely 3 biomarker változásának kimutatására összpontosít az agyban, előrevetíti a multimodális képalkotás klinikai jelentőségét.31 Az ATN osztályozási rendszer agnosztikus a klinikai szindrómák tekintetében, és a neurodegeneratív betegségek teljes spektrumát megragadja az AD biomarkerek szemszögéből. További fejlesztést és finomítást követően az ATN az objektív in vivo biomarker-kategorizálás révén várhatóan drámaian javítja a klinikai diagnosztikai pontosságot és javítja az ellátás minőségét.
Következtetés
A neuroimaging egyedülálló információkat nyújt a kognitív károsodás mögöttes etiológiájáról, és megkönnyíti a betegek és a családok számára a félelmetes és bizonytalan élményben való eligazodást. Valamennyi neurodegeneratív betegség jelentős klinikai heterogenitást mutat, és a legújabb molekuláris képalkotó eljárások fejlődése előtt egyiket sem lehetett véglegesen diagnosztizálni a halál beállta előtt. A modern agyi képalkotó technológia számos olyan epifénoménát képes kimutatni, amelyek a mögöttes neuropatológiát tükrözik, és amelyek egy része meglehetősen proximalisan helyezkedik el a betegség forrásához képest. A legbiztosabb klinikai diagnózis jelenleg a klinikai anamnézis, az orvosi megfigyelések, a fizikális vizsgálat, az orvosi vizsgálat, a neuropszichológiai tesztek és a diagnosztikus képalkotó eljárások megalapozott értelmezésén alapul. Ahogy az ATN biomarkerek tovább finomodnak, a klinikai diagnózisok az élő betegeknél korábban és biztosabban felállíthatók, kevésbé támaszkodnak majd a tünetek osztályozására, és lehetőséget biztosítanak a korábbi kezelési beavatkozásra, amely megváltoztathatja a neurodegeneratív betegség pályáját.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Az Amerikai Neurológiai Akadémia Minőségi Standardok Albizottságának jelentése. Neurológia. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medialis temporális lebeny atrófia az MRI-n megkülönbözteti az Alzheimer-kórt a Lewy-testes demenciától és a vaszkuláris kognitív károsodástól: prospektív vizsgálat a diagnózis patológiai ellenőrzésével. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. A normálisnak tűnő fehérállomány diffúziós tenzoros képalkotása enyhe kognitív károsodásban és korai Alzheimer-kórban: előzetes bizonyítékok axonális degenerációra a temporális lebenyben. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Fehérállományi képalkotó változások szubjektív és enyhe kognitív károsodásban. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Strukturális pályaváltozások előrejelzik a downstream tau felhalmozódást amiloid-pozitív idős egyénekben. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Az agyi metabolikus változások felszíni jellemzőkkel vezérelt feltérképezése kognitívan normális és enyhén károsodott időseknél. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET javítja a pontosságot a frontotemporális demencia és az Alzheimer-kór megkülönböztetésében. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebral glucose metabolism in patients with frontotemporal dementia. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Az enyhe kognitív károsodás, az Alzheimer-kór és más demenciák multicentrikus standardizált 18F-FDG PET diagnosztikája. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Hozzáférés: 2019. május 4.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. A neurodegeneratív betegségek nagyméretű emberi agyi hálózatokat vesznek célba. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Az Alzheimer-kór klinikai diagnózisának pontossága a National Institute on Aging Alzheimer Disease Centerekben, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Az Alzheimer-kór fejlődésének és patofiziológiájának képalkotása. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. Az FDG és az amiloid PET diagnosztikai értéke az Alzheimer-kórban – szisztematikus áttekintés. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Az Alzheimer-kórhoz kapcsolódó elváltozások neuropatológiai stádiumbeosztása. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Az agyi amiloid képalkotása Alzheimer-kórban Pittsburgh Compound-B-vel. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. (SNMMI eljárási standard/EANM gyakorlati útmutató az agy amiloid PET képalkotásához). J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Az amiloid képalkotás prediktív pontossága az enyhe kognitív károsodásból az Alzheimer-kórba való progresszióra vonatkozóan különböző hosszúságú követés mellett: metaanalízis. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Az új tau PET-tracer -MK-6240 autoradiográfiás validálása emberi postmortem agyszöveten. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Korai klinikai PET képalkotási eredmények az új PHF-tau radioligand -T807-vel. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. A tau képalkotás értékelése az Alzheimer-kór stádiumának meghatározásában és a béta-amiloid és a tauopátia közötti kölcsönhatások feltárásában. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA kutatási keretrendszer: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535-562.
MRA és DS nem számolnak be nyilvánosságra hozatalról.
LGA az Eli Lilly tanácsadó testületének tagja volt.