- Introducción
- Materiales y métodos
- Participantes
- Procedimientos del estudio, adquisición de datos del EEG y análisis
- Resultados
- Participantes
- EEG en estado de reposo
- Comparación de las densidades espectrales de potencia (PSDs) del canal Fp1
- Comparación de EEG en reposo del canal Fp1
- Discusión
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
Introducción
Los trastornos neurodegenerativos representan enormes necesidades médicas insatisfechas a nivel mundial y requieren el desarrollo de nuevas terapias modificadoras de la enfermedad. Dada la naturaleza insidiosa de estos trastornos y el elevado coste de muchas pruebas diagnósticas, existe una importante necesidad de contar con biomarcadores ampliamente disponibles, fiables y baratos para seguir la progresión de los procesos neurodegenerativos en plazos adecuados para el desarrollo de fármacos. En este contexto, el EEG puede tener un potencial notable. Aunque el EEG es susceptible a los factores conocidos del estilo de vida y a los medicamentos, tiene muchas ventajas considerables. El EEG refleja la actividad sináptica, que es un denominador común del impacto funcional de los procesos neurodegenerativos. El EEG es una tecnología no invasiva, portátil, segura y barata, ampliamente aceptada y que requiere un tiempo de adquisición relativamente corto. El EEG cualitativo se utiliza de forma rutinaria en la práctica clínica para el diagnóstico de la epilepsia. Más recientemente, se ha propuesto la integración de un biomarcador EEG cuantitativo (qEEG) y la evaluación del clínico para la evaluación del trastorno por déficit de atención/hiperactividad (TDAH) y la FDA (Food and Drug Administration) le ha concedido la designación de clase II para apoyar la evaluación clínica del TDAH (Lenartowicz y Loo, 2014; Snyder et al., 2015). El qEEG está en fase de investigación para su uso como criterio de valoración en enfermedades neurodegenerativas en ensayos clínicos. Sin embargo, los recientes avances en el análisis de datos, la interpretación y la mejora de la resolución espacial han aumentado el potencial del EEG como un biomarcador fiable y preciso para la progresión de la enfermedad neurodegenerativa. Muchos análisis observacionales de qEEG en estado de reposo apoyan su valor potencial como biomarcador para la detección de firmas neuronales de neurodegeneración que se producen en la enfermedad de Alzheimer (Babiloni et al., 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), la enfermedad de Parkinson (Sarnthein y Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) y la demencia frontotemporal (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
A lo largo de los años, la tecnología de hardware de EEG también ha evolucionado y han surgido varios sistemas inalámbricos multicanal que ofrecen señales fisiológicas y de EEG de alta calidad con un diseño más sencillo, práctico y cómodo que los sistemas tradicionales y engorrosos. Los sistemas de EEG tradicionales requieren un largo tiempo de montaje y aplicación, que suele implicar la abrasión del cuero cabelludo del paciente. El tiempo de aplicación y la incomodidad hacen que estos sistemas tradicionales sean difíciles de utilizar en poblaciones afectadas por la demencia, donde la cooperación con los largos procedimientos clínicos suele ser difícil. Sin embargo, varios de los sistemas inalámbricos disponibles actualmente pueden aplicarse en 20 minutos o menos, sin molestias durante la aplicación y con un ajuste cómodo durante las adquisiciones. En combinación con los avances en la detección de señales y las técnicas de análisis cuantitativo, los sistemas inalámbricos son candidatos ideales para la evaluación clínica relativamente rápida y tolerable de poblaciones de demencia potencialmente desafiantes, como la demencia frontotemporal variante del comportamiento, caracterizada por cambios prominentes en el comportamiento y la personalidad.
Más recientemente, también ha habido un mercado creciente para las tecnologías portátiles de consumo que conducen a sistemas de canal limitado disponibles para uso personal, como la meditación y el entrenamiento de relajación. Es concebible que estos sistemas, aunque su cobertura sea limitada, puedan utilizarse también en estudios clínicos seleccionados. Sin embargo, la aplicación de estos sistemas de consumo en la investigación de ensayos clínicos no se ha explorado ampliamente y la precisión y fiabilidad de estos sistemas para las mediciones repetidas no han sido bien establecidas. Además, no está claro si la adquisición de canales limitados puede proporcionar suficientes datos y cobertura anatómica para evaluar las firmas neuronales en pacientes afectados por enfermedades neurodegenerativas.
El presente estudio se diseñó para proporcionar una evaluación inicial del potencial de los sistemas de EEG de consumo para los ensayos clínicos, comparando la facilidad de uso, la precisión y la fiabilidad de dos sistemas de EEG inalámbricos multicanal de grado médico, B-Alert X24 y Enobio 20, con dos sistemas de consumo de canal limitado, Muse y Mindwave.
Materiales y métodos
Participantes
La población del estudio incluyó a cinco participantes sanos que cumplían los requisitos para el estudio (Tabla 1). Los sujetos fueron excluidos si, tras la revisión de su historial médico, medicamentos concomitantes y estilo de vida (consumo de alcohol y cafeína, así como estado de fumador), no se consideraban sanos. En concreto, se excluyeron del estudio si tenían antecedentes de epilepsia u otros trastornos del sueño, neurológicos o psiquiátricos, o si tomaban medicamentos o tenían un estilo de vida que se sabe que afecta a la señal del EEG, como el tabaquismo y un consumo considerable de alcohol y cafeína.

Tabla 1. Datos demográficos de la población del estudio y características de referencia.
Se obtuvo el consentimiento informado por escrito de todos los participantes en el estudio siguiendo las directrices para la investigación experimental con seres humanos exigidas por la Junta de Revisión Institucional de Chesapeake.
Procedimientos del estudio, adquisición de datos del EEG y análisis
Para evitar la posible variabilidad de la señal del EEG asociada a la ingesta nutricional y a las variaciones circadianas, todas las visitas se realizaron por la mañana después de un desayuno estándar bajo en carbohidratos y alto en proteínas (para minimizar la somnolencia posprandial) en el centro de estudio de los laboratorios de investigación Advanced Brain Monitoring (ABM). Además, se pidió a los participantes que evitaran las bebidas alcohólicas la noche anterior a la visita del estudio, así como que estuvieran en ayunas y evitaran la cafeína en la mañana de la visita.
Los datos de EEG se adquirieron durante dos visitas separadas con una semana de diferencia de dos sistemas de EEG médicos multicanal (20 canales), B-Alert (Advanced Brain Monitoring, ABM) y Enobio (Neuroelectrics) (Figura 1, Tabla 2) y dos sistemas de consumo de canal limitado, Muse (Interaxon, 2 canales) y Mindwave (Neurosky, un canal) (Figura 1, Tabla 2) en el siguiente orden: Muse, Mindwave, B-Alert, Enobio. El sistema de EEG B-Alert X24 y Enobio son sistemas inalámbricos de 20 canales con certificación médica CE que se aplican en el montaje internacional estándar 10-20 y adquieren la señal de EEG a una frecuencia de muestreo de 256 Hz. Además, B-Alert ha sido autorizado por la FDA para su uso como dispositivo médico.
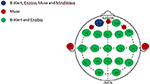
Figura 1. Distribución anatómica de los canales de los sistemas de EEG de canales múltiples y limitados. Representación de los canales compartidos y únicos entre los cuatro sistemas de EEG evaluados. El canal común a los cuatro sistemas de EEG, Fp1 (azul); canales exclusivos del sistema Muse (rojo); canales compartidos entre los sistemas multicanal, B-Alert y Enobio (verde).

Tabla 2. Comparación de los sistemas de EEG.
B-Alert utiliza los mastoides como canal de referencia. Enobio puede utilizarse con una referencia mastoidea, con un clip en la oreja o utilizando otras localizaciones en el cuero cabelludo. Mindwave también tiene una referencia en la oreja y Muse tiene tres canales de referencia en la frente. Todos los sistemas incluyen una comprobación de la calidad de la señal, pero a diferencia de los sistemas de EEG médicos, ambos sistemas de consumo tienen electrodos secos y no tienen una comprobación de la impedancia.
Estas tecnologías se seleccionaron en función de su capacidad para proporcionar a los usuarios finales resultados de EEG sin procesar a través de un acceso práctico y no prohibitivo.
Se adquirieron diez minutos de EEG en estado de reposo durante los ojos abiertos (EO) con fijación visual en un símbolo de cruz presentado en una pantalla de ordenador (5 min), así como con los ojos cerrados (EC) durante 5 min.
Dado que los cuatro sistemas sólo comparten el canal FP1 (Figura 1), los patrones de EEG (crudos y descontaminados), las densidades espectrales de potencia (PSD) y las comparaciones de fiabilidad de prueba/repetición entre los cuatro sistemas de EEG evaluados en el estudio se realizaron centrándose en el electrodo Fp1 tanto en condiciones EO como EC.
Los datos de EEG de cada sistema se cargaron en MATLAB (Mathworks) utilizando funciones construidas a medida. Los datos de EEG registrados durante las pausas y las instrucciones se descartaron antes del análisis. La densidad espectral de potencia del EEG para cada época de 1 s se calculó utilizando el método del periodograma modificado de Welch con una ventana de Hamming de 1 s de longitud. Las PSD se calcularon sobre el EEG en reposo durante los periodos de ojos abiertos y ojos cerrados. Para permitir unidades iguales (μV), se aplicó un factor de corrección de 1,25 (Muse), 0,25 (MindWave) o 1.000 (Enobio 20). Todos los datos de PSD del canal Fp1 se promediaron para los cinco sujetos de cada visita. El test-retest se realizó calculando y trazando Vist1/Visit2.
Resultados
Participantes
Los participantes eran todos voluntarios sanos con una edad media de 27 años, eran todos diestros y no fumadores, y predominantemente varones (60%). Sus características demográficas y de referencia se resumen en la Tabla 1.
EEG en estado de reposo
Los datos de EEG se recogieron con éxito en los cuatro sistemas probados. Como se esperaba, debido a los electrodos secos y al número limitado de canales, el tiempo de configuración fue considerablemente menor para los sistemas de EEG de consumo. Sin embargo, no se observaron diferencias en la tolerancia y aceptación de los sujetos en los cuatro sistemas.
Se recopilaron y evaluaron patrones de datos de EEG sin procesar en condiciones EO (Figura 2) y EC (Figura 3) de cada sistema. Muse y Mindwave eran más propensos a los artefactos debidos a los parpadeos de los ojos y al movimiento muscular en la región frontal con la apertura de los ojos (Figura 2).
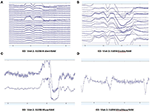
Figura 2. Extractos de datos brutos de OE de B-Alert (A) y Enobio (B) Muse (C) y MindWave (D) dentro del mismo participante durante la misma visita.
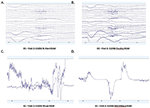
Figura 3. Extractos de datos brutos de CE de B-Alert (A) y Enobio (B) Muse (C) y MindWave (D) dentro del mismo participante durante la misma visita.
Comparación de las densidades espectrales de potencia (PSDs) del canal Fp1
Se calcularon las PSDs promedio en el canal Fp1 comunes a los cuatro sistemas de EEG para la Visita 1 y la Visita 2 y se trazaron para las condiciones de OE (Figuras 4A,B) y CE (Figuras 4C,D). En la condición EO, los espectros B-alert y Enobio fueron aproximadamente iguales, mientras que Mindwave aumentó ligeramente pero siguió una curva similar. Se observó un aumento de banda ancha en la potencia de las PSD adquiridas con el sistema Muse. Del mismo modo, en la condición EC (Figuras 4C,D), las PSD de B-Alert, Enobio y Mindwave fueron similares, sin embargo, se observó un aumento de la potencia de banda ancha para los espectros de Muse, que también parecían tener una mayor variación que los otros sistemas. En los espectros adquiridos con los sistemas B-Alert, Enobio y Mindwave se observaron picos a 8-12 Hz (banda alfa) en cada visita. Mientras que hubo un claro pico alfa para los espectros de potencia de Muse en la Visita 2, no se observó ningún pico en los espectros de la Visita 1.
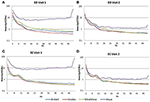
Figura 4. Densidades espectrales de potencia (PSD) de Fp1 de los cuatro sistemas de EEG en la condición EO en la Visita 1 (A) y en la Visita 2 (B) y en la condición EC en la Visita 1 (C) y en la Visita 2 (D).
Comparación de EEG en reposo del canal Fp1
En la condición EC, la relación espectral de potencia estaba entre 0,975 y 1,025 para B-Alert, Enobio y Mindwave (Figura 5A). Los ratios PSD del sistema Muse tuvieron más variación que los otros tres sistemas, con ratios entre 1,125 y 1,225. En la condición EO, parecía haber una variación ligeramente mayor para Enobio en las ondas lentas Delta (1-3 Hz), Theta (3-7 Hz) y alfa lenta (8-10) y para B-Alert y Mindwave en las ondas más rápidas Beta (13-30 Hz) y Gamma (25-40 Hz). Sin embargo, los ratios seguían estando entre 0,975 y 1,05. De forma similar a la condición EC, el test/retest para Muse tuvo una mayor variación, con ratios de hasta 1,2 (Figura 5B).
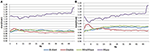
Figura 5. Coeficientes de prueba-retest para la condición EC (A) y EO (B).
Discusión
Este estudio comparó la señal cuantitativa del EEG y la fiabilidad de la prueba-retest de los sistemas de EEG médicos y de consumo con el fin de evaluar su posible aplicación en la investigación clínica y los ensayos clínicos. Se evaluaron los sistemas de EEG de consumo recientemente popularizados debido a su bajo coste, su amplia accesibilidad y su potencial para realizar estudios en casa en poblaciones difíciles. Entre las aplicaciones populares de los sistemas de EEG para consumidores se encuentran la meditación y el entrenamiento en relajación, así como el afrontamiento de la ansiedad o el dolor. Investigaciones recientes han explorado su utilidad más allá del juego: NeuroSky demostró ser capaz de detectar el inicio de la etapa 1 del sueño (Van Hal et al., 2014) y también ha habido interés en evaluar el EEG del consumidor dentro de las interfaces informáticas del cerebro (Bialas y Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). También se está explorando la aplicación de sistemas de EEG más sencillos (de 6 canales, por ejemplo) para entornos de emergencia (Jakab et al., 2014). Una evaluación anterior, aunque utilizó un auricular más complejo, mostró que los sistemas de EEG de consumo de varias derivaciones disponibles en el mercado, como el gorro de 16 electrodos Emotiv EPOC, también pueden tener valor para evaluar las condiciones clínicas (Schiff et al., 2016).
Este estudio proporcionó pruebas de que se pueden recopilar con éxito datos de EEG de bastante buena calidad a partir de EEG de consumo. Sin embargo, hubo distinciones en el aumento de la potencia, la repetición de la prueba y la forma del pico alfa observado a 8-13 Hz. Mindwave mostró en general espectros de potencia Fp1 similares a los de los sistemas médicos, con un ligero aumento de banda ancha sobre B-Alert y Enobio. Muse mostró un aumento de banda ancha en los espectros de potencia, que puede reflejar un artefacto en los datos adquiridos por un electrodo seco.
Los sistemas de EEG para consumidores mostraron una configuración significativamente más cómoda y rápida, que es óptima para su uso previsto en aplicaciones de entretenimiento y autoayuda. Sin embargo, la calidad de sus datos se vio afectada negativamente por la susceptibilidad a los artefactos asociada al electrodo seco. Como era de esperar, la calidad de los datos disminuyó especialmente durante la OE. La falta de capacidad para realizar pruebas de impedancia y la aplicación en la región frontal, que es particularmente propensa a los parpadeos y al movimiento muscular con la apertura de los ojos, también contribuyeron probablemente a este artefacto relativo. Además, la evaluación realizada por los sistemas de EEG de consumo es, por su naturaleza, limitada y confinada a la única región anatómica del cerebro cubierta por los pocos canales, lo que impide las evaluaciones de redes múltiples.
Los electrodos secos también pueden ser más propensos a provocar molestias con el paso del tiempo y suponen un mayor riesgo de colocación errónea en la frente, lo que conduce a una adquisición de la señal y una prueba/repetición inexactas. En comparación con los equipos de grado médico, la fiabilidad de la prueba/repetición fue menor en los sistemas de EEG de consumo. La fiabilidad se midió con una adquisición de prueba/reprueba para todos los sistemas (Figura 5). Mientras que B-Alert, Enobio y Mindwave se comportaron razonablemente bien, Muse tuvo una fiabilidad relativamente baja. Además, mientras que se demostró un claro pico alfa para Muse en la Visita 2 (Figura 4), la ausencia de un pico alfa en la Visita 1 sugiere una falta de consistencia que puede deberse a un artefacto. Las medidas fiables y consistentes de la actividad cerebral son cruciales en los ensayos clínicos a la hora de controlar la progresión de la enfermedad y evaluar la eficacia de una terapia experimental. Aunque los sistemas de consumo pueden ser útiles para una evaluación rápida cuando el tiempo es limitado, estas limitaciones del EEG de consumo podrían dificultar sus aplicaciones en entornos de investigación y ensayos clínicos, y se recomienda un sistema de grado médico con una alta fiabilidad de prueba-retest para su uso como punto final farmacodinámico en las evaluaciones clínicas.
En definitiva, la comparación de los sistemas de EEG médicos y de consumo en condiciones experimentales puso de manifiesto la diferenciación en el rendimiento y, en particular, las limitaciones específicas de uso que podrían dificultar las aplicaciones de los sistemas de consumo en entornos de investigación y ensayos clínicos. Por otro lado, los sistemas médicos multiplaza son menos idóneos para fines de entretenimiento que requieren una configuración rápida y un procesamiento de datos a partir de un número mínimo de electrodos. La principal limitación de este estudio reside en el pequeño tamaño de la población de estudio y la falta de aleatorización del orden de los sistemas utilizados para la adquisición. Los datos se adquirieron en el mismo orden de los sistemas para evitar los efectos de la hora de adquisición que pueden afectar al EEG debido a los ritmos circadianos. Sin embargo, las métricas de potencia del EEG han demostrado ser muy fiables y repetibles para los individuos cuando se utilizan sistemas de EEG estándar. Por este motivo, el tamaño de la muestra seleccionada se consideró informativo.
En conclusión, los datos de EEG se pueden recopilar con éxito a partir de los cuatro sistemas probados, incluidos los sistemas de EEG de consumo, con distintas limitaciones en cuanto a la capacidad de uso, la calidad de los datos y la fiabilidad que guían sus aplicaciones óptimas, incluso en entornos de ensayos clínicos. La susceptibilidad a los artefactos y la variabilidad en la fiabilidad de la prueba/repetición asociada a los sistemas de EEG de consumo actuales sugieren el uso de un sistema de EEG de grado médico para la recopilación de datos de EEG transversales y longitudinales clínicos robustos.
Contribuciones de los autores
ER y AV: participaron en la concepción y el diseño del proyecto, el análisis y la interpretación de los datos y la preparación del manuscrito. SW, CB y GR: participaron en la concepción y el diseño del proyecto, su ejecución, el análisis e interpretación de los datos y la preparación del manuscrito. Todos los autores han participado en la redacción, escritura y revisión del manuscrito y todos han leído y aprobado la versión final del manuscrito.
Financiación
Este estudio fue apoyado por Biogen.
Declaración de conflicto de intereses
ER y AV: empleados de Biogen. SW y CB: empleado de Advanced Brain Monitoring, Inc. GR: empleado de Neuroelectrics.
Agradecimientos
Deseamos agradecer a los participantes en el estudio su tiempo y sus contribuciones a este estudio. El equipo de Biogen participó en el diseño del estudio, el análisis y la interpretación de los datos, en la redacción del informe y en la decisión de presentar el artículo para su publicación.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Cortical sources of resting state electroencephalographic rhythms in Parkinson’s disease related dementia and Alzheimer’s disease. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., y Johnson, R. (2014). «Development of EEG biomarkers for Alzheimer’s disease» (Desarrollo de biomarcadores EEG para la enfermedad de Alzheimer), en GTC Biomarkers Summit (San Diego, CA).
Bialas, P., y Milanowski, P. (2014). Una interfaz de ordenador cerebral basada en el potencial evocado visualmente de alta frecuencia utilizando auriculares EEG de grado de consumidor. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). EEG cuantitativo y LORETA: ¿herramientas valiosas para discernir FTD de AD? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., y ChiehLee, T. (2015). La potencia de frecuencia y la coherencia de la electroencefalografía se correlacionan con la gravedad de la enfermedad de Alzheimer: un análisis multicéntrico en Taiwán. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Los marcadores cuantitativos del EEG se relacionan con la gravedad de la enfermedad de Alzheimer en el registro prospectivo de demencia de Austria (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). El pico de frecuencia dominante del EEG diferencia entre la enfermedad de Alzheimer y la degeneración lobar frontotemporal. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Novedoso sistema de electroencefalografía inalámbrica con un tiempo de preparación mínimo para su uso en emergencias y atención prehospitalaria. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., y Jo, S. (2015). Evaluación cuantitativa de una interfaz híbrida no invasiva de bajo coste basada en el EEG y el movimiento ocular. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibáñez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). «Deep networks using auto-encoders for PD prodromal analysis», en Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., y Loo, S. K. (2014). Uso del EEG para diagnosticar el TDAH. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., y Zanetti, O. (2011). El sustrato anatómico y los marcadores del EEG del cuero cabelludo están correlacionados en sujetos con deterioro cognitivo y enfermedad de Alzheimer. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Differences in quantitative EEG between frontotemporal dementia and Alzheimer’s disease as revealed by LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Investigación de la conectividad funcional del EEG en estado de reposo en la degeneración lobar frontotemporal. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., y Soria-Frisch, A. (2016). «EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients», en Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., y Jeanmonod, D. (2007). Alta coherencia theta talamocortical en pacientes con enfermedad de Parkinson. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Un sistema de registro electroencefalográfico de bajo costo y fácil de usar para la evaluación de la encefalopatía hepática. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., y Johnson, R. (2015). «A novel portable neurocognitive biomarker assessment for Parkinson’s Disease», en GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., y Stein, M. A. (2015). Integración de un biomarcador EEG con la evaluación clínica del TDAH. Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibáñez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). «Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG», en Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., y Claire Davies, T. (2017). Ya hemos llegado a la meta? Evaluación de la interfaz cerebro-ordenador de grado comercial para el control de aplicaciones informáticas por parte de individuos con parálisis cerebral. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., y Bossemeyer, R. (2014). Detección del sueño basada en EEG de bajo coste. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., y Verma, A. (2016). «Identificación de biomarcadores neurofisiológicos de MCI utilizando el estado de reposo, EEG», en Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar