- Introducción
- Métodos
- Sujetos y diseño
- Adquisición de la RM y evaluación del volumen estándar
- Preprocesamiento de imágenes
- Segmentación de tejidos por agrupación discriminatoria
- Estimación del volumen parcial
- Evaluación neuropsicológica
- Análisis estadístico
- Resultados
- Características de los sujetos
- Volúmenes parciales de la LMC y otros hallazgos de la RM
- Volúmenes parciales de LMC como predictores del rendimiento cognitivo
- Discusión
- Contribuciones de los autores
- Declaración de conflicto de intereses
- Agradecimientos
- Material complementario
- Abreviaturas
- Notas
Introducción
La enfermedad cerebral de pequeños vasos (EVP) es la causa más común de deterioro cognitivo vascular y demencia. Las lesiones de la sustancia blanca (WML) son el marcador principal de la SVD en las imágenes cerebrales, junto con los infartos lacunares, las microsangrías y la atrofia cerebral. Se ha demostrado que todos estos hallazgos influyen en el resultado clínico y cognitivo (Jokinen et al., 2011, 2012; Muller et al., 2011; Poels et al., 2012). El estudio Leukoaraiosis and Disability (LADIS), entre otros estudios, ha demostrado que la LMC está relacionada con el declive cognitivo, el deterioro de las capacidades funcionales, la depresión y las alteraciones de la marcha y el equilibrio (LADIS Study Group, 2011).
La resonancia magnética (RM) ha sido el método estándar en la evaluación de la LMC. A pesar de las importantes mejoras recientes en las técnicas de análisis cuantitativo de imágenes, uno de los principales obstáculos de la RM sigue siendo su resolución espacial finita, que da lugar a efectos de volumen parcial. Junto con el ruido y la falta de homogeneidad, plantea dificultades a las técnicas de segmentación cerebral. A menudo, se requiere un análisis cuidadoso de los límites entre los tejidos sanos y patológicos para delinear la extensión y la gravedad de las lesiones, aplicando un «umbral de decisión» implícito para la segmentación de la lesión. Además, las hiperintensidades en la RM parecen representar únicamente la fase final del proceso de la enfermedad. Un daño tisular más extendido puede estar asociado a la LMC, no visible en la RM de rutina (Schmidt et al., 2011). No existe un estándar para evaluar estas etapas tempranas del daño tisular, ya que sus valores de intensidad no se distinguen suficientemente de los de los tejidos normales.
La mayoría de los métodos modernos de segmentación se basan en información previa, como los atlas cerebrales promedio (Smith et al., 2004; Ashburner y Friston, 2005; Goebel et al., 2006) o el etiquetado manual (Wismüller et al., 2004; Lee et al., 2009; Cruz-Barbosa y Vellido, 2011). Recientemente, se ha propuesto un nuevo método basado en datos para la segmentación de tejidos, basado en una estrategia de clustering discriminativo (DC), en un enfoque de aprendizaje automático autosupervisado (Gonçalves et al., 2014). Este método reduce al mínimo el uso de información previa y utiliza datos de RM multiespectrales. A diferencia de otros métodos, que sólo se centran en los tejidos sanos (Pham y Prince, 1998; Van Leemput et al., 1999; Zhang et al., 2001; Manjón et al., 2010) o en tipos específicos de lesiones (Van Leemput et al., 2001; Zijdenbos et al., 2002; Styner et al., 2008; Cruz-Barbosa y Vellido, 2011), el DC permite el estudio de una amplia gama de tipos de tejidos normales y anormales. Otra gran ventaja del método propuesto es su capacidad para estimar las probabilidades tisulares de cada voxel, necesarias para una adecuada caracterización de la evolución de la LMC. Los voxeles se pueden clasificar como que contienen una proporción pequeña (todavía demasiado débil para ser claramente visible), intermedia o alta de WML. Los que contienen una pequeña proporción de lesión suelen estar fuera del «umbral de decisión» de la segmentación convencional, y apuntan a una LMC en fase temprana.
El objetivo del presente estudio es observar cómo los diferentes estadios de las lesiones se relacionan con el rendimiento cognitivo en una muestra de sujetos de edad avanzada con LMC de leve a moderada. Los datos utilizados consistieron en mediciones de resonancia magnética recogidas en un período de seguimiento de 3 años, y evaluaciones neuropsicológicas anuales dentro de ese período. En particular, estábamos interesados en determinar si incluso los pequeños volúmenes parciales de LMC en la etapa más temprana, en el tejido cerebral de apariencia normal, son capaces de predecir de forma independiente el futuro deterioro cognitivo, incrementando la carga de LMC evaluada convencionalmente.
Métodos
Sujetos y diseño
Los sujetos fueron un subgrupo de participantes (n = 78) de tres centros (Amsterdam n = 21, Graz n = 18, Helsinki n = 39) del estudio LADIS, un estudio multicéntrico europeo que investiga el impacto de la LMC relacionada con la edad en la transición de la independencia funcional a la discapacidad. El protocolo del LADIS y las características de la muestra se han descrito en detalle en otro lugar (Pantoni et al., 2005). En resumen, se inscribieron 639 sujetos en 11 centros de acuerdo con los siguientes criterios de inclusión (a) edad de 65 a 84 años, (b) LMC de leve a grave según la escala revisada de Fazekas (Pantoni et al., 2005), (c) ningún o mínimo deterioro en la escala de Actividades Instrumentales de la Vida Diaria (≤ 1 de 8 ítems comprometidos) (Lawton y Brody, 1969), y (d) presencia de un informante regularmente contactable. Los criterios de exclusión fueron: (a) enfermedad grave con probabilidad de abandono del seguimiento (insuficiencia cardíaca, hepática o renal, neoplasia u otra enfermedad sistémica relevante), (b) enfermedad neurológica grave no relacionada o trastorno psiquiátrico, (c) leucoencefalopatías de origen no vascular (inmunológico-desmielinizante, metabólico, tóxico, infeccioso), y (d) incapacidad o negativa a someterse a una RMN.
La evaluación inicial incluyó una resonancia magnética cerebral y evaluaciones médicas, funcionales y neuropsicológicas exhaustivas. Las evaluaciones clínicas se repitieron en intervalos de 12 meses en tres evaluaciones de seguimiento posteriores.
Para permitir una comparación válida entre sujetos/centros, las secuencias de RMN obtenidas en cada centro debían ser las mismas, y cada paciente debía disponer de tres secuencias, sin artefactos importantes. Los 78 sujetos incluidos en este estudio no diferían de la cohorte completa de LADIS en cuanto a la edad, el sexo, la puntuación inicial del Mini-Mental State Examination (MMSE) o el volumen de la LMC, pero tenían una educación significativamente mayor (9,3 frente a 11,7 años; t = -4,6, p < 0,001).
El estudio fue aprobado por los Comités de Ética de cada centro participante en el estudio LADIS (LADIS Study Group, 2011). Todos los sujetos recibieron y firmaron un consentimiento informado por escrito. Los colaboradores del estudio LADIS se enumeran en el Apéndice II.
Adquisición de la RM y evaluación del volumen estándar
Todas las exploraciones de RM axial utilizadas se adquirieron con un equipo de 1.5T, siguiendo el mismo protocolo en cada centro, incluyendo imágenes de transferencia de magnetización (TE = 10-14 ms, TR = 740-780 ms), imágenes de eco de espín rápido ponderadas en T2 (TE = 100-120 ms, TR = 4000-6000 ms), e imágenes de recuperación de inversión atenuada por fluidos (FLAIR) (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Todas las secuencias tenían un tamaño de voxel de 1 × 1 × 5-7,5 mm3, FOV = 250 y una separación entre cortes de 0,5 mm.
La extensión de las hiperintensidades en las regiones de la materia blanca, incluida la región infratentorial, se evaluó en imágenes FLAIR axiales con un análisis volumétrico semiautomatizado (VFLAIR) utilizando una estación de trabajo Sparc 5 (SUN) (van Straaten et al., 2006). Se marcaron las lesiones y se fijaron los bordes en cada corte mediante umbralización local (software de desarrollo propio Show_Images, versión 3.6.1). No se distinguió entre hiperintensidades subcorticales y periventriculares. No se tuvieron en cuenta las áreas de hiperintensidad en las imágenes ponderadas en T2 alrededor de los infartos y las lagunas. El número de lagunas se registró en la materia blanca y en la materia gris profunda utilizando una combinación de imágenes FLAIR, de eco gradiente de adquisición rápida preparada para la magnetización y T2 para distinguir las lagunas de los espacios perivasculares y las microhemorragias (Gouw et al., 2008). Además, la atrofia cerebral se clasificó según una escala de clasificación basada en una plantilla en imágenes FLAIR por separado en regiones corticales y subcorticales (Jokinen et al, 2012).
Preprocesamiento de imágenes
Para garantizar que la información multiespectral contenida en cada vóxel se originara exactamente en la misma ubicación en cada sujeto, se aplicó el registro intrapaciente para todas las secuencias disponibles, utilizando la caja de herramientas SPM5 (Friston, 2003), y aplicando una transformación afín con la imagen de menor resolución, típicamente FLAIR, como plantilla. Además, los vóxeles de tejido extra-meníngeo fueron enmascarados, utilizando un método automático estándar (BET2) (Smith et al., 2004).
Segmentación de tejidos por agrupación discriminatoria
Los recientes avances en las técnicas de aprendizaje automático han mostrado resultados competitivos en la segmentación de tejidos, superando a menudo las precisiones alcanzadas por los métodos clásicos de crecimiento de regiones o basados en umbrales (Styner et al., 2008). En particular, en comparación con la delineación manual, son más robustos y menos subjetivos. El método de segmentación de tejidos utilizado en este estudio fue una técnica de aprendizaje automático de este tipo, basada en una metodología autosupervisada impulsada por datos, arraigada en una estrategia de CC (Gonçalves et al., 2014). De forma similar a los algoritmos de agrupación no supervisada, como los vecinos más cercanos, el DC agrupa los datos de entrada de acuerdo con su información distributiva multidimensional de nivel de gris. En el presente estudio, esas distribuciones eran tridimensionales, que corresponden al número total de secuencias utilizadas. La principal ventaja de DC es su capacidad de utilizar un pequeño conjunto de información etiquetada para apoyar la asignación de la agrupación. Esta característica conduce a una clara mejora de los resultados de la segmentación, más allá de las técnicas tradicionales de clustering (Gonçalves et al., 2014).
El objetivo general de DC se puede resumir entonces como la partición del espacio de datos en regiones agrupadas con distribuciones bastante uniformes en todo, y la información de la etiqueta consistente para todos los vóxeles que pertenecen a cada clúster. En el Apéndice I se ofrece una explicación más detallada, con la descripción matemática completa presentada en Gonçalves et al. (2014).
Estimación del volumen parcial
DC da la probabilidad de pertenencia de cada vóxel a todas las clases de tejido, lo que permite la estimación de la información del volumen parcial. Dado que pretendíamos centrar nuestro estudio en los vóxeles lesionados, sólo analizamos aquellos en los que la proporción de tejido lesionado presente es relevante.
En este estudio, se identificaron tres categorías de lesión diferentes, lo que condujo a una cantidad correspondiente de estimación de volumen: el volumen de los vóxeles que tienen una probabilidad ALTA (VDC100), INTERMEDIA (VDC66) o PEQUEÑA (VDC33) de ser lesión. VDC100 y VDC66 son los volúmenes en los que el tejido principal de los vóxeles en ellos, tiene una probabilidad de ser lesión de >66% y < 66%, respectivamente. Dado que ambos volúmenes VDC100 y VDC66 contienen una mayoría de tejido lesional, VFLAIR1 puede aproximarse mediante la suma VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. Por lo tanto, utilizando la CC, la mejor estimación posible del volumen de la lesión visible se obtiene mediante VDCHARD. La última categoría, VDC33, corresponde al volumen de vóxeles donde la lesión es el segundo tipo de tejido más probable, con probabilidades ≥ 33%. Nótese que, este volumen no se considera como lesión en los métodos de segmentación normales, como el que estima el VFLAIR, ya que la lesión nunca es el principal tipo de tejido en el mismo.
La capacidad del presente método de segmentación para detectar lesiones en etapas tempranas se verificó en un subgrupo de pacientes (n = 19) con datos de resonancia magnética de seguimiento, c.f. Materiales suplementarios: Apéndice I). Allí demostramos que los pequeños volúmenes parciales de LMC indican posibles localizaciones futuras de lesiones completamente desarrolladas.
Evaluación neuropsicológica
La batería de pruebas cognitivas del estudio LADIS incluía el MMSE (Folstein et al., 1975), la Escala de Evaluación de la Demencia Vascular-Subescala Cognitiva (VADAS) (Ferris, 2003), el test de Stroop (MacLeod, 1991) y el test de creación de rastros (Reitan, 1958). Para el presente propósito, utilizamos las puntuaciones totales del MMSE y del VADAS como medidas globales de la función cognitiva. Además, se constituyeron tres medidas compuestas psicométricamente robustas para la evaluación de dominios cognitivos específicos utilizando las puntuaciones estándar promediadas de las subpruebas individuales, como se describió anteriormente (Moleiro et al., 2013) (1) velocidad y control motor = puntuaciones z (Trail making A + laberinto + cancelación de dígitos)/3; (2) funciones ejecutivas = puntuaciones z de /4; y (3) memoria = puntuaciones z (recuerdo inmediato de palabras + recuerdo diferido + reconocimiento de palabras + span de dígitos)/4.
La proporción de valores perdidos en las variables de las pruebas neuropsicológicas varió entre el 0 y el 6,4% al inicio, y entre el 24,4 y el 32,1% en la última evaluación de seguimiento. Esta pérdida de datos se debió a la muerte de los sujetos (n = 2), al abandono de las evaluaciones neuropsicológicas de seguimiento (visita del último año, n = 17), o a la incapacidad de completar toda la batería de pruebas (n = 6).
Análisis estadístico
Los predictores del rendimiento cognitivo longitudinal se analizaron mediante modelos lineales mixtos (estimación de máxima verosimilitud restringida), que son capaces de tratar con valores perdidos y estructuras de covarianza complejas. El año de evaluación (línea de base, primero, segundo y tercero) se utilizó como una variable intra-sujeto, y se adoptó una estructura de covarianza no estructurada. Las puntuaciones de las pruebas cognitivas se establecieron como variables dependientes. Los volúmenes de las lesiones parciales (VDC33, VDC66 y VDC100) se probaron como predictores, uno por uno. En todos los modelos se utilizaron como covariables la edad, el sexo y los años de educación. Los modelos se repitieron añadiendo la VFLAIR como otra covariable, para averiguar el valor predictivo de las mediciones parciales de volumen incrementales a las del volumen del LMC evaluado convencionalmente. Del mismo modo, se añadió el centro de estudio como posible factor de confusión, pero como no tuvo un efecto esencial en los resultados, se dejó fuera de los análisis finales. Debido a que las distribuciones sesgadas podían comprometer el supuesto de linealidad de los modelos de mezcla, se aplicó una transformación logarítmica a las tres mediciones de volumen parcial y a la VFLAIR. Los resultados se analizaron con el módulo mixto de IBM SPSS Statistics 22. La significación estadística se fijó en p < 0,05 para todos los análisis.
Resultados
Características de los sujetos
Las características de los sujetos al inicio del estudio se indican en la tabla 1. Según la escala revisada de Fazekas, 28 (35,9%) sujetos tenían una LMC leve, 26 (33,3%) moderada y 24 (30,8%) grave.

Tabla 1. Características basales de los sujetos, n = 78.
Volúmenes parciales de la LMC y otros hallazgos de la RM
La tabla 1 muestra los volúmenes obtenidos por el método de segmentación convencional, los volúmenes parciales de la lesión estimados por DC, y el coeficiente de similitud de Dice comparando ambos métodos de segmentación. La figura 1 presenta una comparación entre la imagen FLAIR original (1A), el volumen de hiperintensidad estimado convencionalmente, VFLAIR (1B), y los resultados obtenidos para los volúmenes parciales de LMC VDC100 (1C), VDC66 (1D), y VDC33 (1E). Los fotogramas 1F-1J muestran las imágenes correspondientes en la zona ampliada denotada por el rectángulo blanco del fotograma 1A. En los fotogramas 1H-J se puede observar la evolución en torno a los focos de lesión, desde la explosión total en el centro hasta la fase intermedia y la pequeña proporción de lesión en los bordes. Obsérvese que los vóxeles clasificados como VDC33 no están incluidos en el VFLAIR, pero son indicativos de posibles localizaciones de futuras lesiones. La figura 2 muestra hallazgos similares en un nivel superior, el centrum semiovale. El procedimiento de segmentación de CC utilizó tres secuencias diferentes (FLAIR, T2, T1). Aquí, sólo se muestra FLAIR con fines ilustrativos.
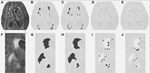
Figura 1. Lesiones de la sustancia blanca (WML) a una altura de nivel medio. (A) Imagen FLAIR para un sujeto determinado. (B) LMC estimada convencionalmente. (C-E) LMC estimada, utilizando el algoritmo de segmentación propuesto, para la proporción completa, intermedia y pequeña de la lesión. (F-J) Imágenes similares para la parte ampliada representada por el cuadro blanco en (A).
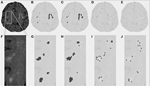
Figura 2. Lesiones de la sustancia blanca (WML) en el centrum semiovale. (A) Imagen FLAIR para un sujeto determinado. (B) Estimación convencional de la LMC. (C-E) Estimación de la LMC utilizando el algoritmo de segmentación propuesto, para la proporción completa, intermedia y pequeña de la lesión. (F-J) Imágenes similares para la parte ampliada representada por el recuadro blanco en (A).
Para todo el conjunto de datos utilizado, las tres medidas parciales del volumen del WML se correlacionaron significativamente entre sí: VDC33*VDC66 r = 0,87; VDC33*VDC100 r = 0,47; VDC66*VDC100 r = 0,47 (p < 0,001). También se correlacionaron significativamente con VFLAIR: VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023), y VDC100 r = 0,87 (p < 0,001), respectivamente. Sin embargo, las medidas no se asociaron significativamente con la presencia de infartos lacunares (ninguno/pocos/muchos) o la puntuación de atrofia cerebral global (cortical y subcortical) (p > 0,05).
La Figura 3 identifica las segmentaciones compartidas y dispares entre la segmentación convencional (VFLAIR), y la DC (VDCHARD) para el sujeto de la Figura 1. Hay un claro solapamiento entre las dos segmentaciones, como muestra el gran número de píxeles verdes. Para el sujeto mostrado en esa figura, hay una pequeña diferencia entre VFLAIR y VDCHARD.
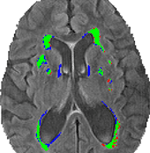
Figura 3. Comparación de los métodos de segmentación. Esta imagen muestra la segmentación obtenida mediante el análisis volumétrico semiautomático (VFLAIR) y el clustering discriminativo (VDCHARD) para el sujeto de la Figura 1. Las regiones representadas en verde corresponden a la segmentación superpuesta entre ambos enfoques. En rojo se muestran las regiones clasificadas como lesión sólo por el método convencional, mientras que el azul corresponde al voxel clasificado como lesión sólo por el DC.
La estimación de la clasificación del tejido completo de un sujeto, utilizando el DC en un PC con CPU Intel® Core™ i5-4590@ 3,30 GHz con 16 GB de RAM, llevó unos 25 min. La estimación de las etiquetas, en dicho ordenador, tardó unos 70 min. Una mejora de esta última estimación debería agilizar el procedimiento de forma significativa.
Volúmenes parciales de LMC como predictores del rendimiento cognitivo
Las relaciones entre los volúmenes parciales de LMC y el rendimiento cognitivo longitudinal se resumen en la Tabla 2. Los modelos lineales mixtos ajustados por edad, sexo y educación mostraron asociaciones negativas significativas entre el VDC33 y la puntuación compuesta para las funciones ejecutivas. En primer lugar, el VDC33 se asoció con un efecto principal significativo en el nivel general de rendimiento ejecutivo (puntuaciones en promedio en las cuatro evaluaciones temporales). En segundo lugar, la interacción entre la VDC33 y el tiempo (año de evaluación) indicó un valor predictivo significativo de la VDC33 sobre el cambio en el rendimiento ejecutivo durante los 3 años de seguimiento. Específicamente, una mayor carga de VDC33 se relacionó con un peor rendimiento en la línea de base y un declive más pronunciado en las funciones ejecutivas en cada año de evaluación posterior. Después de ajustar adicionalmente el VFLAIR, estos resultados se mantuvieron sin cambios. Además, hubo una débil asociación en la línea de base entre el VDC33 y la puntuación total de VADAS, pero este resultado dejó de ser significativo después de controlar el VFLAIR.El VDC33 no tuvo efectos principales significativos ni interacciones con el tiempo en el MMSE, el VADAS, la velocidad de procesamiento o las funciones de memoria.
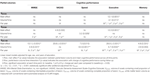
Tabla 2. Relación entre los volúmenes de las lesiones parciales de la sustancia blanca y el rendimiento cognitivo en el seguimiento de 3 años.
El VDC66 se relacionó con efectos principales significativos que indicaban un peor nivel general de rendimiento en las VADAS y las funciones ejecutivas. La interacción entre el VDC66 y el tiempo fue significativa sólo para la velocidad de procesamiento. La inspección de los resultados en puntos temporales individuales mostró una asociación significativa en la línea de base (VADAS, funciones ejecutivas) así como un cambio longitudinal en el primer (VADAS, funciones ejecutivas), segundo (MMSE, funciones ejecutivas) y tercer (funciones ejecutivas) año de seguimiento. El control del VFLAIR tuvo un efecto mínimo sobre estos resultados (Tabla 2).
Por último, el VDC100 se asoció con efectos principales significativos en todas las puntuaciones neuropsicológicas. Las interacciones VDC100* tiempo indicaron una relación significativa con el cambio durante el seguimiento en cuatro de las cinco medidas cognitivas. En esta etapa, las lesiones se asociaron sistemáticamente con el rendimiento cognitivo ya en la línea de base. Además, se evidenció un descenso más pronunciado del rendimiento desde la primera hasta la última evaluación de seguimiento, con cierta variación en las diferentes medidas cognitivas. La mayoría de estos resultados se mantuvieron incluso después de controlar adicionalmente el VFLAIR a pesar de su alta correlación con el VDC100 (Tabla 2).
A pesar del VDC33 y el VDC66, el VFLAIR siguió siendo un predictor significativo del rendimiento general durante el período de seguimiento en las VADAS y las funciones ejecutivas. Sin embargo, VFLAIR no tuvo un valor predictivo independiente incremental al de VDC100 en ninguna de las medidas cognitivas.
Discusión
Este estudio examinó el impacto cognitivo longitudinal de la LMC parcial, desde los cambios más tenues en la materia blanca de apariencia normal hasta las lesiones completamente desarrolladas. La investigación utilizó un novedoso método de segmentación tisular multiespectral de IRM autosupervisado basado en DC (Gonçalves et al., 2014) y evaluaciones neuropsicológicas repetidas anualmente en un seguimiento de 3 años. Se identificaron diferentes tipos de tejidos utilizando simultáneamente todas las secuencias de RM disponibles. A continuación, se categorizó la LMC según los volúmenes parciales como lesión pequeña, intermedia y completa.
A diferencia de la segmentación manual convencional del tejido, en la que la decisión se basa en un umbral de nivel de gris implícito, el método propuesto da acceso a la información «por debajo del umbral» relativa a las lesiones. Esto permite una mejor evaluación de la progresión de la lesión (información cualitativa), así como la volumetría de sub-voxel (información cuantitativa). Existen otros métodos que proporcionan información sobre las proporciones del tejido (Van Leemput et al., 2003; Manjón et al., 2010). Sin embargo, utilizan ciertos prejuicios que los hacen inadecuados para la detección de la LMC, como la suposición de que un vóxel no puede contener más de dos tipos de tejido.
El principal hallazgo del presente estudio fue que incluso el volumen parcial más pequeño de la LMC, el VDC33, se asoció significativamente con un peor rendimiento ejecutivo ya en la línea de base y predijo el futuro declive de las funciones ejecutivas durante el seguimiento de 3 años. Este efecto fue independiente de los factores demográficos y, en particular, también del volumen de hiperintensidad evaluado convencionalmente en las imágenes FLAIR. En un subgrupo de sujetos, demostramos además que las VDC33 probablemente representan los cambios más tempranos en la materia blanca de apariencia normal, ya que su detección, en la línea de base, indicaba las futuras localizaciones de las lesiones completamente desarrolladas tras el seguimiento (Apéndice I).
Las lesiones de fase intermedia, VDC66, se asociaron de forma independiente con un declive cognitivo más extenso, incluyendo cambios en la velocidad de procesamiento y en las funciones ejecutivas, así como en las funciones cognitivas globales. Además, las lesiones en estadio completo, VDC100, se relacionaron con efectos aún más pronunciados que se extendían a todos los dominios cognitivos evaluados, tanto en la línea de base como en el seguimiento. No es sorprendente que la VDC100 sea un fuerte predictor del deterioro cognitivo. Dado que el VDC100 estaba altamente correlacionado con el VFLAIR, que ha mostrado previamente una fuerte asociación con el cambio cognitivo (Jokinen et al., 2011; Kooistra et al., 2014), debería tener un poder predictivo bastante similar.
El resultado novedoso y más importante de la presente investigación es que el volumen de las lesiones detectadas por debajo del umbral de decisión ya permite predecir puntuaciones cognitivas concretas. Los primeros signos de deterioro cognitivo se encontraron específicamente en las funciones ejecutivas, que se supone que dependen esencialmente de la integridad de las conexiones prefrontales-subcorticales de la sustancia blanca (O’sullivan et al., 2001), Las funciones ejecutivas incluyen procesos de control cognitivo como la flexibilidad mental, la inhibición y la planificación relacionada con el comportamiento complejo dirigido a objetivos. Estas funciones son cruciales para las capacidades funcionales de un individuo en la vida cotidiana (Tomaszewski Farias et al., 2009).
Los resultados presentados en este artículo apoyan la hipótesis de que las hiperintensidades de la LMC sólo representan «una punta del iceberg», mientras que, de hecho, el daño de la sustancia blanca en la SVD evoluciona como un proceso gradual que afecta a áreas más amplias del cerebro (Schmidt et al., 2011; Maillard et al., 2013). Los estudios de imágenes de difusión han demostrado que los cambios microestructurales sutiles, incluso en el tejido cerebral de apariencia normal, están relacionados con el deterioro cognitivo y predicen un mal resultado cognitivo y clínico en el seguimiento (Schmidt et al., 2010; Jokinen et al., 2013). La integridad microestructural está particularmente reducida en la proximidad de la HM, como se muestra en la anisotropía fraccional (Maillard et al., 2011). Este fenómeno denominado «penumbra de WMH» puede estar relacionado con los volúmenes de WML parciales en fase temprana observados en nuestro estudio. Sin embargo, los inicios de la lesión también pueden ocurrir a cierta distancia de la LMM completamente desarrollada, como se ilustra en detalle en el Apéndice I. Hasta donde sabemos, la relación de estos cambios focales subliminales con el resultado cognitivo no se ha mostrado antes.
La presente muestra consiste en un grupo mixto de sujetos de edad avanzada, igualmente estratificados a todos los grados de severidad de la LMC, de leve a grave. Los participantes fueron reclutados en diferentes entornos, sobre la base de variados motivos de derivación, representando la diversidad de pacientes con LMC encontrados en la práctica clínica (LADIS Study Group, 2011). Esta heterogeneidad de los sujetos puede, sin embargo, oscurecer los efectos más sutiles entre los hallazgos de imágenes y el deterioro cognitivo. Como es habitual en los estudios longitudinales sobre el envejecimiento y las enfermedades cerebrovasculares, se perdieron algunos datos debido a que los sujetos abandonaron el seguimiento o no pudieron completar todas las evaluaciones.
Como limitación, el protocolo de imágenes del LADIS no se diseñó inicialmente para el presente método de segmentación cuantitativa, por lo que solo se pudo utilizar una parte de los datos de imágenes originales. Además, el ruido de la imagen, la resolución y los artefactos de movimiento son factores que pueden influir en el resultado de un estudio multicéntrico como el presentado aquí. Esto es especialmente cierto cuando se trata de efectos de volumen parcial. A pesar de estas limitaciones, y tras corregir algunos de los factores de confusión mencionados, pudimos detectar indicios sutiles de progresión de la lesión, basándonos en vóxeles con una pequeña probabilidad de ser lesión.
Para mejorar la fiabilidad de los resultados mostrados en este manuscrito, se podría haber considerado una cohorte mayor. Debido a las preocupaciones con respecto a la consistencia entre los centros, y los cambios en las configuraciones de imágenes en diferentes momentos, se debe utilizar una política más estricta con respecto a las secuencias de resonancia magnética empleadas.
Los puntos fuertes de este estudio incluyen un método de análisis de imágenes novedoso, robusto, auto-supervisado y basado en datos que permite la identificación de los tipos de tejido, y la cuantificación de los cambios cerebrales patológicos, en una etapa muy temprana, donde la evaluación de resonancia magnética convencional no sería útil. El estudio también se beneficia de evaluaciones neuropsicológicas detalladas, realizadas a intervalos anuales en un seguimiento de 3 años.
En conclusión, los cambios tempranos en la materia blanca de apariencia normal ya dan una pista del deterioro progresivo y del mal resultado cognitivo. En esta etapa, las funciones ejecutivas se ven afectadas principalmente, pero el efecto perjudicial sobre la cognición se vuelve más global cuando los cambios se convierten gradualmente en una LMC completa, eventualmente detectable también en la segmentación tisular de la RMN convencional. Estos resultados afirman el método de segmentación tisular por RMN multiespectral propuesto como una herramienta prometedora que tiene un valor aditivo en el reconocimiento del riesgo de SVD y el deterioro cognitivo progresivo clínicamente significativo.
Contribuciones de los autores
Todos los autores han realizado revisiones críticas del manuscrito por contenido intelectual importante. Además de eso, el trabajo más central de cada autor para el estudio fue el siguiente: HJ; Investigador responsable y autor correspondiente, diseño y conceptualización del estudio, adquisición de datos neuropsicológicos y clínicos, análisis estadístico e interpretación, redacción y acabado del manuscrito. NG; Investigador responsable, diseño y conceptualización del estudio, desarrollo del método de segmentación de la RM, análisis de los datos de la RM, redacción y finalización del manuscrito. RV: Desarrollo del método de segmentación de la RM, análisis de los datos de la RM, diseño y conceptualización del estudio. JL; Experiencia en el análisis estadístico y la interpretación. FF; Diseño del estudio LADIS, responsable de los métodos de RMN. RS; Diseño del estudio LADIS, responsable de los métodos de RMN. FB; Diseño del estudio LADIS, responsable de los métodos de RMN. SM; Construcción de la batería de pruebas neuropsicológicas, adquisición de datos neuropsicológicos y clínicos. AV; Adquisición de datos neuropsicológicos y clínicos. DI; Coordinador del estudio, miembro del comité directivo de LADIS, diseño del estudio LADIS. LP; Coordinación y diseño del estudio LADIS. TE; Miembro del comité directivo de LADIS, diseño del estudio LADIS, conceptualización y diseño del estudio. HJ y NG contribuyeron a partes iguales a este trabajo.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
El Estudio de Leucoaraiosis y Discapacidad fue apoyado por la Unión Europea (subvención QLRT-2000-00446). El trabajo de HJ fue apoyado por subvenciones del Instituto de Investigación Clínica y el Fondo de Investigación Médica del Hospital Central de la Universidad de Helsinki, y la Fundación Ella y Georg Ehrnrooth. NG fue financiado por la subvención número SFRH/BD/36178/2007 de la Fundação para a Ciência e Tecnologia.
Material complementario
El material complementario de este artículo puede encontrarse en línea en: https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Abreviaturas
DC, agrupación discriminativa; FLAIR, recuperación de inversión atenuada por fluidos; LADIS, Estudio de Leucoaraiosis y Discapacidad; MMSE, Mini-Mental State Examination; MRI, resonancia magnética; SVD, enfermedad de pequeños vasos; VADAS, Escala de Evaluación de Demencia Vascular-Subescala Cognitiva; VDC33, volumen de vóxeles que contienen una pequeña proporción de la lesión; VDC66, volumen de vóxeles que contienen una proporción intermedia de la lesión; VDC100, volumen de vóxeles que contienen una proporción completa de la lesión; VDCHARD = VDC100 + VDC66; VFLAIR, volumen de WML medido con el análisis semiautomático convencional en imágenes FLAIR; WML, lesión de sustancia blanca.
Notas
1. ^VFLAIR, volumen correspondiente a la WML medido con el análisis semiautomático convencional en imágenes FLAIR.
2. ^VDCHARD, volumen correspondiente a los vóxeles en los que la mayoría del tejido es una lesión.
Ashburner, J., y Friston, K. J. (2005). Segmentación unificada. Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., y Vellido, A. (2011). Análisis semisupervisado de tumores cerebrales humanos a partir de información MRS parcialmente etiquetada utilizando modelos de aprendizaje múltiple. Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). Medidas generales de la cognición. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini-mental state. a practical method for grading the cognitive state of patients for the clinician. J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). «Statistical parameter mapping. a practical guide», en Neuroscience Databases, ed R. Kötter (New York, NY: Springer), 237-250. Disponible en línea en: http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., y Formisano, E. (2006). Análisis de datos de concursos de análisis de imágenes funcionales con brainvoyager QX: desde un solo sujeto hasta el análisis de modelos lineales generales de grupos alineados corticalmente y el análisis de componentes independientes de grupos autoorganizados. Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., and Vigário, R. (2014). Segmentación autosupervisada de tejidos por resonancia magnética mediante clustering discriminativo. Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. (2008). Progression of white matter hyperintensities and incidence of new lacunes over a 3-year period: the Leukoaraiosis and Disability study. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. (2011). Las lagunas incidentes influyen en el deterioro cognitivo: el estudio LADIS. Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. (2012). Brain atrophy accelerates cognitive decline in cerebral small vessel disease: the LADIS study. Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. (2013). Los cambios de difusión predicen el resultado cognitivo y funcional: el estudio LADIS. Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Vascular brain lesions, brain atrophy, and cognitive decline. the second manifestations of arterial disease-magnetic resonance (SMART-MR) study. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011: una década del estudio LADIS (Leukoaraiosis And DISability): ¿qué hemos aprendido sobre los cambios en la sustancia blanca y la enfermedad de los vasos pequeños? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., y Brody, E. M. (1969). Evaluación de las personas mayores: actividades de la vida diaria autosuficientes e instrumentales. Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). MR image segmentation using a power transformation approach. IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Half a century of research on the stroop effect: an integrative review. Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. (2013). Las señales de FLAIR y de difusión MRI son predictores independientes de las hiperintensidades de la materia blanca. Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. (2011). Penumbra de hiperintensidad de la materia blanca. Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., y Robles, M. (2010). Improved estimates of partial volume coefficients from noisy brain MRI using spatial context. Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. (2013). Análisis factorial confirmatorio de la batería de evaluación neuropsicológica del estudio LADIS: un análisis longitudinal. J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., y Geerlings, M. I. (2011). Atrofia cerebral y cognición: ¿interacción con la patología cerebrovascular? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., y Markus, H. S. (2001). Evidence for cortical «disconnection» as a mechanism of age-related cognitive decline. Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. (2005). Impact of age-related cerebral white matter changes on the transition to disability-the LADIS study: rationale, design and methodology. Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., y Prince, J. L. (1998). Estimación de volúmenes parciales y el algoritmo fuzzy C-means. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Cerebral microbleeds are associated with worse cognitive function: the rotterdam scan study. Neurology 78, 326-333. doi: 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). Validez del test de elaboración de rastros como indicador de daño cerebral orgánico. Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. (2010). Diffusion-weighted imaging and cognition in the leukoariosis and disability in the elderly study. Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract |Ref Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. (2011). Heterogeneidad en los cambios de la materia blanca relacionados con la edad. Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. (2008). «3D segmentation in the clinic: a grand challenge II: MS lesion segmentation», MIDAS Journal, MICCAI 2008 Workshop. Disponible en línea en: http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). Longitudinal changes in memory and executive functioning are associated with longitudinal change in instrumental activities of daily living in older adults. Clin. Neuropsychol. 23, 446-461. doi: 10.1080/138540802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (1999). Automated model-based tissue classification of MR images of the brain. IEEE Trans. Med. Imaging 18, 897-908. doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., and Suetens, P. (2001). Automated segmentation of multiple sclerosis lesions by model outlier detection. IEEE Trans. Med. Imaging 20, 677-688. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). A unifying framework for partial volume segmentation of brain MR images. IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). Impact of white matter hyperintensities scoring method on correlations with clinical data: the LADIS study. Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., and Ritter, H. (2004). Fully automated biomedical image segmentation by self-organized model adaptation. Neural Netw. 17, 1327. doi: 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., y Smith, S. (2001). Segmentación de imágenes de RM cerebral mediante un modelo de campo aleatorio de Markov oculto y el algoritmo de maximización de expectativas. IEEE Trans. Med. Imaging 20, 45-57. doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., y Evans, A. C. (2002). Automatic pipeline analysis of 3-D MRI data for clinical trials: application to multiple sclerosis. IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar