- Antecedentes e introducción
- Presentación del caso
- Discusión
- Patofisiología de la IDA
- Búsqueda bibliográfica
- Causas de la IDA
- Presentación clínica de la IDA
- Complicaciones asociadas a la IDA
- Enfoques de manejo de la IDA
- Conclusión
- Disponibilidad de los datos
- Declaración ética
- Consentimiento para participar
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
Antecedentes e introducción
La diabetes insípida adípica (DIA) hipotalámica, un síndrome raro con una presentación clínica heterogénea, se caracteriza por una congregación de defectos en los mecanismos homeostáticos del equilibrio hídrico. Estos incluyen el mecanismo de osmorregulación de la sed, la secreción de arginina-vasopresina y la capacidad renal para concentrar la orina. Se han descrito menos de cien casos graves en todo el mundo durante las últimas cuatro décadas (1).
El tratamiento de estos pacientes es extremadamente difícil, ya que tienden a sufrir grandes oscilaciones de sodio en plasma, incluso cuando la DI está bien controlada (2).
Informamos de un caso de IDA grave que se produjo en el postoperatorio de una cirugía de malformación arteriovenosa (MAV) cerebral. Describimos la posible patogénesis en este caso y revisamos la literatura de todos los casos notificados de forma similar y describimos los posibles mecanismos implicados, la presentación clínica, el manejo tanto agudo como crónico y el pronóstico.
Presentación del caso
Una señora de 27 años de edad presentó una hemorragia intracerebral frontal izquierda con extensión intraventricular secundaria a un complejo de ganglios basales de gran tamaño (MAV) con alimentadores arteriales complejos desde las arterias cerebrales medias (ACM) izquierdas, y las arterias cerebrales anteriores (ACA) con una escala de clasificación de Spetzler Martin de 3 (3).
Tras la recuperación inicial de la craneotomía descompresiva y la cirugía de evacuación del coágulo, se sometió a una cirugía electiva de escisión de la MAV ~2 semanas después. Durante la cirugía de la MAV, los cirujanos informaron de una fuerte hemorragia de los vasos alimentadores (la ACM, la ACA y los vasos coroideos) con una grave hemorragia intracerebral y hemorragia intraventricular que requirió una transfusión masiva de sangre de hasta 32 unidades intraoperatorias. Se le puso en coma inducido con barbitúricos e hipotensión inducida para minimizar el edema cerebral (4).
Empezó a tener poliuria con grandes volúmenes de orina intraoperatoria poco después del episodio de hemorragia intraoperatoria profusa. Aunque en el preoperatorio sus concentraciones de sodio eran normales, las concentraciones de sodio fueron más altas inmediatamente (en la primera hora) en el postoperatorio dentro del rango de 151-160 mmol/L en tándem con una osmolalidad urinaria baja <130 mosm/L. Se consideró una DI transitoria y se comenzó a administrar desmopresina intravenosa (desmopresina IV) 1 mcg que se administró diariamente junto con una infusión de suero salino de 3,5-4 L durante 3 días consecutivos.
Sin embargo, desde que desarrolló un edema pulmonar (probablemente una consecuencia de la transfusión masiva de sangre intraoperatoria, los fluidos hipotónicos intravenosos y la desmopresina IV concurrente) en el día postoperatorio 4, se suspendió la desmopresina IV y se administró plasma fresco congelado y diuréticos (furosemida intravenosa 40 mg) para reducir el edema extravascular. En la hora siguiente, comenzó a desarrollar de nuevo poliuria con una diuresis de 800 mL en una sola hora y sus concentraciones de sodio subieron hasta 172 mmol/L. En vista del edema cerebral postoperatorio concomitante, se decidió bajar las concentraciones de sodio de forma dirigida, de manera que la tasa de disminución de sodio se mantuviera dentro de 5-10 mmol/L/día, con un nivel objetivo de 155 mmol/L. Se administró una dosis baja de desmopresina IV de 0,25 mcg, y se sugirió un régimen de titulación con vistas a mantener una producción de orina por hora inferior a 100 mL/h. Necesitó desmopresina IV 0,75 mcg en el día postoperatorio 5, y luego IV 0,25 mcg dos veces al día en el día 6 cuando alcanzó un nivel objetivo de 155 mmol/L. Esta concentración de sodio pudo mantenerse con la dosis de desmopresina durante otros 2 días.
El día 9, en el postoperatorio, se suspendió la desmopresina, ya que era capaz de mantener una baja producción de orina sin desmopresina, y las concentraciones de sodio eran estables. En esta fase, se consideró que había desarrollado un síndrome de secreción inapropiada de hormonas antidiuréticas (SIADH) y se restringieron los líquidos a 1 L/día. Sus concentraciones de sodio se mantuvieron estables en 134-138 mmol/L durante esta semana.
En el día postoperatorio 14, volvió a desarrollar poliuria con aumento de las concentraciones de sodio y de la osmolalidad sérica. En este momento se reanudó la desmopresina IV a 0,25 mcg dos veces al día. Las concentraciones de sodio pudieron mantenerse en 138-150 mmol/L con desmopresina IV (0,25 mcg dos veces al día) y líquidos. Había pasado por una fase trifásica con un periodo de DI transitoria, seguido de SIADH, y posterior DI permanente (ver Figura 1). Los niveles séricos de cortisol, hormona de crecimiento, factor de crecimiento similar a la insulina-1, función tiroidea y prolactina estaban dentro de los límites normales.

Figura 1. Gráfico que muestra todas las mediciones seriadas en nuestra paciente a lo largo de la hospitalización.
Después de la inserción de una derivación ventriculoperitoneal (realizada para mantener la presión intracraneal) 6 semanas después de la escisión de la MAV, fue trasladada a las salas de rehabilitación y el régimen de desmopresina intravenosa se convirtió en un régimen subcutáneo (SC) (véase la figura 1). Cuando se suspendió la alimentación por sonda nasogástrica, se intentó regular los líquidos por sed. Los análisis de sangre mostraron un aumento de los niveles de sodio hasta 165 mmol/L y ella no sintió sed durante este período de hipernatremia a pesar de una osmolalidad sérica de 350 mosm/kg. Seguía siendo adípica a pesar de la recuperación de la afasia. No se utilizó una escala de sed ya que, al preguntarle, verbalizó que no sentía sed en absoluto, y no se pudo aplicar una escala de sed. Por lo tanto, hubo que regular los líquidos para mantener el equilibrio de sodio. Su producción de orina era fija y su equilibrio de sodio estaba bien regulado con un régimen de desmopresina 0,5 mcg por la mañana y 0,375 mcg por la noche, con líquidos regulados de 1,5-2 L por día. No presentaba ninguna evidencia de alteraciones termorreguladoras. Se realizó una craneoplastia de polieteretercetona (PEEK) ~4 meses después de la cirugía inicial.
Después de 5 meses de rehabilitación multidisciplinar intensiva, seguía teniendo una mano derecha dominante no funcional y déficits cognitivos residuales significativos, y la dosificación y autoadministración segura de desmopresina subcutánea no era posible a largo plazo.
Un ensayo de desmopresina nasal y desmopresina oral mostró una absorción variable significativa que conducía a mayores fluctuaciones en las concentraciones de sodio. En lo sucesivo, se decidió utilizar la desmopresina sublingual disponible como desmopresina Melt. Tras varios ensayos con diferentes regímenes de dosificación, conseguimos fijar la producción de orina en aproximadamente 2 L/día utilizando desmopresina Melt liofilizada oral 120 mcg (2 comprimidos) por la mañana y 60 mcg (1 comprimido) por la noche. Sin embargo, con esta dosis tenía hiponatremia a ciertas horas del día. Llevamos a cabo un ajuste de dosis adicional cortando los comprimidos de desmopresina con pinzas/fórceps para sacar los comprimidos del blíster y cortarlos en cuartos exactos (cada uno de 15 mcg) con la ayuda de un cortador de pastillas. Con un régimen de 90 mcg (1,5 comprimidos) por la mañana y 75 mcg (1,25 comprimidos) por la noche conseguimos resultados similares a los del régimen subcutáneo. Con este régimen, y una ingesta de líquidos regulada de 2 L/día, sus concentraciones de sodio se mantuvieron dentro del rango de 135-150 mmol/L sin grandes fluctuaciones ni síntomas cognitivos. Esta dosificación también le permitió tener una mayor actividad durante el día para la rehabilitación y pudo dormir bien sin ser molestada por la poliuria por la noche.
Véase en la figura 1 las mediciones seriadas de sodio en esta paciente a lo largo del período de hospitalización con los acontecimientos descritos anteriormente.
En vista de la historia clínica y del hecho de que su hipófisis y su hipotálamo están en su mayoría intactos, es poco probable que tuviera defectos significativos en la barorregulación.
Discusión
Patofisiología de la IDA
En condiciones fisiológicas, el sodio plasmático, la osmolalidad y el equilibrio hídrico se mantienen dentro de rangos estrechos secundarios a una cuidadosa interacción entre la sed y la ingesta de agua, la secreción neurohipofisaria de vasopresina y la antidiuresis en los túbulos colectores distales renales.
Las señales periféricas (orofaríngeas, osmosensores intestinales, osmolalidad sanguínea) codifican la información sobre el estado actual de hidratación en tiempo real y se integran centralmente (5). Un estado de deshidratación dará lugar a señales estimulantes en el órgano subfornical (OFS), que jerárquicamente envía señales al órgano vascular de la lámina terminal (OVLT) y al núcleo preóptico medio (MnPO) (6). El MnPO, que puede servir de «detector central», envía señales estimulantes a los núcleos hipotalámicos para aumentar la liberación de vasopresina y también envía una señal de aumento de la sed a través del OFS y el OVLT (7, 8). Las vías neuronales relacionadas con la sed que conectan el SFO y el OVLT con la corteza cingulada e insular dan lugar a la percepción consciente de la sed (7, 8). Por el contrario, en el estado de hidratación adecuada, las señales de los sensores periféricos conducen a una inhibición de estas áreas y a una retroalimentación negativa de la MnPO que conduce a la supresión de la sed y a una menor secreción y liberación de vasopresina (circuito rojo). En efecto, las neuronas de la MnPO, la OVLT y la SFO están amplia y recíprocamente interconectadas, ya que la activación optogenética y quimiogenética de las neuronas de cualquiera de estas áreas puede estimular la sed (9). Por lo tanto, la interrupción del suministro de sangre que provoca un daño celular conducirá a la adipsia. También se han publicado casos de IAD debidos a la autoinmunidad de las células neuronales del SFO y del OVLT que indican la importancia funcional de estos sensores neuronales en el control de la sed (10).
Las neuronas de la AVP presentan una actividad «fásica» de potenciales de acción con intervalos en los que se libera AVP en los terminales de los axones. La liberación de vasopresina está regulada por las entradas osmosensoriales del MnPO, a través de barorreceptores y también existe una regulación anticipatoria en la que la liberación de vasopresina se estimula antes de las comidas (prandial), en la hipertermia y en un patrón circadiano (11). Existe un patrón circadiano diario de secreción de vasopresina en la circulación con un aumento de los niveles entre las 24:00 y las 02:00 h y los niveles caen progresivamente durante el día con el nadir entre las 16:00 y las 20:00 h (12). Este aumento circadiano a medianoche causado por un incremento en la liberación de vasopresina resulta en parte de una mayor excitación sináptica de las neuronas neurosecretoras magnocelulares por parte del núcleo supraquiasmático que se sabe que regula el ritmo circadiano (11). En la IAD, la regulación osmosensorial de la secreción de vasopresina es la más afectada y otros efectos pueden ser variables dependiendo del lugar y la extensión de la lesión, mientras que se sabe que la respuesta barorreceptora está preservada en muchos pacientes con lesiones limitadas, como se demostró en un estudio (13).
La PAV actúa en los conductos colectores renales a través de los receptores de vasopresina-2 (V2) para aumentar la permeabilidad al agua, lo que conduce a una menor formación de orina. La reabsorción de agua se controla mediante la regulación del canal de agua, la acuaporina-2 (AQP2). El AVP induce a corto plazo la translocación intracelular de vesículas portadoras de AQP2 a la membrana plasmática apical, regulando así el tráfico de AQP2. A largo plazo, con concentraciones adecuadas de AVP, regula la transcripción del gen AQP2 para aumentar la abundancia de la proteína AQP2 en el conducto colector (14). En la IAD, postulamos que es probable que la respuesta osmosensorial aguda se vea más afectada que la respuesta crónica. Por lo tanto, habrá una abundancia relativa de acuaporina, pero el tráfico agudo hacia la membrana apical se verá afectado.
Véase la Figura 2 para una ilustración detallada de los mecanismos.
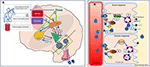
Figura 2. Representación esquemática de la regulación del equilibrio de líquidos en los seres humanos. (A) El control y la regulación de la secreción de vasopresina en el cerebro. (A) Las señales periféricas (orofaríngeas, osmosensores intestinales, osmolalidad sanguínea) codifican la información sobre el estado actual de hidratación en tiempo real (1) y se integran centralmente (2). Un estado de deshidratación conduce a señales estimulantes al SFO, que jerárquicamente envía señales al OVLT y al MnPO (3). El MnPO, que puede servir de «detector central», envía señales estimulantes a los núcleos hipotalámicos para aumentar la liberación de vasopresina (4), y también envía una señal de aumento de la sed a través del SFO y el OVLT (5, circuito azul en el diagrama). Por el contrario, en el estado de hidratación adecuada, las señales procedentes de los sensores periféricos se inhiben y la retroalimentación negativa de la MnPO conduce a la supresión de la sed y a una menor secreción y liberación de vasopresina (circuito rojo 6). Las vías neuronales relacionadas con la sed que conectan el SFO y el OVLT con la corteza cingulada e insular dan lugar a la percepción consciente de la sed (7). En la DI adípica, en ausencia de estímulos osmosensoriales, los circuitos neuronales asociados debido al daño celular, la liberación estimulante o la inhibición de la vasopresina y la percepción consciente de la sed están interrumpidos. (B) El mecanismo de acción de la vasopresina en los túbulos colectores renales. (B) La vasopresina en la circulación sanguínea se une al receptor 2 de la vasopresina en la superficie luminal de las células principales del túbulo colector distal de los riñones (1). En la fase aguda, mediante la síntesis de AMPc a partir de ATP a través de la AC (adenilato ciclasa) forma la proteína quinasa A (2) que estimula la translocación de la acuaporina desde la vesícula de almacenamiento a la membrana apical y la superficie luminal de la sangre (3). Esto hace que el agua sea transportada al interior de la célula (4) y absorbida posteriormente en la circulación (5). En la fase crónica, a través del control transcripcional del gen de la acuaporina mediado por el AMPc (6), se pueden encontrar mayores niveles del canal de agua de la acuaporina en las células principales (7). En la DI adípica, es probable que la respuesta aguda se vea más afectada que la crónica, ya que la secreción de vasopresina relacionada con la osmosensibilidad se ve afectada.
Búsqueda bibliográfica
Realizamos una búsqueda bibliográfica sistemática que incluyó Pubmed, Scopus y Embase de casos notificados como informe de casos o series de casos de DI adípica desde los años 1980 a 2018. Se utilizó el término de búsqueda: Adipsia, Adipsic disorder, y Adipsic DI y limitamos la búsqueda al idioma inglés y a Humanos. También buscamos cualquier otra referencia identificada durante la lectura de cada informe de caso/serie de casos. Encontramos 25 referencias (10, 13, 15-39) con un total de 45 casos reportados en la literatura. Hemos resumido todos los informes de casos en la Tabla 1.
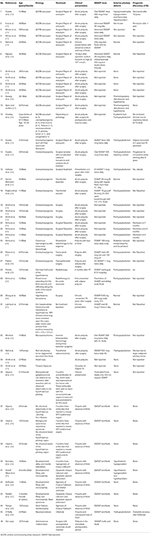
Tabla 1. Demografía, etiología, presentación clínica, manejo y pronóstico de los pacientes con diabetes insípida adípica reportados en la literatura.
Causas de la IDA
El 40% (17/46) de los casos de IDA descritos en la literatura se produjeron de forma secundaria a la rotura de un aneurisma de la arteria comunicante anterior (ACOM) y al recorte postquirúrgico mediante un abordaje de craniectomía frontal. En un caso se describió la doble patología de craneofaringioma y aneurisma de ACOM (15). Se ha descrito que el suministro arterial del OVLT proviene de cuatro fuentes (40) (1) una fuente mediana superior que se ramifica de la arteria comunicante anterior, (2) y (3) dos fuentes laterales que provienen de arterias que se ramifican de cada arteria cerebral anterior por debajo de la arteria comunicante anterior, y (4) una fuente mediana inferior que asciende desde debajo del quiasma óptico. Característicamente, los capilares que recubren este órgano se encuentran fuera de la barrera hematoencefálica y, por lo tanto, un cambio en la osmolalidad puede ser fácilmente percibido por estos órganos (41). Hay que tener en cuenta que las mejoras en las técnicas quirúrgicas y el uso del coiling en lugar del clipaje pueden reducir estas complicaciones. Para los pacientes en buenas condiciones clínicas con aneurismas rotos de la circulación anterior que son aptos para el coiling, los datos de un metaanálisis muestran que el coiling se asocia a un mejor resultado (42). En comparación con el clipaje, en el que se recortan ambos extremos del ACA con interrupción del suministro de sangre al hipotálamo, el procedimiento de inserción de un espiral en el aneurisma es capaz de preservar los alimentadores del hipotálamo en la mayoría de los casos.
La segunda causa de ADI se ha descrito como craneofaringioma supraselar (17/46). Estos casos suelen implicar una escisión transfrontal y en algunos casos se ha descrito la recuperación tras la cirugía. También se ha descrito un caso de hemangioma cavernoso con una manifestación similar tras un episodio hemorrágico (26).
Los tumores hipotalámicos, incluidos el hamartoma, el tumor de la glándula pineal y el tumor de células germinales, pueden presentarse con IAD (26, 29, 30). Se ha descrito un caso de carcinoma hepatocelular con metástasis en el hipotálamo y con resultado de IDA (31).
Interesantemente sólo se han descrito dos casos de tumores hipofisarios con IDA (18, 32). Ambos casos tenían un tumor agresivo con resección transfrontal múltiple y hemorragia intracraneal intraoperatoria. También se ha descrito un caso en relación con un traumatismo craneal y con la exposición al tolueno (13).
Se han descrito cuatro casos con presentación aguda y repentina de poliuria e hipernatremia. Estos pacientes no presentaban ninguna anomalía estructural en el hipotálamo y las investigaciones detalladas revelaron evidencias de anticuerpos contra los órganos del OVLT. Se ha postulado que estos casos tienen una patología autoinmune subyacente (10, 33).
También se han descrito casos congénitos o de la primera infancia en pacientes con problemas de desarrollo del cuerpo calloso con manifestación de IAD (34-38). También se ha descrito un caso de neurosarcoidosis con afectación extensa de la hipófisis anterior, la hipófisis posterior y el hipotálamo con IDA (39).
Presentación clínica de la IDA
La presentación clínica en la mayoría de los casos descritos es poliuria en la semana inmediata a la intervención quirúrgica por MAV o después de la craneotomía. La presentación bioquímica es la hipernatremia con aumento de la osmolalidad sérica en presencia de orina inapropiadamente diluida en grandes volúmenes. Si se evalúa la sensación de sed mediante una escala de sed, estos pacientes con IAD manifiestan tener poca o mínima sed a pesar de la hipernatremia. Curiosamente, estos pacientes tienen una respuesta normal a la hipotensión y su mecanismo barorreceptor está intacto (13).
Nuestro paciente pasó por una fase trifásica de DI inicial, seguida de SIADH y luego DI permanente. Este patrón descrito como respuesta trifásica se ha descrito después de cirugías de hipófisis y craneofaringioma. La fisiopatología de la respuesta trifásica parece explicarse por la disfunción hipotalámica inicial (caracterizada por poliuria e hipernatremia), la posterior liberación de vasopresina preformada desde las vesículas de almacenamiento en la hipófisis posterior (no relacionada con ningún estímulo) (caracterizada por SIADH) y, finalmente, el agotamiento de las reservas de vasopresina (DI permanente) (43). En nuestra paciente, es probable que en la tercera fase se desenmascare la deficiencia en la respuesta a la osmolalidad en la liberación de vasopresina tras la resolución del SIADH, más que una depleción absoluta de vasopresina.
Complicaciones asociadas a la IDA
Pocos informes de casos han descrito alteraciones termorreguladoras. El panhipopituitarismo se ha descrito en casos de craneofaringioma y sólo en casos de tumor hipofisario y no estaba presente en nuestra paciente.
Aunque no se ha informado de forma consistente, otras complicaciones importantes de la hipernatremia incluyen la trombosis venosa profunda; por lo tanto, la heparina de bajo peso molecular puede estar indicada durante la enfermedad aguda y la inmovilización (18).
También se ha informado con frecuencia de obesidad hipotalámica y apnea del sueño (18). En una serie de casos (13), en la que evaluaron la respuesta de la AVP a la hipotensión, encontraron que los pacientes con craneofaringiomas también tenían una pérdida de la respuesta de la AVP regulada por el baro. Estos pacientes tenían evidencia de panhipopituitarismo, lo que indica que la cirugía de sus tumores había dejado un daño más generalizado en la hipófisis, incluida la hipófisis posterior, que es la vía común final para la secreción de AVP.
Enfoques de manejo de la IDA
Se ha descrito el manejo de estos casos (15, 18). La educación del paciente y la familia sobre los principios del equilibrio hídrico y su manejo es crucial. La ingesta de agua puede fijarse en 1,5-2 L diarios y luego realizar la titulación de desmopresina. El seguimiento diario del peso es útil para detectar la deshidratación o la sobrecarga de líquidos. Se recomienda realizar concentraciones plasmáticas de sodio semanales para controlar las fluctuaciones. A pesar de un seguimiento estricto, es difícil reproducir un control de las concentraciones de sodio en plasma durante todo el día que imite la osmorregulación fisiológica. En vista del riesgo de rápidas oscilaciones en las concentraciones de sodio, y de los síntomas de hiponatremia observados en el rango de referencia bajo, es aconsejable mantener las concentraciones de sodio dentro del rango de referencia más alto.
La desmopresina, el análogo sintético de la AVP, se introdujo por primera vez para el tratamiento de la DI en 1972 (44). La mayoría de los pacientes obtienen buenos resultados con dosis bajas de desmopresina administradas dos veces al día. Hay un fino equilibrio y los niveles de sodio pueden oscilar a niveles muy bajos con escalas de dosis mínimas.
A nuestro paciente le fue muy bien con dosis muy bajas de administraciones parenterales que se sabe que tienen la menor variabilidad en la biodisponibilidad (45). La absorción de las formulaciones intranasales es muy variable, especialmente en niños o adultos con problemas cognitivos, ya que pueden no inhalar la solución de forma consistente (46, 47). Las formulaciones orales son una buena opción, ya que al aumentar la dosis se consigue una mayor duración de la acción, pero no tiene un efecto máximo (48-50). Probamos esta forma en dosis variables de 50-100 mcg, pero encontramos variaciones significativas en los efectos día a día con esta formulación. La desmopresina sublingual (Minirin Melt) está disponible desde 2005. Los estudios farmacológicos han demostrado que la vía sublingual da lugar a una mayor biodisponibilidad en un ~60% en comparación con la vía oral (49, 50). Se podrían conseguir dosis refinadas de desmopresina sublingual cortando cada comprimido de 60 mcg, lo que permitiría ajustar la dosis de 65 a 90 mcg por vía sublingual. Se ha descrito un perfil farmacocinético similar de dichos comprimidos divididos (51). Se sabe que la ingesta concomitante de alimentos disminuye la tasa y la extensión de la absorción en un 40%, por lo tanto, es mejor evitar cualquier consumo de alimentos dentro de una hora antes y después de la administración de los comprimidos de desmopresina sublingual. Recientemente se ha descrito un protocolo detallado de administración de líquidos con monitorización diaria de sodio con desmopresina subcutánea a dosis fijas (28) que demuestra la dificultad de la monitorización diaria. Otro informe de caso reciente (27) también ha informado del uso de la forma de desmopresina sublingual para la IDA en dosis de 60 y 120 mcg diarios. El uso de la desmopresina sublingual puede ser una alternativa útil en los casos en los que no se pueden alcanzar efectos óptimos con otras formulaciones.Estos pacientes requieren un control estricto del peso diario, el volumen de orina y la ingesta de líquidos durante todo el día. En vista de los defectos cognitivos y de memoria que suelen tener estos pacientes, suelen necesitar que un cuidador controle la ingesta de líquidos para asegurarse de que están bebiendo el volumen necesario.
En nuestra revisión de casos, 6 pacientes tuvieron una remisión de la IDA, de los cuales 2 estaban relacionados con un aneurisma de ACOM (15, 16) y 4 con un craneofaringioma (15, 26). Un paciente con neurosarcoidosis tuvo una remisión con el tratamiento con Infliximab (39). Estas observaciones pueden sugerir que tanto los osmorreceptores que regulan la sed como sus vías eferentes demuestran más neuroplasticidad que los que regulan la producción de AVP (26).
Conclusión
La IAD es una complicación extremadamente rara de los trastornos hipotalámicos que da lugar a una pérdida de función en el centro de la sed. Debido al control jerárquico del centro de la sed, la ausencia de sed se asocia también a la pérdida de regulación de la vasopresina y a la poliuria. Los sujetos que padecen IAD deben ser manejados delicadamente con dosis bajas de desmopresina y equilibrio de líquidos. Con los enfoques actuales de monitorización y atención personalizada, todavía no es posible imitar la osmorregulación casi fisiológica durante todo el día.
Disponibilidad de los datos
Todos los conjuntos de datos generados para este estudio se incluyen en el manuscrito/archivos complementarios.
Declaración ética
Se obtuvo el consentimiento informado por escrito de la(s) persona(s) para la publicación de cualquier imagen o dato potencialmente identificable incluido en este artículo.
Consentimiento para participar
Hemos obtenido el permiso por escrito de los familiares del paciente para escribir y publicar este manuscrito.
Contribuciones de los autores
RD fue el endocrinólogo principal que manejó el equilibrio de líquidos del paciente, conceptualizó la idea, escribió el manuscrito, hizo la revisión de la literatura, adquirió los datos, escribió y revisó el manuscrito final. HC, AC y JH fueron residentes que participaron en el tratamiento de este paciente y revisaron el manuscrito final. HT fue el anestesista a cargo de este paciente durante la fase de cuidados intensivos, conceptualizó la idea y evaluó críticamente el manuscrito final. KC fue la principal especialista en rehabilitación a cargo de la paciente, conceptualizó la idea y evaluó críticamente el manuscrito final. BB conceptualizó la idea y evaluó críticamente el manuscrito final.
Financiación
RD fue apoyado en parte por la Subvención del Centro del Consejo Nacional de Investigación Médica (NMRC/CG/017/2013) y el Premio de Científico Clínico del Consejo Nacional de Investigación Médica (MOH-CSAINV17nov-0006).
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Agradecemos a la paciente y a sus padres por permitirnos escribir y publicar este manuscrito.
1. Eisenberg Y, Frohman LA. Diabetes insípida adípica: una revisión. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Anomalías de la regulación de la sed. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Una propuesta de sistema de clasificación para las malformaciones arteriovenosas. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. El uso del coma inducido por barbitúricos durante los procedimientos de neurocirugía cerebrovascular: una revisión de la literatura. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarchical neural architecture underlying thirst regulation. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regulación de la sed y la liberación de vasopresina. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. From sensory circumventricular organs to cerebral cortex: neural pathways controlling thirst and hunger. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. El núcleo preóptico medio: al frente y en el centro de la regulación del líquido corporal, el sodio, la temperatura, el sueño y la homeostasis cardiovascular. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. La autoinmunidad al sensor de nivel de sodio en el cerebro causa hipernatremia esencial. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulation of vasopressin secretion and thirst in health and disease. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque C. Gizowski C, Bourque CW. La base neural de la sed homeostática y anticipatoria. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulación de la liberación de vasopresina en la diabetes insípida adípica. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Molecular mechanisms regulating aquaporin-2 in kidney collecting duct. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Patrones heterogéneos de recuperación de la sed en pacientes adultos con diabetes insípida adípica. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renal compensatory adaptation for water handling in a patient with adipsic diabetes insipidus after clipping of a ruptured aneurysm of the anterior communicating artery. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus after clipping of anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Síndrome adípico hipotalámico: diagnóstico y manejo. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hipernatremia hipodípica y diabetes insípida tras el recorte del aneurisma de la arteria comunicante anterior: retos diagnósticos y terapéuticos en el paciente amnésico de rehabilitación. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Chronic hypernatremia and hypothermia following subarachnoid haemorrhage. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia e hipotermia después de una hemorragia subaracnoidea. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Clinical insights into adipsic diabetes insipidus: a large case series. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypothalamic obesity complicated by adipsic central diabetes insipidus following surgical resection of a craniopharyngioma. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Rabdomiólisis grave por hipernatremia adípica tras cirugía de craneofaringioma. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Evaluación objetiva de la recuperación de la sed en pacientes con diabetes insípida adípica. Pituitary. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Diabetes insípida adípica secundaria a resección de craneofaringioma. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Protocolo de monitorización diaria de sodio e ingesta de líquidos: prevención de la hospitalización recurrente en la diabetes insípida adípica. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia en un paciente con diabetes insípida. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Gota de inicio juvenil y diabetes insípida adípica: informe de un caso y revisión de la literatura. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Hiperosmolaridad severa e hipernatremia en una mujer joven adípica. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Diabetes insípida adípica tras la cirugía hipofisaria por un macroprolactinoma. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Hipernatremia adípica sin lesiones hipotalámicas acompañada de autoanticuerpos contra el órgano subfornical. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hipoplasia del cuerpo calloso asociada a hipernatremia adípica e hipogonadotropismo hipotalámico: informe de un caso y revisión de la literatura. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Hipernatremia crónica por un defecto congénito en la osmorregulación de la sed y la vasopresina. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Hipernatremia esencial, hormona antidiurética y secreción de neurohipofisina: respuesta a la clorpropamida. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Hipernatremia adípica en dos hermanas. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Un caso de hipernatremia crónica con agenesia del cuerpo calloso. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Remisión radiológica y recuperación de la apreciación de la sed tras el tratamiento con infliximab en la diabetes insípida adípica secundaria a neurosarcoidosis. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Los órganos circunventriculares: un atlas de anatomía comparativa y vascularización. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Espiral endovascular versus clipaje neuroquirúrgico para personas con hemorragia subaracnoidea por aneurisma. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Trastornos del equilibrio hídrico después de la neurocirugía: la respuesta trifásica revisada. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effects of DDAVP, a synthetic analogue of vasopressin, in patients with cranial diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmacocinética y farmacodinámica de la desmopresina administrada por vía oral frente a la intravenosa durante el día frente a la noche en hombres sanos de 55-70 años. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopresina 30 años en uso clínico: una revisión de seguridad. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Tratamiento de la diabetes insípida neurohipofisaria. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmacocinética de la vasopresina 1-deamino-8-D-arginina tras varias vías de administración en voluntarios sanos. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Pharmacokinetics, pharmacodynamics, long-term efficacy and safety of oral 1-deamino-8-D-arginine vasopressin in adult patients with central diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Farmacocinética plasmática de la desmopresina tras la administración sublingual: un estudio exploratorio de escalada de dosis en voluntarios varones sanos. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin lyophilisate for the treatment of central diabetes insipidus: first experience in very young infants. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar