- Introducción
- Materiales y métodos
- Criterios de inclusión
- Estimulación ovárica y recuperación de ovocitos
- Política de transferencia de embriones
- Medidas del resultado primario y análisis estadístico
- Resultados
- Parámetros de ovocitos y embriones
- Resultados de la gestación y tasa acumulada de nacidos vivos (CLBR)
- Discusión
- Conclusión
- Disponibilidad de datos
- Declaración ética
- Contribuciones de los autores
- Financiación
- Declaración de conflicto de intereses
- Agradecimientos
Introducción
Recientemente se ha desarrollado un novedoso sistema, los criterios POSEIDON, para clasificar a las pacientes con infertilidad de bajo pronóstico sometidas a tratamiento con tecnología de reproducción asistida (TRA) (1). Se trata de un sistema útil para la identificación y clasificación de las pacientes con reserva ovárica alterada o respuesta ovárica deficiente (POR), que proporciona una guía para el diagnóstico y el tratamiento de estas pacientes (2). Se han sugerido cuatro subconjuntos basados en parámetros cuantitativos y cualitativos que incluyen la edad, los biomarcadores de reserva ovárica y la respuesta ovárica. Los nuevos criterios, al introducir una estratificación más detallada de la POR, redujeron significativamente la heterogeneidad de las pacientes que cumplían los criterios de Bolonia (3), lo que puede diferenciar subconjuntos de pacientes dentro de la población de la POR que podrían ser identificados y beneficiarse de intervenciones específicas (4). Aunque se establecieron los criterios POSEIDON, junto con algunas recomendaciones de tratamiento específicas propuestas para los subgrupos específicos de pacientes (5), todavía no hay pruebas suficientes que respalden la validez de los parámetros utilizados en los criterios POSEIDON, así como la evaluación de los resultados de los diferentes subgrupos.
Entre los cuatro grupos basados en los criterios POSEIDON, el grupo 1 es sin duda el de mejor pronóstico teniendo en cuenta su menor edad y su reserva ovárica normal, mientras que el grupo 4 tiene el peor pronóstico debido a la edad avanzada y la reserva ovárica disminuida. Sin embargo, una pregunta interesante es quién conseguiría un mejor resultado de embarazo, las mujeres mayores (grupo 2) con reserva ovárica normal o las jóvenes (grupo 3) con reserva ovárica disminuida. La tasa acumulativa de nacidos vivos (TCV) se considera una medida preferible del éxito del tratamiento de FIV (6). Hasta ahora, ha habido muy pocos informes sobre los CLBR de los cuatro grupos de pacientes definidos por los criterios de POSEIDON.
Las características y el pronóstico de las pacientes deben utilizarse para desarrollar estrategias de manejo clínico. El objetivo de este estudio es caracterizar a los pacientes de bajo pronóstico para facilitar la toma de decisiones de tratamiento. En este estudio, se analizaron las características basales y los resultados de los grupos de pacientes definidos por los criterios POSEIDON, y se propuso el CLBR resultante de un ciclo de fecundación in vitro (FIV)/inyección intracitoplasmática de espermatozoides (ICSI) aspirado como medida de resultado principal para los pacientes de bajo pronóstico sometidos a tratamiento de FIV (7).
Materiales y métodos
Este estudio retrospectivo incluyó 18.455 ciclos de FIV con aspiración en fresco y posterior transferencia de embriones congelados desde enero de 2014 hasta enero de 2017 en nuestro centro. El resultado de nacidos vivos fue seguido durante al menos 2 años hasta enero de 2019. El estudio fue aprobado por el Comité de Ética para la Aplicación Clínica de la Tecnología de Reproducción Humana Asistida del Northwest Women’s and Children’s Hospital (nº 2018002). El comité de ética aprobó este estudio renunciando a la necesidad de obtener el consentimiento informado. Toda la investigación se llevó a cabo de acuerdo con las directrices y reglamentos pertinentes.
Criterios de inclusión
Las pacientes se clasificaron según los criterios de POSEIDON:
Pacientes de bajo pronóstico
Grupo 1 (n = 879 ciclos): Edad < 35 años, recuento de folículos antrales (AFC) ≥ 5, número de ovocitos recuperados ≤ 9 en el ciclo anterior;
Grupo 2 (n = 482 ciclos): Edad ≥ 35, AFC≥5, número de ovocitos recuperados ≤ 9 en el ciclo anterior;
Grupo 3 (n = 858 ciclos): Edad < 35, AFC < 5;
Grupo 4 (n = 1.306 ciclos): Edad ≥ 35, AFC < 5;
Pacientes de pronóstico no bajo
Grupo 5 (n = 664 ciclos): AFC ≥ 5, estimulación ovárica previa > 9 ovocitos;
Grupo 6 (n = 13708 ciclos): AFC ≥ 5, sin estimulación ovárica previa.
El diagrama de flujo y el procedimiento de procesamiento de datos se indican en la figura 1. Los datos demográficos y las características basales de las pacientes se presentan en la Tabla 1.
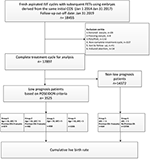
Figura 1. Diagrama de flujo y procesamiento de datos.
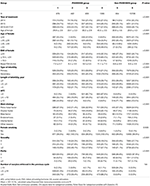
Tabla 1. Datos demográficos y características basales.
Estimulación ovárica y recuperación de ovocitos
El protocolo de estimulación ovárica (EO) se determinó individualmente según la edad de la mujer, el índice de masa corporal (IMC), la hormona foliculoestimulante basal (FSH) y el recuento de folículos antrales (AFC). El 94,33% de las pacientes de FIV recibieron gonadotrofinas recombinantes y/o urinarias (rFSH/hMG) en el protocolo de agonistas de la GnRH o en el de antagonistas de la GnRH seguido de FIV o ICSI. Para las mujeres con reserva ovárica disminuida, se utilizó el protocolo de estimulación leve o la estimulación ovárica en fase lútea o el ciclo natural. Se añadió gonadotrofina menopáusica humana (hMG, Li Zhu, China) en el protocolo de ovulación suave o en el protocolo de Shanghai, según la respuesta de las pacientes a la estimulación. Se administró gonadotrofina coriónica humana (hCG) 4.000-10.000 UI o hCG recombinante (r-hCG, MerckSerono S.p.A.) 250μg cuando 2-3 folículos alcanzaron el tamaño de 17 mm o más. Treinta y seis horas más tarde, se llevó a cabo la extracción de ovocitos mediante aspiración guiada por ecografía transvaginal. Los parámetros de estimulación ovárica de cada grupo se enumeran en la tabla 2.

Tabla 2. Parámetros de estimulación ovárica.
Política de transferencia de embriones
Los procedimientos de procesamiento de ovocitos y desarrollo de embriones, así como el sistema de puntuación de embriones, se describieron en nuestros artículos anteriores (8, 9). Los embriones de grado 1-3 en el día 3 se consideraron embriones utilizables, y los embriones de grado 1-2 se consideraron embriones de buena calidad. Todas las transferencias de embriones frescos (TE) se realizaron en el día 3 o en el día 5. En los casos con un número suficiente (≥ 3-4) de embriones de buena calidad en el día 3, se practicaba la transferencia de blastocitos en el día 5. Aparte de los embriones transferidos, los embriones adicionales de las pacientes se vitrificaron en el día 3 o en la fase de blastocisto (día 5-6). Los embriones en fase de clivaje de grado 1-3 en el día 3 y los blastocistos con una puntuación de Gardner superior a 4CC se criopreservaron (Cryo-top, sistema abierto, Kuwayama). Los métodos y el procedimiento de la TE congelada se detallan en un estudio de verificación previo de nuestro equipo (8, 9). Si la implantación fallaba en el ciclo en fresco, se realizaba la transferencia de embriones congelados-descongelados (FET) utilizando los embriones vitrificados restantes o los blastocistos. Se animó a las pacientes menores de 35 años con embriones de buena calidad a que recibieran una transferencia de un solo embrión. También se aplicó una política de transferencia de un solo embrión a las pacientes con útero anormal (por ejemplo, útero cicatrizado, malformación uterina) y/u otros casos conflictivos con el embarazo gemelar. Se administró una inyección intramuscular de progesterona (60 mg/día) para el apoyo de la fase lútea desde el día de la recuperación de ovocitos hasta una beta-hCG sérica negativa o hasta las 8 semanas de embarazo.
Medidas del resultado primario y análisis estadístico
El resultado primario fue el nacimiento vivo acumulado (RVC) definido como al menos un nacimiento vivo resultante de un ciclo de TRA aspirado en la TE fresca o en la FET posterior en relación con el número de ovocitos recuperados. El numerador del cálculo del CLBR fue la suma de los nacidos vivos conseguidos en los FET y los nacidos vivos en los ciclos en fresco. Sólo se contabilizó el primer parto en el análisis si una paciente conseguía varios partos. El CLBR se definió como el número acumulado de nacidos vivos por aspiración transvaginal de ovocitos de acuerdo con la definición terminológica (7, 10) Un ciclo de tratamiento se definió como una extracción de ovocitos. Un ciclo de tratamiento completo se refirió a un ciclo de tratamiento que alcanzó el nacimiento vivo o un ciclo de tratamiento que no alcanzó el nacimiento vivo con todos los embriones transferidos. La tasa acumulada de nacidos vivos en este estudio se calculó sobre la base del ciclo de tratamiento completo, por lo que se excluyeron las pacientes (n = 337) de tratamiento no completo.
El procesamiento de los datos y el análisis estadístico se realizaron utilizando el software EmpowerStats (www.empowerstats.com) y los paquetes de software estadístico R. Para evaluar la odds ratio (OR) de la RBC en los diferentes grupos de pacientes, se estableció un modelo de regresión de variables múltiples con los posibles factores de confusión como variables y se ajustó por el año de tratamiento, el IMC femenino, el tipo de infertilidad, la duración de la infertilidad, la gravidez, la paridad, la etiología principal, el protocolo de SO, el tipo de gonadotrofina y la dosis inicial de FSH. Las pacientes se inscribieron durante 3 años, durante los cuales se revisó el procedimiento de FIV. Para eliminar el sesgo causado por este factor, la tasa acumulada de nacidos vivos se ajustó por el año de tratamiento. El IMC femenino, el tipo de infertilidad, la duración de la infertilidad, la gravidez, la paridad y la etiología principal eran factores importantes que afectaban al embarazo y a los nacidos vivos según la experiencia o la literatura. El protocolo de OS, el tipo de gonadotrofina y la dosis inicial de FSH son los indicadores clave que afectan al número de ovocitos recuperados y, en última instancia, a la posibilidad acumulada de nacidos vivos.
Resultados
Parámetros de ovocitos y embriones

Tabla 3. Parámetros de ovocitos y embriones y CLBRs.
Resultados de la gestación y tasa acumulada de nacidos vivos (CLBR)
Incongruente con el patrón de distribución del número de ovocitos y embriones por grupo, el CLBRs en el orden de mayor a menor fue del 44.6% en el grupo 1 (n = 879), 35,5% en el grupo 3 (n = 858), 24,5% en el grupo 2 (n = 482) y 12,7% en el grupo 4 (n = 1306). Se realizó un análisis de regresión de variables múltiples con las variables que pueden actuar como factores de confusión descritas en las tablas 1, 2. Las odds ratios (OR) ajustadas de CLBR con sus intervalos de confianza (IC) del 95% se mostraron en la Tabla 4. En consonancia con la tendencia de los resultados no ajustados, el CLBR del grupo 3 (OR 0,9; IC del 95%: 0,7-1,2; p = 0,615) fue ligeramente inferior y el del grupo 5 (OR 1,3; IC del 95%: 0,9-1,7; p = 0,111) fue ligeramente superior al CLBR del grupo 1, sin diferencias estadísticas significativas. El CLBR en el grupo 2 fue significativamente menor que en el grupo 1 (OR 0,6, IC 95% 0,4-0,8, p = 0,004) y el CLBR en el grupo 4 fue el más bajo (OR 0,4, IC 95% 0,3-0,6, p < 0,001) en comparación con el grupo 1. La tabla 5 mostró los resultados de embarazo por transferencia en fresco o FET en las pacientes de bajo pronóstico. Las tasas de implantación en los grupos de edad (grupo 2 y grupo 4) fueron significativamente menores que en los grupos jóvenes (grupo 1 y grupo 3).

Tabla 4. Análisis de regresión logística para CLBRs.

Tabla 5. Resultados del embarazo por transferencia tanto en fresco como congelada de embriones en pacientes de bajo pronóstico.
La figura 2 mostraba el gráfico de tendencias de los eventos clave en pacientes de bajo pronóstico. Hubo un cruce de líneas de tendencia entre el grupo 2 y el grupo 3 después de la transferencia de embriones. Las pacientes del grupo 2 (edad ≥35 años; AFC ≥ 5) tuvieron mayor AFC, más ovocitos recuperados, más embriones y más embriones de buena calidad, pero disminuyeron la tasa de implantación y la CLBR. Por el contrario, aunque las pacientes del grupo 3 (edad < 35; AFC < 5) tuvieron menos ovocitos y embriones, la CLBR resultó superior a la del grupo 2. El análisis DAFO de 4 grupos de pacientes de bajo pronóstico definidos por los criterios POSEIDON se muestra en la Figura 3.
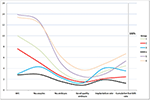
Figura 2. Gráfico de tendencia de los eventos clave en los pacientes de bajo pronóstico. Hubo un cruce de líneas de tendencia entre el grupo 2 (rojo) y el grupo 3 (azul) después de la transferencia de embriones. El eje X representa el número medio de AFC, el número de ovocitos, el número de embriones, el número de embriones de buena calidad, la tasa de implantación y la tasa de nacidos vivos acumulada. El eje Y de la izquierda representa el número de las cuatro primeras variables (n) y el eje Y de la derecha representa la tasa de las dos últimas variables (%).
FIGURA 3

Figura 3. Análisis DAFO de 4 grupos de pacientes de bajo pronóstico definidos por los criterios POSEIDON.
Discusión
El principal hallazgo de este estudio retrospectivo en la población definida por los criterios POSEIDON fue que el CLBR fue más alto en el grupo 1, seguido del grupo 3 y el grupo 2, y más bajo en el grupo 4. Según nuestros resultados, el CLBR de las mujeres jóvenes con poca reserva ovárica (grupo 3) fue ligeramente inferior al de las mujeres jóvenes con buena reserva ovárica y baja respuesta previa (grupo 1). Aunque las pacientes del grupo 2 (edad ≥ 35 años; AFC ≥ 5) tenían mejor reserva ovárica, más ovocitos y más embriones, la CLBR y la tasa de implantación, en cambio, fueron menores que en las pacientes del grupo 3 con peor reserva ovárica, menos ovocitos y menos embriones. Este hallazgo puede facilitar el desarrollo de estrategias de gestión para las pacientes de bajo pronóstico.
Los innovadores criterios POSEIDON tienen como objetivo identificar y estratificar a las pacientes de bajo pronóstico en cuatro grupos distintos en función de la edad de la mujer, la AFC y la respuesta ovárica en el ciclo anterior (4). Las pacientes del grupo 2 se caracterizan por tener una buena reserva ovárica y una edad avanzada, exactamente lo contrario que las pacientes del grupo 3, con una reserva ovárica pobre pero de menor edad. Los estudios (11-13) han demostrado que la RBC aumenta con el número de ovocitos recuperados incluso en las mujeres de edad avanzada (14). Se sugirió que el número de ovocitos extraídos es una variable muy importante asociada de forma independiente con la RBC. Se esperaba que las pacientes del grupo 2 con un mayor número de ovocitos tuvieran un mejor pronóstico que las del grupo 3, porque las pacientes del grupo 2 tenían más embriones para transferir. Sin embargo, el CLBR y la tasa de implantación fueron inversamente mayores en el grupo 2 que en el grupo 3.
Nuestros resultados coinciden con estudios anteriores (15, 16) sobre la asociación de la reserva ovárica y el resultado del embarazo. Chang et al. (15) descubrieron que había tasas más bajas de fecundación normal, escisión, embriones de alta calidad, implantación y embarazo en las mujeres mayores que en las más jóvenes con reserva ovárica disminuida. La razón principal era el impacto adverso del envejecimiento de los ovocitos en el resultado del embarazo (baja tasa de implantación y alta tasa de pérdida del embarazo) debido a las anomalías cromosómicas (17) y a la disfunción citoplasmática (18). La disminución de la fertilidad con el envejecimiento afecta tanto a la cantidad como a la calidad del ovocito. La implantación y el aborto están relacionados con la calidad de los ovocitos, pero no necesariamente con la reserva ovárica (16). La justa reserva ovárica del grupo 2 aumentaría la posibilidad de obtener más ovocitos y embriones para transferir, pero al mismo tiempo, la mayor tasa de aneuploidía llevaría a una baja tasa de implantación y a una alta tasa de abortos.
En cuanto al manejo de las pacientes del grupo 2, se debe prestar más atención al desarrollo de estrategias de mejora de la calidad de los ovocitos más que a la cantidad de ovocitos o de embriones. Dado que en el grupo 2 se consiguen más embriones en el día 3, el cultivo de embriones hasta el estadio de blastocisto para su transferencia es una buena opción. Los embriones del día 5-6 tienen una menor tasa de aneuploidía segmentaria (19) y una mayor viabilidad para la implantación (20) que los embriones del día 2-3. Las pruebas genéticas de preimplantación para aneuploidías (PGT-A) también son beneficiosas para que las mujeres avanzadas seleccionen un embrión euploide para transferir (21). Un régimen de estimulación ovárica óptimo para mejorar la calidad de los ovocitos (22, 23) podría ser una opción alternativa. Se probaron suplementos como la dehidroepiandrosterona para mejorar el desarrollo de los folículos (24), aunque no hay pruebas suficientes que respalden su uso en estas pacientes.
Las pacientes del grupo 3 (edad < 35 años; AFC < 5) tenían una reserva ovárica pobre, de las que se esperaba una mala respuesta con un mal resultado de embarazo. Curiosamente, la tasa de salida de ovocitos (145,3% de ovocitos recuperados por AFC) en el grupo 3 fue significativamente mayor que en los otros grupos, aunque la dosis inicial de FSH no se incrementó significativamente (Tabla 2). Esto sugiere que la respuesta de los folículos antrales a la gonadotropina puede haber alcanzado el límite de su capacidad, por lo que no habrá ningún beneficio adicional en el número de ovocitos si se siguen aumentando las dosis diarias de gonadotropina (25). La evaluación de la sensibilidad ovárica a la FSH es un elemento clave para mejorar las tasas de éxito de la FIV en estas pacientes de bajo pronóstico y abrir nuevas perspectivas de tratamiento (26). La elevada tasa de producción de ovocitos por AFC en el grupo 3 también apoyó la recomendación comunicada de una dosis diaria máxima de 300 UI de FSHr (5). En el caso de las pacientes del grupo 3, se deberían centrar más esfuerzos en aumentar el número de ovocitos, ya que el resultado clínico del embarazo está asegurado una vez que se adquieren los ovocitos.
Las pacientes del grupo 5 eran las pacientes de pronóstico no bajo que tenían una buena respuesta ovárica (más de 9 ovocitos en la recuperación anterior), sin embargo, la mayoría de estas pacientes no lograron el nacimiento en el ciclo de FIV anterior. En comparación con otras pacientes de pronóstico no bajo con el primer tratamiento de FIV (grupo 6), aunque las pacientes del grupo 5 tienen más AFC y número de ovocitos recuperados, el desarrollo del embrión y el resultado del embarazo fueron inferiores a los del grupo 6. Por lo tanto, el fracaso en las pacientes de la primera FIV con buena respuesta ovárica puede ser el mal pronóstico para el tratamiento posterior de FIV.
El factor tubárico-pélvico es la causa más común de infertilidad, representando alrededor del 10,8-78,3% de las mujeres infértiles en China (27, 28). El factor tubárico implica principalmente la oclusión de las trompas y la patología peritoneal que provoca adherencias, que se diagnostican mediante histerosalpingografía y laparoscopia. La causa prevalente de la infertilidad por factor tubárico se atribuyó a la enfermedad inflamatoria pélvica (EIP), la salpingitis y la endometriosis (29). En los grupos de pacientes de este estudio, el factor tubárico es la principal etiología de la infertilidad, y oscila entre el 62,9 y el 71,4%, lo que es más elevado que en las mujeres con infertilidad de otros países y regiones. Por lo tanto, se debe tener cuidado al interpretar las implicaciones más amplias de los hallazgos.
Las limitaciones están relacionadas con la naturaleza retrospectiva del estudio y el hecho de que los datos provenían de un solo centro también debilita la universalidad de nuestras observaciones. Otras limitaciones potenciales podrían ser que se utilizó un protocolo no análogo a la GnRH en algunas mujeres con reserva ovárica disminuida y no en aquellas con reserva ovárica normal. Los ciclos en fresco que no produjeron ningún ovocito no se incluyeron en este estudio, por ejemplo, los ciclos con cancelación de la estimulación ovárica.
Los resultados de este estudio pueden aportar nuevas ideas para el desarrollo de estrategias de manejo de pacientes de bajo pronóstico. Se realizó un análisis DAFO para ayudar al manejo de las pacientes de mal pronóstico en la clínica, que se extrajo de los informes POSEIDON (1, 2, 4, 5) y de los datos de este estudio. La capacidad de respuesta de los folículos antrales a la gonadotrofina fue muy superior en el grupo 3 que en los demás grupos. Teniendo en cuenta el resultado gratificante del CLBR en el grupo 3, para aumentar la producción de ovocitos, sugerimos intentar más estimulaciones ováricas pero no una estimulación ovárica más dura mediante una dosis diaria excesiva de gonadotrofina. Aunque las pacientes del grupo 2 tienen más reserva ovárica, así como más ovocitos y embriones, el CLBR fue inferior al esperado. La estrategia de manejo para el grupo 2 debería ser mejorar la tasa de nacidos vivos en lugar de aumentar el número de ovocitos recuperados.
Conclusión
En conclusión, inconsistente con el patrón de distribución de la cantidad de ovocitos y la cantidad de embriones por grupo de pacientes, los CLBR en el orden de mayor a menor fueron en el grupo 1 (mujeres jóvenes con buena reserva ovárica), el grupo 3 (mujeres jóvenes con mala reserva ovárica), el grupo 2 (mujeres en edad avanzada con buena reserva ovárica), y por último el grupo 4 (mujeres en edad avanzada con mala reserva ovárica.
Disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este manuscrito serán puestos a disposición por los autores, sin reservas indebidas, a cualquier investigador cualificado.
Declaración ética
El estudio fue aprobado por el Comité de Ética para la Aplicación Clínica de la Tecnología de Reproducción Humana Asistida del Hospital de Mujeres y Niños del Noroeste (nº 2018002). El comité de ética que aprobó este estudio renunció a la necesidad de obtener el consentimiento informado. Toda la investigación se realizó de acuerdo con las directrices y reglamentos pertinentes.
Contribuciones de los autores
WS y JS concibieron y diseñaron el estudio. WS y WZ redactaron y revisaron el manuscrito. WS, ZZ y WZ analizaron e interpretaron los datos. LT, ZZ, y HZ recogido y despejado los datos. Todos los autores han leído y aprobado la versión final del manuscrito.
Financiación
El estudio fue financiado por Proyectos Generales de Desarrollo Social en la provincia de Shaanxi (nº 2018SF-247) y Programa de Formación de Personal del Hospital de Mujeres y Niños del Noroeste (2018ZD02).
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Agradecemos a todos los clínicos, científicos y embriólogos del Hospital de Mujeres y Niños del Noroeste por su ayuda en la recopilación de datos, y a todos los pacientes por su contribución a este estudio. Agradecemos a la Dra. Xinglin Chen del Departamento de Epidemiología y Bioestadística de X&Y solutions Inc. de Boston su contribución al apoyo estadístico.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. Una nueva estratificación más detallada de las respondedoras bajas a la estimulación ovárica: de una respuesta ovárica pobre a un concepto de bajo pronóstico. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. La novedosa estratificación POSEIDON de «pacientes de bajo pronóstico en tecnología de reproducción asistida’ y su propuesta de marcador de resultado exitoso. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. Consenso de la ESHRE sobre la definición de «mala respuesta» a la estimulación ovárica para la fertilización in vitro: los criterios de Bolonia. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definición de pacientes de bajo pronóstico sometidos a tecnología de reproducción asistida: Criterios POSEIDON-el por qué. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Factores relacionados con el embarazo clínico después de la transferencia de embriones vitrificados-calentados: un análisis retrospectivo y de regresión logística multivariante de 2313 ciclos de transferencia. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Tasas acumuladas de nacidos vivos según el número de ovocitos recuperados después de la primera estimulación ovárica para la fecundación in vitro/inyección intracitoplasmática de espermatozoides: un análisis multinacional multicéntrico que incluye aproximadamente 15.000 mujeres. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Asociación entre el número de ovocitos recuperados y la tasa acumulada de nacidos vivos en mujeres de 35-40 años sometidas a ciclos largos de FIV/ICSI con agonistas de GnRH. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Pronóstico de la tasa de nacidos vivos acumulada basado en el número de ovocitos aspirados en ciclos previos de TRA. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodríguez I, Coroleu B, Martínez F, Polyzos NP. Tasas acumuladas de nacidos vivos y número de ovocitos recuperados en mujeres de edad avanzada. A single centre analysis including 4500 women >/ = 38 years old. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Egg quality and pregnancy outcome in young infertile women with diminished ovarian reserve. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. La disminución de la reserva ovárica medida por medio de la hormona foliculoestimulante basal y el recuento de folículos antrales no se asocia con la pérdida del embarazo en pacientes más jóvenes de fertilización in vitro. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. El envejecimiento de los ovocitos subyace al envejecimiento reproductivo femenino: mecanismos biológicos y estrategias terapéuticas. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparación de los resultados del embarazo después de la vitrificación en la etapa de clivaje y blastocisto: un meta-análisis. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. La estimulación ovárica en la fase lútea puede mejorar la recuperación de ovocitos y la calidad de los mismos en las personas con mala respuesta ovárica que se someten a la fecundación in vitro: resultados preliminares de un estudio piloto prospectivo de un solo centro. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Eficacia de la dehidroepiandrosterona (DHEA) para superar el efecto del envejecimiento ovárico (DITTO): un ensayo aleatorio controlado con placebo a prueba de principio. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Entender la tasa de salida folicular (FORT) y sus implicaciones para los criterios de POSEIDON. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Estudio epidemiológico sobre la infertilidad en tres provincias de China. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiología y etiología de la infertilidad del oviducto. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar