Dénomination générique : acyclovir
Formation posologique : crème
Médicalement examiné par Drugs.com. Dernière mise à jour le 1 décembre 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
- Indications et utilisation de Zovirax crème
- Zovirax crème Dosage et administration
- Formes posologiques et dosages
- 4CONTRAINDICATIONS
- Avertissements et précautions
- Général
- Sensibilisation de contact
- Réactions indésirables
- Expérience des essais cliniques
- Expérience post-commercialisation
- Interactions médicamenteuses
- Utilisation dans des populations particulières
- Résumé des risques
- Grossesse
- Lactation
- Utilisation pédiatrique
- Utilisation gériatrique
- Surdosage
- Zovirax Crème Description
- Zovirax Crème – Pharmacologie clinique
- Mécanisme d’action
- Pharmacocinétique
- Microbiologie
- Toxicologie non clinique
- Carcinogenèse, mutagenèse, altération de la fertilité
- Études cliniques
- Sujets adultes
- Sujets pédiatriques
- Mode de délivrance/stockage et manipulation
- Information sur le conseil au patient
- INFORMATIONS POUR LE PATIENTZOVIRAX (zho-vahy-rex)(acyclovir)Crème
- Panneau d’affichage principal – Carton de tubes de 5 g
- Plus d’informations sur Zovirax Cream (acyclovir topical)
- Ressources pour le consommateur
- Ressources pour le professionnel
- Autres formulations
- Guides de traitement associés
Indications et utilisation de Zovirax crème
Zovirax. La crème est un inhibiteur de l’ADN polymérase analogue au virus de l’herpès simplex (HSV) de type désoxynucléoside indiqué pour le traitement de l’herpès labial (boutons de fièvre) récurrent chez les adultes et les adolescents immunocompétents âgés de 12 ans et plus.
Zovirax crème Dosage et administration
Zovirax crème doit être appliquée 5 fois par jour pendant 4 jours. Le traitement doit être initié le plus tôt possible après l’apparition des signes ou des symptômes de l’herpès labial, c’est-à-dire pendant le prodrome ou lors de l’apparition des lésions.
Pour les adolescents de 12 ans et plus, la posologie est la même que chez les adultes.
Formes posologiques et dosages
Chaque gramme de crème Zovirax contient 50 mg (équivalent à 5% p/p) d’aciclovir.
4CONTRAINDICATIONS
La crème Zovirax est contre-indiquée chez les patients présentant une hypersensibilité connue à l’aciclovir, au valacyclovir ou à l’un des composants de la formulation.
Avertissements et précautions
Général
La crème Zovirax ne doit être appliquée que sur les aspects externes affectés des lèvres et du visage chez les patients atteints d’herpès labial. En l’absence de données, l’application sur les muqueuses humaines n’est pas recommandée. La crème Zovirax est destinée à un usage cutané uniquement et ne doit pas être utilisée dans l’œil ou à l’intérieur de la bouche ou du nez.
Sensibilisation de contact
La crème Zovirax présente un potentiel d’irritation et de sensibilisation de contact .
L’effet de la crème Zovirax n’a pas été établi chez les patients immunodéprimés.
Réactions indésirables
Expérience des essais cliniques
Parce que les essais cliniques sont menés dans des conditions très variables, les taux de réactions indésirables observés dans les essais cliniques d’un médicament ne peuvent pas être directement comparés aux taux dans les essais cliniques d’un autre médicament, et peuvent ne pas refléter les taux observés dans la pratique clinique.
Dans cinq essais en double aveugle, contrôlés par placebo, 1124 patients ont été traités avec la crème Zovirax et 1161 avec la crème placebo (véhicule). Des réactions locales au site d’application ont été rapportées par 5% des patients recevant la crème Zovirax et 4% des patients recevant le placebo. Les réactions indésirables les plus fréquentes au site d’application topique ont été les suivantes : lèvres sèches, desquamation, sécheresse de la peau, lèvres fissurées, peau brûlante, prurit, desquamation de la peau et picotements sur la peau ; chaque réaction indésirable est survenue chez moins de 1 % des patients recevant la crème Zovirax et le placebo. Trois patients sous Zovirax crème et un patient sous placebo ont arrêté le traitement en raison d’un effet indésirable.
Une étude supplémentaire, portant sur 22 adultes en bonne santé, a été menée pour évaluer la tolérance cutanée de Zovirax crème par rapport au véhicule en utilisant une méthodologie de test épicutané à occlusion simple et semi-occlusion. La crème Zovirax et le placebo ont tous deux montré un potentiel d’irritation élevé et cumulatif. Une autre étude, portant sur 251 adultes en bonne santé, a été menée pour évaluer le potentiel de sensibilisation de contact de la crème Zovirax en utilisant une méthodologie de test épicutané à insultes répétées. Sur 202 sujets évaluables, des réactions possibles de sensibilisation cutanée ont été observées chez les 4 mêmes sujets (2 %) à la fois avec la crème Zovirax et le placebo, et ces réactions à la fois à la crème Zovirax et au placebo ont été confirmées chez 3 sujets lors d’un nouveau test. Le ou les ingrédients sensibilisants n’ont pas été identifiés.
Le profil de sécurité chez les patients âgés de 12 à 17 ans était similaire à celui observé chez les adultes.
Expérience post-commercialisation
En plus des événements indésirables rapportés lors des essais cliniques, les événements suivants ont été identifiés lors de l’utilisation de la crème d’aciclovir après son approbation. Comme ils sont rapportés volontairement par une population de taille inconnue, il est impossible d’estimer leur fréquence. Ces événements ont été choisis pour être inclus en raison d’une combinaison de leur gravité, de leur fréquence de déclaration ou de leur lien de causalité potentiel avec la crème d’aciclovir.
Général : Angioedème, anaphylaxie.
Peau : Dermatite de contact, eczéma.
Interactions médicamenteuses
L’expérience clinique n’a identifié aucune interaction résultant de l’administration topique ou systémique d’autres médicaments en concomitance avec la crème Zovirax. En raison de l’absorption systémique minimale de la crème Zovirax, les interactions médicamenteuses systémiques sont peu probables.
Utilisation dans des populations particulières
Résumé des risques
L’absorption systémique de l’acyclovir est minimale après la voie d’administration topique, et l’utilisation maternelle ne devrait pas entraîner d’exposition du fœtus à la crème Zovirax . L’expérience de l’utilisation de l’acyclovir topique chez les femmes enceintes depuis plusieurs décennies, basée sur la littérature publiée, y compris des études d’observation, n’a pas identifié de risque associé au médicament de malformations congénitales majeures, de fausses couches ou d’issues maternelles ou fœtales indésirables. Des études de reproduction animale avec exposition systémique de l’acyclovir ont été menées. Se référer aux informations de prescription de l’aciclovir pour plus de détails.
Le risque de fond estimé d’anomalies congénitales majeures et de fausses couches pour la population indiquée est inconnu. Toutes les grossesses présentent un risque de fond d’anomalie congénitale, de perte ou d’autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Grossesse
Résumé du risque
L’acyclovir est absorbé de façon minimale par voie systémique après la voie d’administration topique, et l’utilisation maternelle ne devrait pas entraîner d’exposition du ftus à la crème Zovirax . L’expérience de l’utilisation de l’acyclovir topique chez les femmes enceintes depuis plusieurs décennies, basée sur la littérature publiée, y compris les études d’observation, n’a pas identifié de risque associé au médicament de malformations congénitales majeures, de fausses couches ou de résultats défavorables pour la mère ou le fœtus. Des études de reproduction animale avec exposition systémique de l’acyclovir ont été menées. Se référer aux informations de prescription de l’aciclovir pour plus de détails.
Le risque de fond estimé d’anomalies congénitales majeures et de fausses couches pour la population indiquée est inconnu. Toutes les grossesses présentent un risque de fond d’anomalie congénitale, de perte ou d’autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Lactation
Résumé des risques
L’acyclovir est absorbé de façon minimale par voie systémique après la voie d’administration topique, et l’allaitement ne devrait pas entraîner d’exposition de l’enfant à Zovirax crème . Il n’existe pas de données sur les effets de ZOVIRAX sur le nourrisson allaité ou sur la production de lait. Les avantages de l’allaitement sur le plan du développement et de la santé doivent être pris en compte ainsi que le besoin clinique de la mère pour la crème Zovirax et tout effet indésirable potentiel de la crème Zovirax ou de l’affection maternelle sous-jacente sur l’enfant allaité.
Utilisation pédiatrique
Un essai ouvert et non contrôlé avec la crème Zovirax a été mené chez 113 patients âgés de 12 à 17 ans présentant un herpès labial récurrent. Dans cet essai, le traitement a été appliqué en utilisant le même schéma posologique que chez les adultes et les sujets ont été suivis pour les effets indésirables. Le profil de sécurité était similaire à celui observé chez les adultes. La sécurité et l’efficacité chez les patients pédiatriques âgés de moins de 12 ans n’ont pas été établies.
Utilisation gériatrique
Les études cliniques de la crème d’aciclovir n’ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondent différemment des sujets plus jeunes. D’autres expériences cliniques rapportées n’ont pas identifié de différences de réponses entre les personnes âgées et les patients plus jeunes. L’absorption systémique de l’aciclovir après administration topique est minimale .
Surdosage
Le surdosage par application topique de la crème Zovirax est peu probable en raison de l’exposition systémique minimale . Il n’y a pas d’information disponible pour le surdosage.
Zovirax Crème Description
ZOVIRAX est le nom de marque de l’acyclovir, un analogue synthétique du désoxynucléoside actif contre les virus de l’herpès. La crème Zovirax 5% est une formulation pour l’administration topique.
Le nom chimique de l’acyclovir est 2-amino-1,9-dihydro-9–6H-purin-6-one ; il a la formule structurelle suivante :
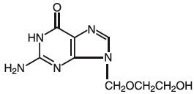
L’acyclovir est une poudre blanche, cristalline avec la formule moléculaire C8H11N5O3 et un poids moléculaire de 225. La solubilité maximale dans l’eau à 37°C est de 2,5 mg/mL. Les pKa de l’aciclovir sont de 2,27 et 9,25.
Chaque gramme de crème Zovirax contient 50 mg (équivalent à 5 % p/p) d’aciclovir et les ingrédients inactifs suivants : alcool cétostéarylique, huile minérale, poloxamère 407, propylèneglycol, lauryl sulfate de sodium, eau et pétrolatum blanc.
Zovirax Crème – Pharmacologie clinique
Mécanisme d’action
L’acyclovir est un médicament antiviral actif contre les α-herpèsvirus .
Pharmacocinétique
Une étude de pharmacologie clinique a été réalisée avec Zovirax Crème chez des volontaires adultes pour évaluer l’absorption percutanée de l’acyclovir. Dans cette étude, qui comprenait 6 volontaires masculins, la crème a été appliquée sur une surface de 710 cm2 sur le dos des volontaires 5 fois par jour à intervalles de 2 heures pendant un total de 4 jours. Le poids de la crème appliquée et l’excrétion urinaire d’acyclovir ont été mesurés quotidiennement. La concentration plasmatique d’acyclovir a été dosée 1 heure après la dernière application. L’excrétion urinaire quotidienne moyenne d’acyclovir était d’environ 0,04 % de la dose quotidienne appliquée. Les concentrations plasmatiques d’aciclovir étaient inférieures à la limite de détection (0,01 μM) chez 5 sujets et à peine détectables (0,014 μM) chez 1 sujet. L’absorption systémique de l’aciclovir provenant de la crème Zovirax est minime chez les adultes.
L’absorption systémique de l’aciclovir après application topique de la crème n’a pas été évaluée chez les patients <18 ans.
Microbiologie
Mécanisme d’action : L’acyclovir est un analogue purique désoxynucléosidique synthétique présentant une activité inhibitrice en culture cellulaire et in vivo contre les ADN polymérases du HSV de type 1 (HSV-1) et 2 (HSV-2). Il inhibe la réplication du HSV-1 et du HSV-2 en culture cellulaire et in vivo.
L’activité inhibitrice de l’aciclovir est sélective en raison de son affinité pour l’enzyme thymidine kinase (TK) codée par le HSV. Cette enzyme virale convertit l’acyclovir en acyclovir monophosphate, un analogue désoxynucléotidique. Le monophosphate est ensuite converti en diphosphate par la guanylate kinase cellulaire et en triphosphate par un certain nombre d’enzymes cellulaires. Dans les tests biochimiques, le triphosphate d’acyclovir inhibe la réplication de l’ADN viral de l’α-herpès. Cette inhibition s’effectue de 3 façons : 1) inhibition compétitive de l’ADN polymérase virale, 2) incorporation dans la chaîne d’ADN virale en croissance et terminaison de celle-ci, et 3) inactivation de l’ADN polymérase virale.
Activité antivirale
La relation quantitative entre la sensibilité des virus de l’herpès aux antiviraux en culture cellulaire et la réponse clinique au traitement n’a pas été établie chez l’homme, et les tests de sensibilité aux virus n’ont pas été standardisés. Les résultats des tests de sensibilité, exprimés par la concentration de médicament nécessaire pour inhiber de 50 % la croissance du virus en culture cellulaire (valeur EC50), varient considérablement en fonction d’un certain nombre de facteurs. En utilisant des tests de réduction de plaque sur des cellules Vero, les valeurs de la CE50 de l’acyclovir contre les isolats du virus de l’herpès simplex varient de 0,09 à 59,9 μM (0,02 à 13,5 μg/mL) pour le HSV-1 et de 0.04 à 44,0 μM (0,01 à 9,9 μg/mL) pour le HSV-2.
Résistance
En culture cellulaire
Des souches de HSV-1 et de HSV-2 résistantes à l’acyclovir ont été isolées en culture cellulaire. Les HSV résistants à l’acyclovir résultaient de mutations dans les gènes viraux de la thymidine kinase (TK ; pUL23) et de l’ADN polymérase (POL ; pUL30). Des décalages de cadre ont été fréquemment isolés et entraînent une troncature prématurée du produit TK du HSV, avec pour conséquence une moindre sensibilité à l’acyclovir. Les mutations du gène de la TK virale peuvent entraîner une perte totale de l’activité de la TK (TK négative), des niveaux réduits d’activité de la TK (TK partielle) ou une altération de la capacité de la TK virale à phosphoryler le médicament sans perte équivalente de la capacité à phosphoryler la thymidine (TK altérée). En culture cellulaire, les substitutions suivantes associées à la résistance dans la TK de HSV-1 et HSV-2 ont été observées (tableau 1).
|
HSV-1 |
TK |
P5A, H7Q, L50V, G56V, G59A, G61A, K62N, T63A, E83K, P84S, D116N, P131S, R163H, A167V, P173L, Q185R, R216S, R220H, T245M, R281stop, T287M, M322K |
|
HSV-2 |
TK |
L69P, C172R, T288M |
|
HSV-1 |
POL |
D368A, Y557S, E597D, V621S, L702H, N815S, V817M, G841C |
|
HSV-2 |
POL |
Chez des patients infectés par le HSV
Isolats cliniques de HSV-1 et de HSV-2 obtenus à partir de patients ayant échoué au traitement de leurs infections à α-herpèsvirus ont été évalués pour les modifications génotypiques des gènes TK et POL et pour la résistance phénotypique à l’acyclovir (tableau 2). Les isolats de HSV présentant des mutations de type frameshift et des substitutions associées à la résistance dans les gènes TK et POL ont été identifiés. La liste des substitutions dans la TK et la POL du HSV entraînant une diminution de la sensibilité à l’acyclovir n’est pas exhaustive et d’autres modifications seront probablement identifiées dans les variantes du HSV isolées chez les patients qui ne répondent pas aux traitements contenant de l’acyclovir. La possibilité d’une résistance virale à l’acyclovir doit être envisagée chez les patients qui ne répondent pas ou qui présentent une excrétion virale récurrente pendant le traitement.
|
HSV-1 |
TK |
G6C, R32H, R41H, R51W, Y53C/D/H, Y53stop, D55N, G56D/S, P57H, H58/N/R/Y, G59R, G61A, K62N, T63I, Q67stop, S74stop, Y80N, E83K, P84L, Y87H, W88R, R89Q/W, E95stop, T103P, Q104H, Q104stop, H105P, D116N, M121L/R, S123R, Q125H, M128L, G129D, I143V, A156V, D162A/H/N, R163G/H, L170P, Y172C, P173L, A174P, A175V, R176Q/W, R176stop, L178R, S181N, V187M, A189V, V192A, G200C/D/S, T201P, V204G, A207P, L208F/H, R216C/H, R220C/H, R221H, R222C/H, L227F, T245M/P, L249P, Q250Stop, C251G, R256W, E257K, Q261R, T287M, L288Stop, L291P/R, L297S, L315S, L327R, C336Y, Q342Stop, T354P, L364P, A365T |
|
HSV-2 |
TK |
R34C, G39E, R51W, Y53N, G59P, G61W, S66P, A72S, D78N, P85S, A94V, N100H, I101S, Q105P, T131P, D137stop, F140L, L158P, S169P, R177W, S182N, M183I, V192M, G201D, R217H, R221C/H, Q222stop, R223H, Y239stop, R271V, P272S, D273R, T287M, C337Y |
|
HSV-1 |
POL |
K532T, Q570R, L583V, A605V, A657T, D672N, V715G, A719T/V, S724N, F733C, E771Q, S775N, L778M, E798K, V813M, N815S, G841S, I890M, G901V, V958L H1228D |
|
HSV-2 |
POL |
E250Q, D307N, K533E, A606V, C625R, R628C, E678G, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, N820S, Y823C, Q829R, T843A, M910T, D912N/V, A915V, F923L, T934A, R964H |
Note : Des substitutions supplémentaires à la résistance à l’acyclovir peuvent exister.
Résistance croisée
Une résistance croisée a été observée parmi les isolats de HSV portant des mutations de type frameshift et des substitutions associées à la résistance, qui confèrent une sensibilité réduite au penciclovir (PCV), au famciclovir (FCV) et au foscarnet (FOS) .
|
Résistance croisée au PCV/FCV |
HSV-1 TK |
G6C, R32H, R51W, Y53C/H, H58N, G61A, S74Stop, E83K, P84L, T103P, Q104Stop, D116N, M121R, I143V, R163H, L170P, Y172C, A174P, R176Q/W, Q185R, A189V, G200D, L208H, R216C, R220H, R222C/H, T245M, Q250Stop, R256W, R281Stop, T287M, L315S, M322K, C336Y |
|
Résistant au PCV/FCV |
HSV-1 POL |
A657T, D672N, V715G, A719V, S724N, E798K, N815S, G841S |
|
Résistance croisée au PCV/FCV |
HSV-2 TK |
G39E, R51W, Y53N, R177W, R221H, T288M |
|
Résistance croisée au PCV/FCV |
HSV-2 POL |
K533E, A606V, C625R, R628C, S729N, Q732R, M789K/T, V818A, N820S, F923L, T934A |
|
Résistance croisée au FOS |
HSV-1 POL |
D368A, A605V, D672N, L702H, V715G, A719T/V, S724N, L778M, E798K, V813M, N815S, V817M, G841C/S, I890M, |
|
Résistance croisée au FOS |
HSV-2 POL |
K533E, A606V, C625R, R628C, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, Y823C, D912V, F923L, T934A, R964H |
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
L’exposition systémique après administration topique d’aciclovir est minime. Aucune étude de cancérogénicité cutanée n’a été réalisée. Les résultats des études de cancérogenèse, de mutagenèse et de fertilité ne sont pas inclus dans les informations complètes de prescription de la crème Zovirax en raison des expositions minimales d’aciclovir qui résultent de l’application cutanée. Des renseignements sur ces études sont disponibles dans les renseignements thérapeutiques complets sur les capsules, les comprimés et la suspension ZOVIRAX et sur ZOVIRAX pour injection.
Études cliniques
Sujets adultes
La crème Zovirax a été évaluée dans deux essais à double insu, randomisés et contrôlés par placebo (véhicule) pour le traitement de l’herpès labial récurrent. Le patient moyen avait eu cinq épisodes d’herpès labial au cours des 12 mois précédents. Dans le premier essai, l’âge médian des sujets était de 37 ans (intervalle de 18 à 81 ans), 74 % étaient des femmes et 94 % étaient de race blanche. Dans le deuxième essai, l’âge médian des sujets était de 38 ans (de 18 à 87 ans), 73 % étaient des femmes et 94 % étaient de race blanche. Les sujets devaient commencer le traitement dans l’heure suivant l’apparition des signes ou des symptômes et le poursuivre pendant 4 jours, en appliquant le médicament à l’étude 5 fois par jour. Dans les deux études, la durée moyenne de l’épisode d’herpès labial récurrent était plus courte d’environ une demi-journée chez les sujets traités avec la crème Zovirax (n = 682) par rapport aux sujets traités avec le placebo (n = 703), soit environ 4,5 jours contre 5 jours, respectivement. Aucune différence significative n’a été observée entre les sujets recevant Zovirax crème ou le placebo dans la prévention de la progression des lésions d’herpès labial.
Sujets pédiatriques
Un essai ouvert et non contrôlé avec Zovirax crème a été mené chez 113 patients âgés de 12 à 17 ans présentant un herpès labial récurrent. Dans cet essai, le traitement a été appliqué en utilisant le même schéma posologique que chez les adultes et les sujets ont été suivis pour les effets indésirables. Le profil de sécurité était similaire à celui observé chez les adultes.
Mode de délivrance/stockage et manipulation
Chaque gramme de Zovirax Crème contient 50 mg (équivalent à 5% p/p) d’aciclovir dans une base de crème aqueuse. La crème Zovirax est fournie comme suit :
NDC 0187-0994-45 : tubes de 5 g
Réservez à une température inférieure ou égale à 25°C (77°F) ; excursions autorisées entre 15° et 30°C (59° et 86°F) .
Information sur le conseil au patient
Conseillez au patient de lire l’étiquetage approuvé par la FDA (Information du patient).
Généralités
Les patients doivent être informés que la crème Zovirax est une crème topique délivrée sur ordonnance pour le traitement des feux sauvages (herpès labial récurrent) qui surviennent sur le visage et les lèvres. La crème Zovirax n’est pas un remède contre les feux sauvages. Les patients doivent être informés que la crème Zovirax est destinée à un usage cutané uniquement pour l’herpès labial des lèvres et du pourtour de la bouche. Les patients doivent être informés que la crème Zovirax ne doit pas être utilisée dans les yeux, à l’intérieur de la bouche ou du nez, ni sur les organes génitaux. Les patients doivent être informés qu’ils doivent éviter d’appliquer d’autres produits topiques sur la zone affectée pendant l’utilisation de la crème Zovirax.
Ne pas utiliser si vous êtes allergique à la crème Zovirax ou à l’un des ingrédients de la crème Zovirax. Avant d’utiliser Zovirax Cream, informez votre médecin si vous êtes enceinte, si vous prévoyez de l’être ou si vous allaitez.
Mode d’emploi
Le traitement doit être initié dès le premier signe ou symptôme de récidive. Indiquer aux patients de se laver les mains avant l’application et de s’assurer que le visage et/ou les lèvres sont propres et secs. Conseillez aux patients d’appliquer la crème Zovirax par voie topique 5 fois par jour pendant 4 jours. Indiquer aux patients d’appliquer par voie topique une quantité de crème Zovirax suffisante pour couvrir la zone affectée, y compris le bord extérieur. Conseillez aux patients d’éviter de frotter inutilement la zone affectée pour ne pas aggraver ou transférer l’infection. Indiquer aux patients de se laver les mains avec de l’eau et du savon après avoir utilisé la crème Zovirax. Tenir hors de portée des enfants.
Effets secondaires possibles
Les effets secondaires courants liés à la peau qui sont survenus lors de l’application de la crème Zovirax comprennent des réactions au site d’application. La crème Zovirax présente un potentiel d’irritation et de sensibilisation de contact.
Distribué par : Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Fabriqué par : Bausch Health Companies Inc.
Laval, Québec H7L 4A8, Canada
Zovirax est une marque déposée du groupe de sociétés GlaxoSmithKline et utilisée sous licence par Bausch Health.
© 2020 Bausch Health Companies Inc. ou ses sociétés affiliées
9462203
INFORMATIONS POUR LE PATIENTZOVIRAX (zho-vahy-rex)(acyclovir)Crème
Information importante : La crème Zovirax est destinée à être utilisée sur les feux sauvages sur les lèvres et autour de la bouche uniquement. La crème Zovirax ne doit pas être utilisée dans les yeux, la bouche, le nez ou sur les organes génitaux.
Qu’est-ce que la crème Zovirax ?
– La crème Zovirax est un médicament d’ordonnance utilisé pour traiter les feux sauvages (herpès labial) qui sont récurrents chez les adultes et les enfants de 12 ans et plus, et qui ont un système immunitaire normal. – La crème Zovirax n’est pas un remède contre les feux sauvages.
On ne sait pas si Zovirax crème est sûr et efficace chez les enfants de moins de 12 ans.
N’utilisez pas Zovirax crème si vous êtes allergique à l’aciclovir, au valacyclovir ou à l’un des ingrédients de Zovirax crème. Voir la fin de cette notice pour la liste complète des ingrédients contenus dans Zovirax Cream.
Que dois-je dire à mon professionnel de santé avant d’utiliser Zovirax Cream ?
Avant d’utiliser Zovirax Cream, informez votre professionnel de santé de toutes vos conditions médicales, y compris si vous :
– tombez malade très facilement (avez un système immunitaire faible). – êtes enceinte ou prévoyez de l’être. On ne sait pas si la crème Zovirax peut nuire à votre bébé à naître. – vous allaitez ou prévoyez d’allaiter. On ne sait pas si la crème Zovirax passe dans le lait maternel. Parlez à votre professionnel de santé de la meilleure façon de nourrir votre bébé si vous utilisez la crème Zovirax.
Dites à votre professionnel de la santé tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
Comment dois-je utiliser la crème Zovirax ?
– Utilisez la crème Zovirax exactement comme votre professionnel de la santé vous dit de l’utiliser. – Utilisez la crème Zovirax dès que vous avez les premiers symptômes d’un feu sauvage, tels que des démangeaisons, des rougeurs, des brûlures ou des picotements, ou dès que le feu sauvage apparaît. – Lavez-vous les mains à l’eau et au savon avant et après l’application de la crème Zovirax. – La zone affectée doit être propre et sèche avant d’appliquer la crème Zovirax. – Appliquez la crème Zovirax sur la zone affectée 5 fois par jour pendant 4 jours, y compris sur le bord extérieur. – Vous ne devez pas appliquer d’autres produits pour la peau sur la zone affectée pendant le traitement avec la crème Zovirax. – Évitez de frotter inutilement le bouton de fièvre, car cela peut entraîner la propagation du bouton de fièvre à d’autres zones autour de votre bouche ou aggraver votre bouton de fièvre.
Quels sont les effets secondaires possibles de la crème Zovirax ?
Les effets secondaires les plus fréquents de la crème Zovirax sont des réactions cutanées au site de traitement et peuvent inclure : des lèvres sèches ou fissurées, une desquamation, une desquamation ou une sécheresse de la peau, une sensation de brûlure ou de piqûre et des démangeaisons.
Ce ne sont pas tous les effets secondaires possibles de la crème Zovirax. Appelez votre médecin pour obtenir un avis médical sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver la crème Zovirax ?
– Conservez la crème Zovirax à la température ambiante entre 68° et 77°F (20° et 25°C).
Gardez la crème Zovirax et tous les médicaments hors de portée des enfants.
Informations générales sur l’utilisation sûre et efficace de la crème Zovirax.
Les médicaments sont parfois prescrits à des fins autres que celles mentionnées dans une notice d’information destinée aux patients. N’utilisez pas la crème Zovirax pour une affection pour laquelle elle n’a pas été prescrite. Ne donnez pas Zovirax Cream à d’autres personnes, même si elles présentent les mêmes symptômes que vous. Elle pourrait leur nuire. Vous pouvez demander à votre pharmacien ou à votre prestataire de soins de santé des informations sur Zovirax Cream qui sont écrites pour les professionnels de la santé.
Quels sont les ingrédients de Zovirax Cream ?
Ingrédient actif : acyclovir
Ingrédients inactifs : alcool cétostéarylique, huile minérale, poloxamère 407, propylèneglycol, laurylsulfate de sodium, eau et pétrolatum blanc
Distribué par : Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Fabriqué par : Bausch Health Companies Inc.
Laval, Québec H7L 4A8, Canada
Zovirax est une marque déposée du groupe GlaxoSmithKline utilisée sous licence par Bausch Health.
© 2020 Bausch Health Companies Inc. ou ses sociétés affiliées
Pour plus d’information, composez le 1-800-321-4576.
Cette information destinée aux patients a été approuvée par la Food and Drug Administration des États-Unis.
Révisé : 12/2020
9462203
Panneau d’affichage principal – Carton de tubes de 5 g
ZOVIRAX®
(ACYCLOVIR) CRÈME 5%
NDC 0187-0994-45
Poids net. 5 g
Chaque gramme contient :
50 mg d’acyclovir, alcool cétostéarylique, huile minérale, poloxamère 407, propylène glycol, laurylsulfate de sodium, eau et pétrolatum blanc.
Utiliser uniquement pour les SORES FROIDES.
Pour usage cutané uniquement.
Ortho Dermatologics
Rx only
| ZOVIRAX crème d’acyclovir |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Étiqueteur – Bausch Health US, LLC (831922468)
| Etablissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| Bausch Health Companies Inc. | 245141858 | MANUFACTURE(0187-0994) | |
Plus d’informations sur Zovirax Cream (acyclovir topical)
- Effets secondaires
- Grossesse ou allaitement
- Informations sur la posologie
- Interactions médicamenteuses
- Prix & Coupons
- 39 avis
- Classe de médicaments : antiviraux topiques
Ressources pour le consommateur
- Information pour le patient
Ressources pour le professionnel
- Informations sur la prescription
- Pommade à l’acyclovir (FDA)
.
Autres formulations
- Zovirax
- Zovirax en pommade
Guides de traitement associés
- Herpès Simplex
- Ampéromes froids
Avis médical
.