Des signaux intracellulaires, tels que des dommages à l’ADN de la cellule, conduisent l’apoptose principalement par la voie intrinsèque. La voie intrinsèque de l’apoptose, qui implique des protéines de signalisation conservées, est physiquement associée aux mitochondries et, chez les vertébrés, est sensible au stress oxydatif mitochondrial. La voie est influencée par les membres de la famille Bcl liés à la membrane mitochondriale, notamment le gène Bax et Bcl-2, qui agissent respectivement comme des protéines régulatrices pro- ou anti-apoptotiques.
Vue d’ensemble de la voie d’apoptose intrinsèque
La voie d’apoptose intrinsèque est initiée, par exemple, par la chimiothérapie et/ou la radiothérapie. Elle est activée par une série de stimuli exogènes et endogènes, tels que les lésions de l’ADN, l’ischémie et le stress oxydatif. De plus, elle joue une fonction importante dans le développement et dans l’élimination des cellules endommagées.
Dans la voie intrinsèque, la conséquence fonctionnelle de la signalisation pro-apoptotique est la perturbation de la membrane mitochondriale et la libération du cytochrome c dans le cytoplasme, où il forme un complexe ou apoptosome avec le facteur d’activation de la protéase apoptotique 1 (APAF1) et la forme inactive de la caspase-9. Ce complexe hydrolyse l’adénosine triphosphate pour cliver et activer la caspase-9. La caspase-9 initiatrice clive et active ensuite les caspases-3/6/7 exécutrices, ce qui entraîne l’apoptose cellulaire. C’est totalement différent des signaux extracellulaires, qui sont généralement générés par les cellules cytotoxiques du système immunitaire et déclenchent l’apoptose principalement par la voie extrinsèque.
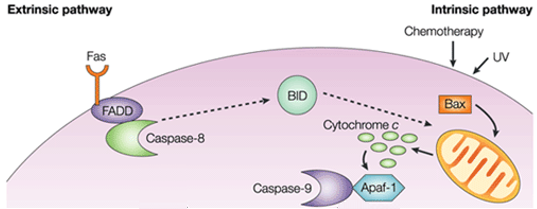
Figure 1. Différence entre la voie extrinsèque et la voie intrinsèque.
Processus et régulation de la voie d’apoptose intrinsèque
La voie d’apoptose intrinsèque induit l’apoptose en activant directement la caspase-3 ou en clivant le bid (agoniste de mort à domaine d’interaction BH3), ce qui entraîne un dysfonctionnement mitochondrial et la libération ultérieure de cytochrome c et l’activation des caspases-9 et des caspases-3. La caspase-3 favorise les caractéristiques typiques de l’apoptose, notamment la fragmentation de l’ADN et la mort cellulaire dans plusieurs tissus.
La famille de protéines du lymphome à cellules B 2 (Bcl-2) contrôle étroitement l’activation de la voie intrinsèque. Elle est présente dans les lymphomes folliculaires et a été identifiée pour la première fois comme l’un des gènes impliqués dans la mort cellulaire en activant l’apoptose pro-apoptotique ou en inhibant l’apoptose anti-apoptotique. Les protéines d’un sous-groupe, dont Bid, Bad, Bim, Bmf, Puma et Noxa, contiennent un seul domaine d’homologie 3 de Bcl-2 (protéines BH3 uniquement) et ont une activité pro-apoptotique. Deux autres sous-ensembles de protéines possèdent plusieurs domaines BH. Le premier sous-ensemble, comprenant la protéine X associée à Bcl-2 (Bax), l’antagoniste/tueur homologue de Bcl-2 (Bak) et le régulateur d’apoptose de la famille Bcl-2 (Bok), est pro-apoptotique ; l’autre sous-ensemble, comprenant Bcl-2, Bcl-XL et Mcl-1, est anti-apoptotique. La voie mitochondriale est en partie influencée par les membres de la famille Bcl liés à la membrane mitochondriale, y compris les protéines régulatrices pro-apoptotiques Bax et les protéines régulatrices anti-apoptotiques Bcl-2.
Les molécules pro-apoptotiques provoquent la perméabilisation de la membrane mitochondriale externe, entraînant l’efflux du cytochrome c, qui se lie à l’adaptateur Apaf-1 et à l’initiateur caspase-9 dans le cytosol pour former le complexe apoptosome. Cela stimule la caspase-9, qui active à son tour les caspases effectrices. La mitochondrie libère également une protéine appelée Smac/DIABLO dans le cytosol. Smac/DIABLO favorise indirectement l’apoptose en bloquant les effets d’un groupe de protéines anti-apoptotiques appelées protéines inhibitrices de l’apoptose (IAP).
Les protéines anti-apoptotiques Bcl-2 et Bcl-XL inhibent la libération du cytochrome c, tandis que Bax, Bak et Bid, toutes des protéines pro-apoptotiques, favorisent sa libération par les mitochondries. Le cytochrome c et le désoxyadénosine triphosphate (dATP) se lient à l’APAF-1 pour former un complexe multimérique qui recrute et active la pro-caspase-9, une protéase exécutrice médiatrice de l’apoptose qui active à son tour la cascade des caspases, entraînant l’apoptose cellulaire. Au cours de ce processus, la caspase-2, la caspase-8, la caspase-9 et la caspase-10 sont impliquées dans l’initiation de l’apoptose. La caspase-3, la caspase-6 et la caspase-7 sont impliquées dans l’apoptose. La caspase-3 et la caspase-7 régulent l’inhibition de la réparation de l’ADN et déclenchent la dégradation de l’ADN. En outre, la caspase-6 régule la désintégration de la lamelle et du cytosquelette.
Voie apoptotique intrinsèque en physiopathologie
La plupart des thérapies chimiothérapeutiques et ciblées contre le cancer tuent les cellules tumorales par la génération d’une signalisation pro-mort qui initie la voie apoptotique intrinsèque de la mort cellulaire programmée. Le point de non-retour dans la cascade apoptotique est la perméabilisation de la membrane externe de la mitochondrie (MOMP) ; une fois qu’elle s’est produite, la perméabilisation de la mitochondrie entraîne la formation d’un apoptosome, qui facilite l’activation des caspases et déclenche ensuite les autres caractéristiques de la mort cellulaire apoptotique. La décision cellulaire d’initier la MOMP est contrôlée par un équilibre délicat entre les molécules pro- et anti-apoptotiques de la famille BCL-2.
L’une des raisons de la résistance à la chimiothérapie est l’incapacité des cellules tumorales à entrer en apoptose en raison de défauts dans la voie apoptotique intrinsèque (par exemple, des modifications de p53). Malgré des améliorations significatives du traitement, les taux de guérison de nombreux cancers restent sous-optimaux. L’essor de la chimiothérapie cytotoxique a conduit à une thérapie curative pour un sous-ensemble de cancers, bien que la résistance intrinsèque au traitement soit difficile à prévoir pour chaque patient. La vague de thérapies moléculaires ciblées s’est concentrée sur les mutations activant les médicaments et est donc limitée à des sous-ensembles spécifiques de patients. La voie mitochondriale intrinsèque de l’apoptose représente une cible prometteuse pour les nouvelles thérapies, et le fait de réussir à cibler cette voie a le potentiel de modifier le paysage thérapeutique pour une variété de cancers.