Objectifs d’apprentissage
- Relier les configurations électroniques des éléments à la forme du tableau périodique.
- Déterminer la configuration électronique attendue d’un élément par sa place sur le tableau périodique.
Au chapitre 3 « Atomes, molécules et ions », nous avons présenté le tableau périodique comme un outil pour organiser les éléments chimiques connus. Un tableau périodique est illustré à la figure 8.11 « Le tableau périodique ». Les éléments sont classés par numéro atomique (le nombre de protons dans le noyau), et les éléments ayant des propriétés chimiques similaires sont regroupés en colonnes.
Figure 8.11 Le tableau périodique
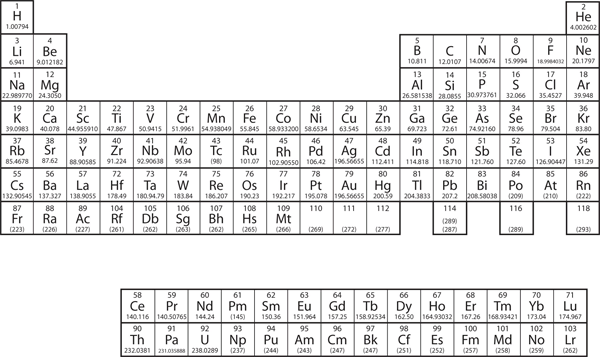
Pourquoi le tableau périodique a-t-il la structure qu’il a ? La réponse est assez simple, si vous comprenez les configurations électroniques : la forme du tableau périodique imite le remplissage des sous-coquilles avec des électrons.
Commençons par H et He. Leurs configurations électroniques sont respectivement 1s1 et 1s2 ; avec He, la coquille n = 1 est remplie. Ces deux éléments constituent la première rangée du tableau périodique (voir figure 8.12 « Le 1 »).
Figure 8.12 La sous-coquille 1s
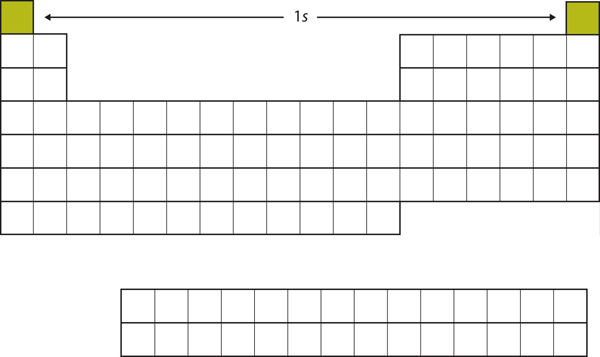
H et He représentent le remplissage de la sous-coquille 1s.
Les deux électrons suivants, pour Li et Be, iraient dans la sous-coquille 2s. La figure 8.13 « Le 2 » montre que ces deux éléments sont adjacents sur le tableau périodique.
Figure 8.13 La sous coque 2s
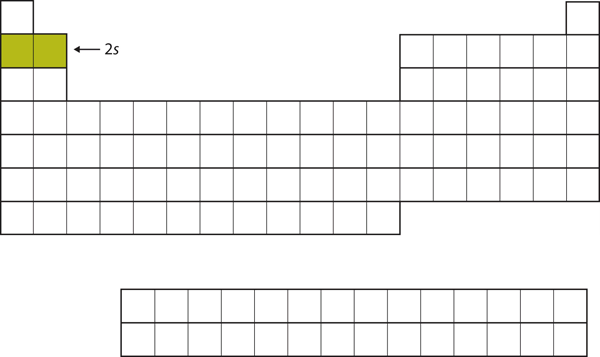
Dans Li et Be, la sous coque 2s est en train d’être remplie.
Pour les six éléments suivants, la sous coque 2p est en train d’être occupée par des électrons. Sur le côté droit du tableau périodique, ces six éléments (B à Ne) sont regroupés (figure 8.14 « Le 2 »).
Figure 8.14 La sous coque 2p
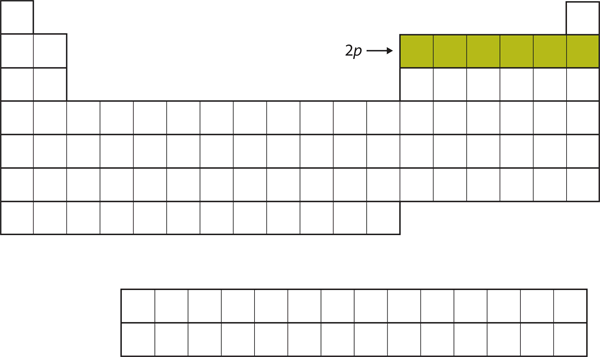
Pour B à Ne, la sous coque 2p est occupée.
La prochaine sous coque à être remplie est la sous coque 3s. Les éléments lorsque cette sous coquille est remplie, Na et Mg, sont de retour sur le côté gauche du tableau périodique (figure 8.15 « Le 3 »).
Figure 8.15 La sous-coquille 3s
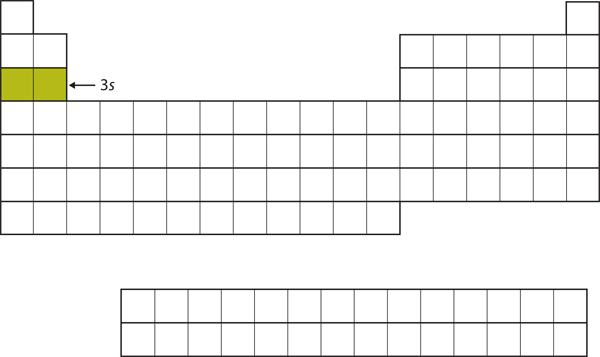
Maintenant, la sous-coquille 3s est occupée.
Puis, la sous-coquille 3p est remplie avec les six éléments suivants (figure 8.16 « Le 3 »).
Figure 8.16 La sous coque 3p
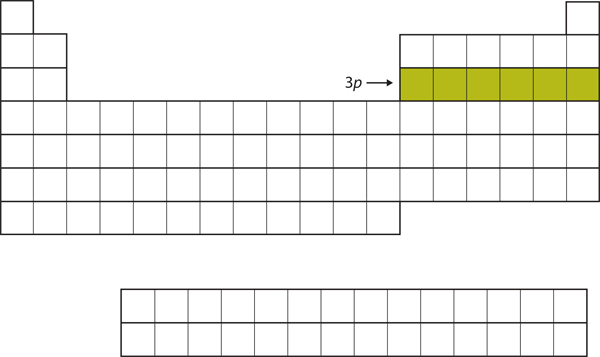
Puis, la sous coque 3p est remplie d’électrons.
Au lieu de remplir ensuite la sous coque 3d, les électrons vont dans la sous coque 4s (figure 8.17 « La 4 »).
Figure 8.17 La sous coque 4s
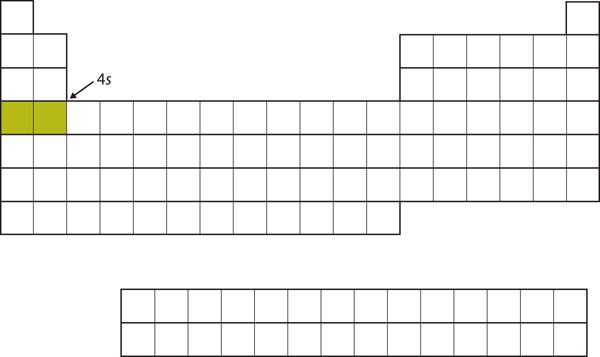
La sous coque 4s est remplie avant la sous coque 3d. Cela se reflète dans la structure du tableau périodique.
Après le remplissage de la sous coque 4s, la sous coque 3d est remplie avec jusqu’à 10 électrons. Cela explique la section de 10 éléments au milieu du tableau périodique (figure 8.18 « Le 3 »).
Figure 8.18 La sous coque 3d
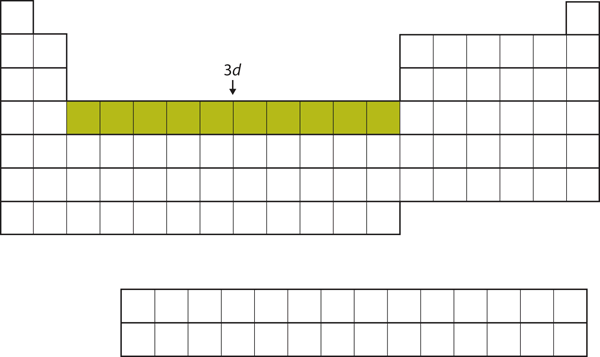
La sous coque 3d est remplie dans la section du milieu du tableau périodique.
Et ainsi de suite. Au fur et à mesure que nous traversons les rangées du tableau périodique, la forme globale du tableau décrit comment les électrons occupent les coquilles et les sous-coquilles.
Les deux premières colonnes du côté gauche du tableau périodique sont celles où les sous-coquilles s sont occupées. Pour cette raison, les deux premières rangées du tableau périodique sont appelées le bloc s. De même, le bloc p correspond aux six colonnes les plus à droite du tableau périodique, le bloc d correspond aux 10 colonnes du milieu du tableau périodique, tandis que le bloc f correspond à la section de 14 colonnes qui est normalement représentée comme détachée du corps principal du tableau périodique. Il pourrait faire partie du corps principal, mais le tableau périodique serait alors plutôt long et encombrant. La figure 8.19 « Blocs du tableau périodique » montre les blocs du tableau périodique.
Figure 8.19 Blocs du tableau périodique
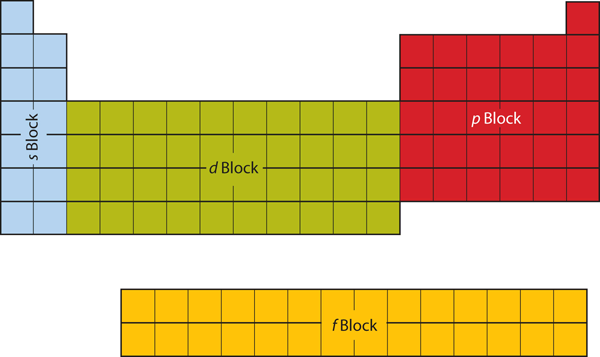
Le tableau périodique est séparé en blocs selon la sous-coquille qui est remplie pour les atomes qui appartiennent à cette section.
Les électrons de la coquille la plus élevée, plus les électrons de la dernière sous-coquille non remplie, sont appelés électrons de valence ; la coquille la plus élevée est appelée coquille de valence. (Les électrons internes sont appelés électrons de noyau.) Les électrons de valence contrôlent en grande partie la chimie d’un atome. Si nous examinons uniquement la configuration électronique de la coquille de valence, nous constatons que dans chaque colonne, la configuration électronique de la coquille de valence est la même. Par exemple, prenez les éléments de la première colonne du tableau périodique : H, Li, Na, K, Rb et Cs. Leurs configurations électroniques (abrégées pour les plus gros atomes) sont les suivantes, la configuration électronique de la couche de valence étant mise en évidence :
| H: | 1s1 |
| Li: | 1s22s1 |
| Na : | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs : | 6s1 |
Ils ont tous une configuration électronique similaire dans leur coquille de valence : un seul électron s. Comme une grande partie de la chimie d’un élément est influencée par les électrons de valence, on pourrait s’attendre à ce que ces éléments aient une chimie similaire – et c’est le cas. L’organisation des électrons dans les atomes explique non seulement la forme du tableau périodique mais aussi le fait que les éléments de la même colonne du tableau périodique ont une chimie similaire.
Le même concept s’applique aux autres colonnes du tableau périodique. Les éléments de chaque colonne ont les mêmes configurations électroniques de la coquille de valence, et les éléments ont certaines propriétés chimiques similaires. Ceci est strictement vrai pour tous les éléments des blocs s et p. Dans les blocs d et f, comme il existe des exceptions à l’ordre de remplissage des sous-coquilles par les électrons, la similitude des coquilles de valence n’est pas absolue dans ces blocs. Cependant, de nombreuses similitudes existent dans ces blocs, de sorte qu’une similitude des propriétés chimiques est attendue.
La similitude de la configuration électronique de la coquille de valence implique que nous pouvons déterminer la configuration électronique d’un atome uniquement par sa position sur le tableau périodique. Prenons l’exemple de Se, comme le montre la figure 8.20 » Le sélénium dans le tableau périodique « . Il se trouve dans la quatrième colonne du bloc p. Cela signifie que sa configuration électronique devrait se terminer par une configuration électronique p4. En effet, la configuration électronique de Se est 4s23d104p4, comme prévu.
Figure 8.20 Sélénium sur le tableau périodique
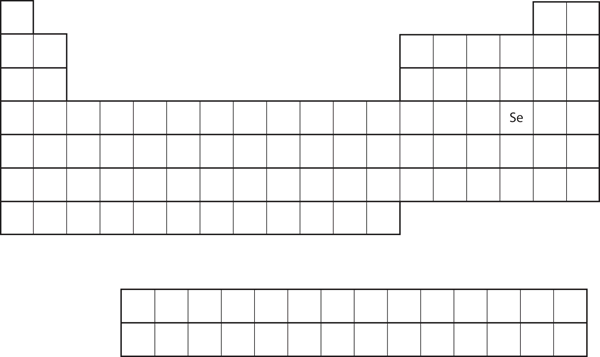
Exemple 8
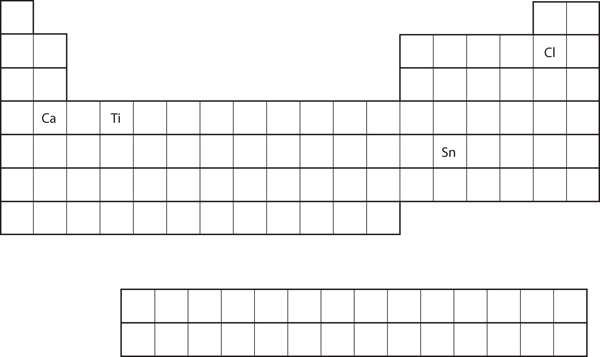
À partir de la position de l’élément sur le tableau périodique, prédisez la configuration électronique de la coquille de valence pour chaque atome. Voir la figure 8.21 « Différents éléments sur le tableau périodique ».
- Ca
- Sn
Solution
- Ca est situé dans la deuxième colonne du bloc s. On s’attendrait à ce que sa configuration électronique se termine par s2. La configuration électronique du calcium est 4s2.
- Sn est situé dans la deuxième colonne du bloc p, nous nous attendons donc à ce que sa configuration électronique se termine par p2. La configuration électronique de l’étain est 5s24d105p2.
Testez vous-même
À partir de la position de l’élément sur le tableau périodique, prédisez la configuration électronique de la coquille de valence pour chaque atome. Voir la figure 8.21 « Divers éléments du tableau périodique ».
- Ti
- Cl
Réponse
- 4s23d2
- 3s23p5
Figure 8.21 Divers éléments du tableau périodique
Application aux aliments et boissons : Couleurs artificielles
La couleur des objets provient d’un mécanisme différent de celui des couleurs des néons et autres lumières à décharge. Bien que les lumières colorées produisent leurs couleurs, les objets sont colorés parce qu’ils reflètent préférentiellement une certaine couleur de la lumière blanche qui les éclaire. Une tomate rouge, par exemple, est rouge vif parce qu’elle reflète la lumière rouge tout en absorbant toutes les autres couleurs de l’arc-en-ciel.
De nombreux aliments, comme les tomates, sont très colorés ; en fait, l’affirmation courante « on mange d’abord avec les yeux » est une reconnaissance implicite que l’attrait visuel des aliments est tout aussi important que leur goût. Mais qu’en est-il des aliments transformés ?
De nombreux aliments transformés sont additionnés de colorants alimentaires. Il existe deux types de colorants alimentaires : naturels et artificiels. Les colorants alimentaires naturels comprennent le sucre caramélisé pour le brun ; le rocou, le curcuma et le safran pour diverses nuances d’orange ou de jaune ; la bétanine des betteraves pour le violet ; et même le carmin, un colorant rouge profond qui est extrait de la cochenille, un petit insecte parasite des cactus en Amérique centrale et en Amérique du Sud. (C’est vrai : vous mangez peut-être du jus d’insecte !)
Certains colorants sont artificiels. Aux États-Unis, la Food and Drug Administration n’approuve actuellement que sept composés comme colorants artificiels dans les aliments, les boissons et les cosmétiques :
- FD&C Bleu #1 : Brilliant Blue FCF
- FD&C Bleu #2 : Indigotine
- FD&C Vert #3 : Vert rapide FCF
- RD&C Rouge #3 : Erythrosine
- FD&C Rouge #40 : Allura Red AC
- FD&C Jaune #5 : Tartrazine
- FD&C Jaune #6 : Sunset Yellow FCF
Les colorants portant un numéro inférieur ne sont plus sur le marché ou ont été retirés pour diverses raisons. Généralement, ces colorants artificiels sont de grosses molécules qui absorbent très fortement certaines couleurs de la lumière, ce qui les rend utiles même à de très faibles concentrations dans les aliments et les cosmétiques. Même à de si faibles concentrations, certains critiques affirment qu’une petite partie de la population (en particulier les enfants) est sensible aux colorants artificiels et demandent instamment que leur utilisation soit réduite ou arrêtée. Cependant, les études formelles sur les colorants artificiels et leurs effets sur le comportement n’ont pas été concluantes ou contradictoires. Malgré cela, la plupart des gens continuent à apprécier les aliments transformés contenant des colorants artificiels (comme ceux présentés dans la figure ci-jointe).

Les colorants alimentaires artificiels sont présents dans une variété de produits alimentaires, tels que les aliments transformés, les bonbons et les colorants pour œufs. Même les aliments pour animaux de compagnie contiennent des colorants alimentaires artificiels, même s’il est probable que l’animal s’en moque !
Source : Photo courtoisie de Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Renseignements clés
- L’arrangement des électrons dans les atomes est responsable de la forme du tableau périodique.
- Les configurations des électrons peuvent être prédites par la position d’un atome sur le tableau périodique.
Exercices
-
Où sur le tableau périodique les s sous-coquilles sont-elles occupées par des électrons ?
-
Où sur le tableau périodique les sous coques d sont-elles occupées par des électrons ?
-
Dans quel bloc se trouve Ra ?
-
Dans quel bloc se trouve Br ?
-
Quelles sont les configurations électroniques de la coquille de valence des éléments de la deuxième colonne du tableau périodique ?
-
Quelles sont les configurations électroniques de l’enveloppe de valence des éléments de l’avant-dernière colonne du tableau périodique ?
-
Quelles sont les configurations électroniques de l’enveloppe de valence des éléments de la première colonne du bloc p ?
-
Quelles sont les configurations électroniques de l’enveloppe de valence des éléments de la dernière colonne du bloc p ?
-
À partir de la position de l’élément sur le tableau périodique, prédire la configuration électronique de chaque atome.
a) Sr
b) S
10. A partir de la position de l’élément sur le tableau périodique, prédire la configuration électronique de chaque atome.
a) Fe
b) Ba
11. A partir de la position de l’élément sur le tableau périodique, prédire la configuration électronique de chaque atome.
a) V
b) Ar
12. A partir de la position de l’élément sur le tableau périodique, prédire la configuration électronique de chaque atome.
a) Cl
b) K
13. A partir de la position de l’élément sur le tableau périodique, prédire la configuration électronique de chaque atome.
a) Ge
b) C
14. A partir de la position de l’élément sur le tableau périodique, prédisez la configuration électronique de chaque atome.
a) Mg
b) I
Réponses
les deux premières colonnes
le bloc s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2