Introduction
Les protéines bêta-amyloïde et tau phosphorylée sont des marques pathologiques de la maladie d’Alzheimer (MA) qui s’accumulent et se propagent de manière prévisible dans les réseaux neuronaux distribués, provoquant des anomalies métaboliques progressives, des lésions neuronales et la mort cellulaire. La neuro-imagerie facilite une évaluation détaillée de ces changements pathologiques chez les patients qui subissent un bilan pour un déclin cognitif. Auparavant, le diagnostic définitif de la MA n’était possible que par l’observation post-mortem et la mise en évidence neuro-anatomique de ces agrégats protéiques. Cependant, les progrès récents de l’imagerie moléculaire permettent de visualiser les dépôts amyloïdes et tau dans le cerveau humain vivant et nous ont rapprochés d’un diagnostic définitif in vivo de la MA.
Imagerie structurelle
Les directives de l’American Academy of Neurology (AAN) pour le bilan diagnostique des personnes ayant des plaintes cognitives1 recommandent l’imagerie cérébrale structurelle par CT ou IRM sans contraste chez toute personne ayant une histoire clinique positive et des changements cognitifs objectifs. Dans ce contexte, le rôle principal de l’imagerie cérébrale est d’exclure les lésions structurelles non dégénératives, dont 5 % peuvent ne pas être mises en évidence par l’histoire clinique ou l’examen physique2 et sont potentiellement traitables. L’AAN recommande également d’exclure cliniquement la démence vasculaire (VaD), la démence à corps de Lewy (DLB) et la démence frontotemporale (FTD). L’imagerie structurelle peut améliorer la certitude diagnostique et modifier le diagnostic clinique dans 19 % à 28 % des cas, ainsi que la prise en charge de 15 % des cas cliniques.2
Les modalités d’imagerie de choix pour évaluer l’atrophie structurelle sont la tomodensitométrie et l’IRM. Les modèles d’atrophie spécifiques à la maladie ont été minutieusement décrits et validés à l’aide de ces modalités. Bien que l’atrophie soit observable au scanner, la résolution spatiale intrinsèquement plus faible et le contraste inférieur entre la matière grise et la matière blanche entraînent la perte d’observations subtiles potentiellement utiles concernant les changements neurodégénératifs. Par conséquent, les cliniciens s’appuient souvent sur l’IRM pour évaluer le schéma et la gravité des changements structurels, pour écarter les causes non neurodégénératives du déclin cognitif et pour évaluer la gravité et l’étendue des changements de la substance blanche, comme nous le verrons plus en détail ci-dessous.
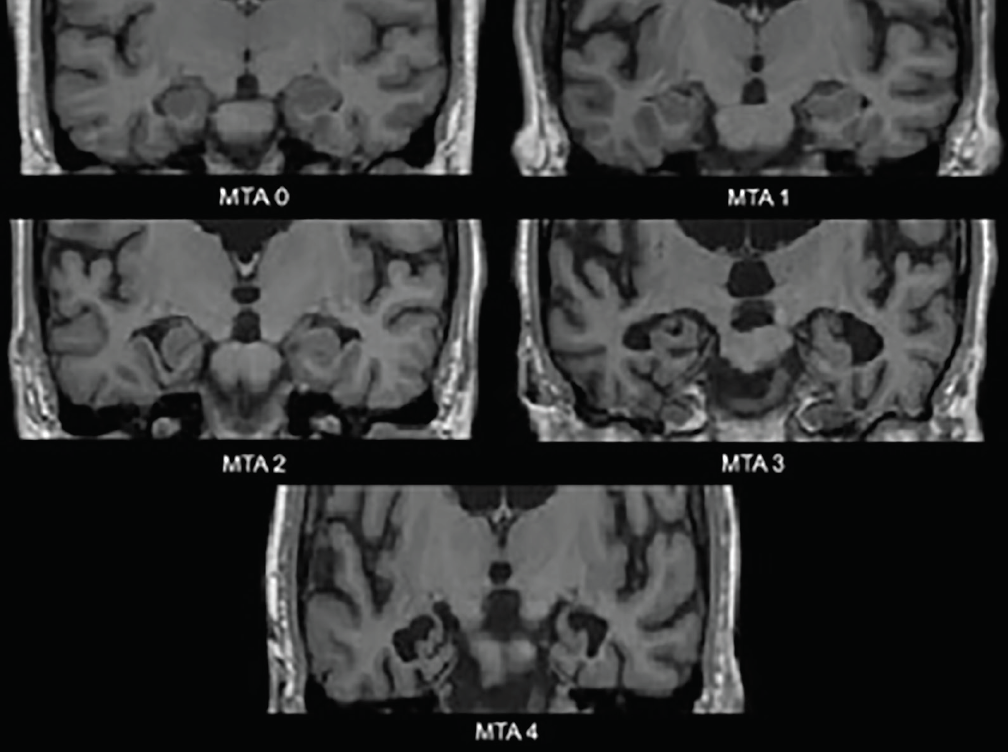
Les changements neurodégénératifs les plus précoces dans la MA se produisent dans les lobes temporaux médians – l’hippocampe, le cortex entorhinal et le gyrus parahippocampique. Au fur et à mesure que l’atrophie s’installe, la fissure choroïde et la corne temporale du ventricule latéral se dilatent ; ces changements sont mieux évalués dans le plan coronal. Une échelle d’évaluation visuelle couramment utilisée et basée sur ces structures – l’échelle d’atrophie temporale médiane (ATM) (figure 1) – a été validée cliniquement3 et neuropathologiquement4. Diverses études utilisant cette échelle ou les structures qu’elle évalue ont montré une capacité significative à distinguer les personnes atteintes de la MA des témoins appariés selon l’âge4 ou de celles atteintes de DLB4 ou de troubles cognitifs vasculaires (VCI).5 L’atrophie temporale médiane est également prédictive de la conversion d’un trouble cognitif léger amnésique (MCI) en démence d’Alzheimer.3
Cliquez pour agrandir
Figure 1. Échelle d’évaluation de l’atrophie temporale médiane (ATM). ATM 0-pas de glissement ou glissement minime de la fissure choroïde ; ATM 1-élargissement subtil de la fissure choroïde ; ATM 2-élargissement plus important de la fissure choroïde qui fusionne avec la corne temporale du ventricule latéral, légère diminution de la hauteur de la formation hippocampique ; ATM 3- diminution modérée de la hauteur de la formation hippocampique, élargissement proéminent de la corne temporale du ventricule latéral ; ATM 4-sévère diminution de la hauteur de la formation hippocampique, élargissement proéminent de la corne temporale du ventricule latéral.
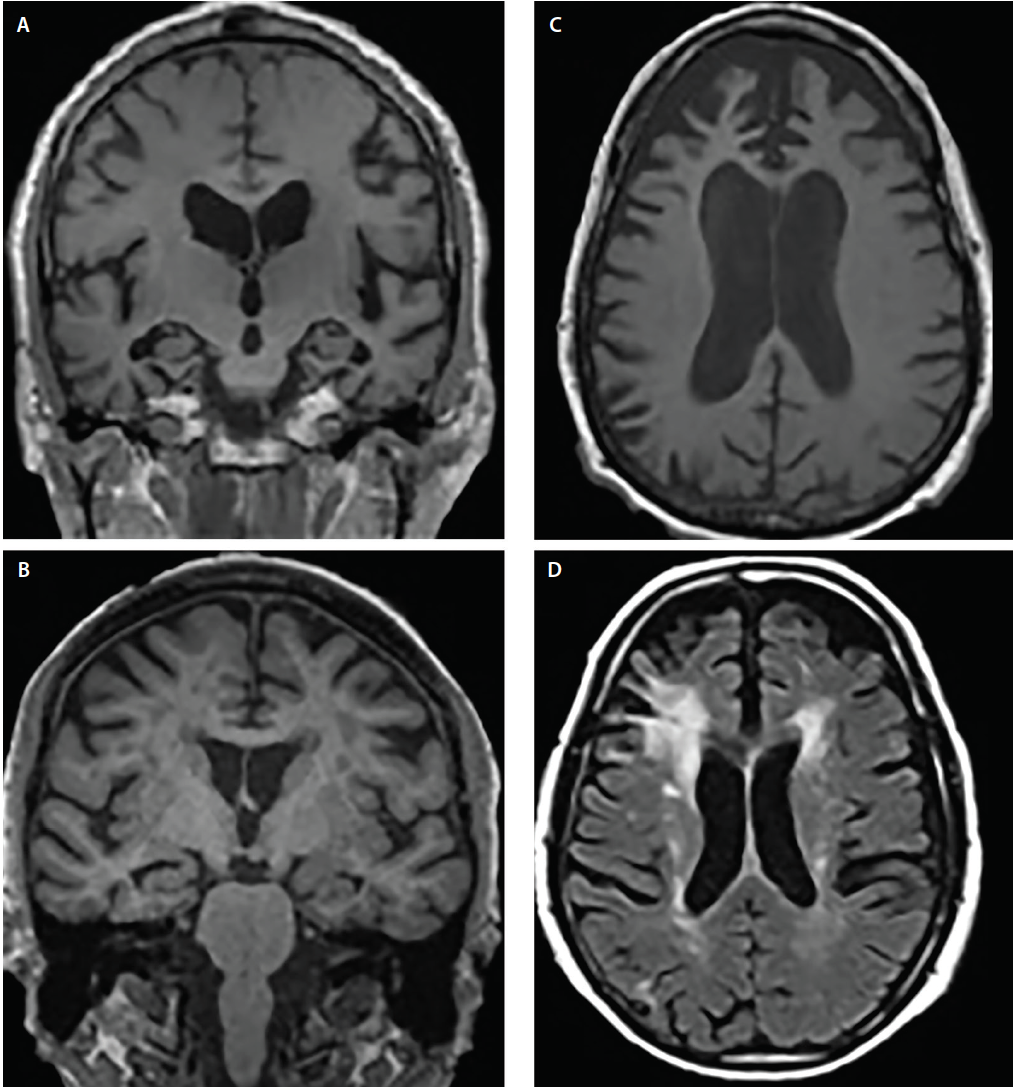
Les syndromes de démence présentent généralement des schémas d’atrophie canoniques6 qui correspondent aux symptômes cognitifs et comportementaux ; cependant, les structures impliquées peuvent se chevaucher. Par exemple, la MA et la DLB présentent toutes deux une atteinte du lobe temporal médian, mais plusieurs études d’imagerie et de neuropathologie ont montré que, par rapport à la MA, la DLB présente une prédilection nettement moindre pour les structures temporales médianes4,5 (figure 2).
Cliquez pour agrandir
Figure 2. Modèles d’atrophie structurelle à travers la maladie d’Alzheimer (AD) (A), la démence à corps de Lewy (DLB) (B), la démence frontotemporale (FTD) (C) et la démence vasculaire (VaD) (D). L’IRM coronale pondérée en T1 montre une atrophie corticale généralisée mais des degrés différents d’atrophie de l’hippocampe dans la MA (A) et la DLB (B). L’IRM axiale pondérée en T1 montre une atrophie bvFTD avec une prédilection focale pour les cortex préfrontal médial et latéral (C). L’IRM axiale pondérée en T2 démontre des hypointensifications de la substance blanche (HMW) confluentes de la calotte périventriculaire et du halo impliquant la corona radiata et s’étendant au néocortex préfrontal latéral, de légères HMW dispersées et des HMW de la paroi ventriculaire sous-épendymaire et du septum pellucidum dans la VaD (D).
La MA et la dégénérescence lobaire fronto-temporale (DLFT) présentent toutes deux des régions d’atrophie qui se chevauchent, notamment des zones des cortex préfrontal, orbitofrontal et insulaire antérieur, ainsi que des lobes temporaux antérieurs et médians6. Cependant, la maladie d’Alzheimer présente une atrophie significativement plus importante dans les cortex pariétal et occipital latéraux, tandis que la maladie d’Alzheimer et des maladies apparentées présente une atrophie plus importante dans les lobes frontaux (Figure 2).6
Il est important d’évaluer systématiquement toutes les zones du cerveau, en notant les régions d’atrophie structurelle et d’épargnes anatomiques afin d’utiliser au mieux l’imagerie diagnostique. Une vaste étude multicentrique a récemment évalué la capacité de 6 échelles d’évaluation visuelle à classer correctement 186 cas pathologiquement confirmés de MA, DLB et FTLD.6 Cette étude a montré que l’évaluation simultanée de plusieurs régions spécifiques de la maladie fournissait une discrimination significativement meilleure que de se concentrer sur une seule région.4
Les dommages vasculaires sont une considération importante lors de l’évaluation des personnes atteintes de troubles cognitifs. Les changements ischémiques sont courants dans le vieillissement normal et sont accélérés par les comorbidités communes (par exemple, l’hypertension, le diabète et l’hypercholestérolémie). Les contributions vasculaires aux troubles cognitifs sont souvent déduites lorsque des hyperintensités significatives de la substance blanche (WMH), des accidents vasculaires cérébraux corticaux ou des lacunes stratégiquement situées sont détectés sur des séquences pondérées en T2 ou des séquences FLAIR (fluid attenuated inversion recovery). Les accidents lacunaires des ganglions de la base et les HMM dans le centrum semiovale et la corona radiata sont des indicateurs de lésions ischémiques chroniques des petits vaisseaux (Figure 2). En revanche, les calottes périventriculaires sont souvent d’origine non ischémique et reflètent une gliose sous-épendymaire.7 Il existe plusieurs échelles de gravité des HMM (par exemple, l’échelle de Fazekas)7 qui peuvent être utilisées en milieu clinique. Ces algorithmes de notation s’accordent tous sur le fait que les HMM confluentes étendues et les infarctus lacunaires sous-corticaux sont, au moins en partie, susceptibles de contribuer au déclin cognitif.7
L’imagerie du tenseur de diffusion (ITD) est une nouvelle séquence d’IRM sensible à la diffusion de l’eau dans les tissus qui évalue l’intégrité de la substance blanche car l’architecture des axones contraint le flux d’eau. Les mesures de diffusivité moyenne et d’anisotropie fractionnelle sont souvent utilisées pour caractériser les changements neurodégénératifs sur l’ITD. La première mesure l’ampleur de la diffusion et la seconde indique si l’eau s’écoule préférentiellement dans une seule direction, comme on s’y attend dans les axones sains. Une diminution de la diffusivité moyenne et une réduction de l’anisotropie fractionnelle ont été régulièrement signalées dans les populations de patients atteints de MCI et de démence MA.8 Plusieurs études ont également identifié des modifications de l’ITD chez des personnes asymptomatiques présentant un risque de développer la MA9, ce qui indique que ces modifications surviennent à un stade précoce de la maladie. Outre l’évaluation de l’intégrité de la substance blanche, l’ITD peut être utilisée pour modéliser la connectivité structurelle brute entre les régions corticales à l’aide d’algorithmes de tractographie. Cette technique a gagné en popularité dans le domaine de la MA, car des preuves suggèrent que la pathologie amyloïde et tau peut se propager via les connexions cérébrales.10 Bien que la DTI montre un potentiel en tant que mesure de l’intégrité de la substance blanche, sa sensibilité au mouvement et d’autres contraintes techniques, limitent, au moins pour le moment, son application clinique.
Imagerie fonctionnelle
L’hypométabolisme cérébral est facilement observé dans les troubles neurodégénératifs et peut aider au diagnostic différentiel. La fonction des neurones dépend de l’oxygène et du glucose provenant du sang, dont l’apport est facilité par la vasodilatation régionale. La tomographie par émission de positons au 18F-fluorodéoxyglucose (FDG-PET) reflète indirectement le degré d’activité corticale et peut facilement être utilisée pour visualiser les changements neurodégénératifs en exploitant cette dépendance métabolique au glucose.
La signature corticale hypométabolique caractéristique de la MA consiste en des changements précoces dans le cingulaire postérieur (PCC) ; le précuneus ; les cortex temporal, pariétal et, à des stades plus avancés, frontal. Contrairement à la MA, la signature métabolique de la DFT révèle un hypométabolisme frontal, temporal antérieur, ganglionnaire basal et thalamique, avec une épargne relative des cortex d’association postérieurs13. Dans des situations cliniquement incertaines, les cliniciens peuvent utiliser ces signatures métaboliques pour distinguer la MA de la DFT.12 De même, bien que la signature métabolique néocorticale de la DLB puisse présenter un chevauchement confondant avec celle de la MA, les cas de DLB peuvent également présenter un hypométabolisme occipital14.
Le Center for Medicare & Medicaid Services juge la TEP-FDG » raisonnable et nécessaire » uniquement pour les personnes répondant aux critères de la MA et de la DFT, chez qui un bilan diagnostique complet selon les directives de l’AAN1 n’a pas permis d’établir définitivement une étiologie.15
L’IRM fonctionnelle (IRMf) peut également mesurer l’activité cérébrale en utilisant des séquences sensibles aux changements temporels de l’hémoglobine oxygénée/désoxygénée dus à l’activité cérébrale. De cette façon, l’IRMf est liée à la TEP-FDG, car les modifications de l’hémoglobine sont dues au métabolisme du glucose nécessaire à l’activité cérébrale. Les dépendances temporelles entre les régions peuvent être utilisées pour déduire la connectivité fonctionnelle (c’est-à-dire les régions qui communiquent activement). Par rapport à la TEP-FDG, l’IRMf offre une meilleure résolution spatiale, ce qui permet une cartographie plus précise de la connectivité. Un autre avantage de l’IRMf est qu’elle peut être acquise pendant l’exécution d’une tâche ou au repos. Le premier cas identifie les schémas de connectivité induits par des états actifs spécifiques, tandis que le second identifie les schémas de connectivité présents au repos, connus sous le nom de réseau de mode par défaut (DMN). Le DMN est défini par des centres fonctionnels, le PCC et le précuneus, qui se connectent à un sous-système médian dorsal et à un sous-système temporal médian.16 On pense que le dépôt d’amyloïde commence dans les centres fonctionnels du DMN. On sait que le DMN est affecté dans la MA.16 En revanche, le DMN est épargné dans la DFT alors que les réseaux de saillance ou d’attention sont affectés.17 Actuellement, la technologie IRMf est limitée aux applications de recherche, mais des pistes pour développer des algorithmes pertinents applicables en clinique sont activement explorées.
Imagerie moléculaire
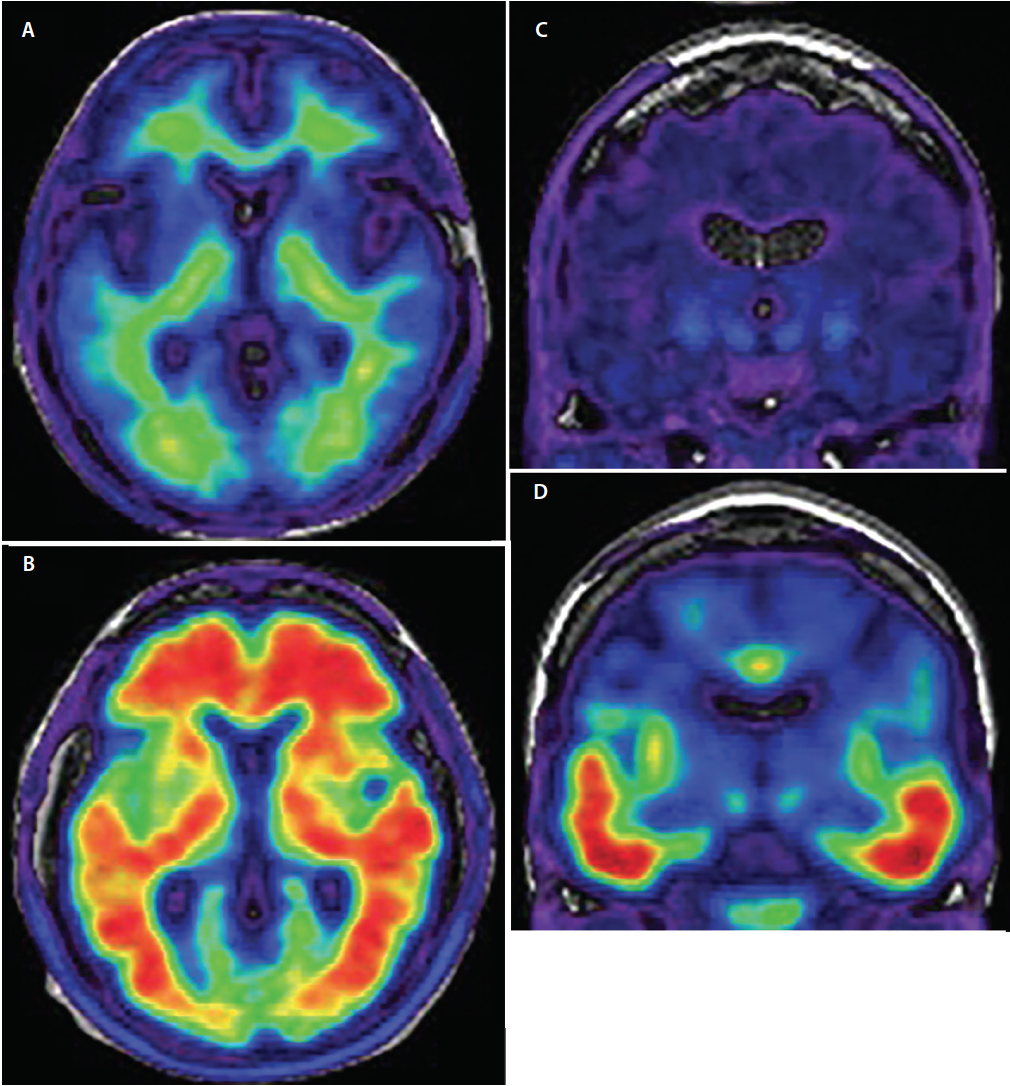
La norme de critère pour un diagnostic définitif de la MA est l’examen cérébral neuropathologique post-mortem. Même entre les mains d’experts expérimentés en matière de démence, le diagnostic clinique de la MA n’atteint que l’inquiétante sensibilité de 70,9% à 87,3% et la spécificité de 44,3% à 70,8%.18 L’élément le plus pertinent pour améliorer la précision du diagnostic clinique de la MA a été le développement de traceurs d’imagerie TEP radiomarqués ayant une affinité spécifique pour les agrégats de ß-amyloïde et de tau phosphorylé liés à la MA (figure 3), qui permettent de démontrer in vivo la neuropathologie sous-jacente (tableau), autrefois seulement possible post-mortem.
Cliquez pour agrandir
Figure 3. TEP amyloïde axiale montrant des scans amyloïdes négatifs (A) et amyloïdes positifs (B). Dans les images amyloïdes négatives (A), le signal du radiotraceur est de faible intensité et se limite à une liaison non spécifique de la substance blanche. La jonction matière grise/matière blanche est préservée. Sur les images amyloïdes positives (B), le signal du radiotraceur est de forte intensité et s’étend de façon diffuse dans les régions de la substance grise corticale, masquant la jonction substance grise/substance blanche. TEP-tau coronale montrant des scans tau négatifs (C) et tau positifs (D). Dans les scans tau négatifs, on observe un signal radiotraceur de faible intensité, minimal et non spécifique, dans les régions temporales médianes, le cerveau antérieur basal et les ganglions de la base. Dans les scans tau-positifs (D), le signal du radiotraceur est de plus forte intensité et implique les cortex temporaux inférieurs et latéraux en suivant la trajectoire connue de la progression des enchevêtrements neurofibrillaires.
Tomographie par émission de positons amyloïde
L’imagerie amyloïde et, plus récemment, l’imagerie tau ont révolutionné notre capacité à visualiser la pathologie de la MA, même à des stades présympto-tomatiques19. Les traceurs d’imagerie TEP de l’amyloïde sont valides et fiables pour détecter in vivo la pathologie de la MA à différents stades de la maladie. Ces traceurs d’imagerie se lient à des motifs conformationnels spécifiques de la protéine amyloïde et entraînent une absorption du traceur qui est étroitement corrélée au dépôt amyloïde post-mortem.20
Par rapport à la protéine tau, la pathologie amyloïde commence dans un modèle régional distribué de manière plus diffuse, s’étendant des parties basales des lobes frontal, temporal et occipital aux zones d’association néocorticales dorsales, avec seulement une implication tardive des cortex sensoriels et moteurs primaires.21 Les zones les plus remarquables de captation du traceur sont les cortex frontal, pariétal et temporal latéral (figure 3), avec une captation 1,5 à 2 fois plus importante chez les personnes atteintes de la MA par rapport aux groupes témoins22 ou aux personnes atteintes d’autres démences.23
Les images TEP amyloïdes sont évaluées pour la captation du traceur cortical dans les zones caractéristiques de la distribution amyloïde de la MA. Les scans positifs montrent une perte de la distinction matière grise/matière blanche alors que la captation du traceur s’étend au néocortex. Les scans négatifs conservent la distinction matière grise/matière blanche, ne montrant que la liaison hors cible de la matière blanche.24 Les schémas d’imagerie TEP amyloïde peuvent prédire de manière fiable le déclin cognitif tant chez les personnes en bonne santé que chez celles atteintes de MCI20.
La relation incertaine entre le coût, le risque et les avantages a conduit à l’élaboration de critères d’utilisation appropriée pour l’imagerie de l’amyloïde, attribuant la nécessité d’une évaluation de la TEP à l’amyloïde aux personnes présentant un MCI inexpliqué, des présentations atypiques de la MA et une démence précoce.26 Les experts ont également identifié des indications inappropriées pour l’imagerie amyloïde qui incluent une évaluation autonome pour des préoccupations cognitives avant un bilan clinique, cognitif, de laboratoire et de neuro-imagerie structurelle approfondi ; en l’absence de troubles cognitifs objectifs ; en cas de forte probabilité de MA (c’est-à-dire en l’absence d’un équi-voque clinique ; et pour la stadification de la gravité de la démence.
L’étude IDEAS (imaging dementia-evidence for amyloid scanning) – une étude en cours du Center for Medicare and Medicaid Services – valide actuellement les critères d’utilisation appropriés et évalue l’impact du statut amyloïde déterminé par TEP sur la gestion de la maladie et les résultats à long terme pour les bénéficiaires de Medicare présentant un MCI ou des présentations atypiques. Une analyse intérimaire a révélé que l’intégration de la TEP amyloïde dans le bilan clinique a entraîné des changements dans la gestion de la maladie chez 60,2 % des personnes atteintes de MCI et 63,5 % de celles atteintes de démence.27 Les résultats à long terme sont encore en cours de détermination.
Tomographie par émission de positons de Tau
Tau est la deuxième protéine qui se dépose dans le cerveau des personnes atteintes de la MA. Des traceurs d’imagerie TEP de la protéine Tau sont en cours de développement et sont déjà prometteurs. Comme pour la TEP de l’amyloïde, les traceurs TEP de la protéine tau ciblent des motifs conformationnels particuliers de la protéine tau phosphorylée. La spécificité des traceurs tau a été validée post-mortem,28 et le signal TEP tau observé correspond étroitement à la distribution anatomique des enchevêtrements neurofibrillaires actuellement utilisés pour le diagnostic neuropathologique de la MA.29 Les premiers stades de la pathologie tau qui peuvent être visualisés avec l’imagerie TEP tau sont les dépôts d’enchevêtrements neurofibrillaires dans le cortex entorhinal et l’hippocampe. Ensuite, les dépôts de tau deviennent détectables dans les cortex temporaux inférieurs et latéraux (figure 3), puis dans les cortex pariétal et occipital, et enfin dans les cortex frontaux, conformément à la classification pathologique bien établie de Braak et Braak des dépôts de tau dans le cerveau21 . Cependant, étant donné que la liaison des traceurs tau change dynamiquement tout au long de l’évolution clinique de la MA, cette modalité d’imagerie jouera probablement un rôle important dans la stadification de la gravité de la maladie in vivo.30
Directives futures
Compte tenu du fait que la pathologie de la MA peut être facilement détectée jusqu’à 20 ans avant le diagnostic de démence19 et qu’elle suit une distribution par étapes prévisible, la recherche se concentre maintenant sur la détection précoce présymptomatique et l’amélioration de la précision du diagnostic par l’utilisation de biomarqueurs (tableau).31 Une proposition de cadre de recherche sur l’amyloïde-tau-neurodégénérescence (ATN) axée sur la détection de 3 changements de biomarqueurs dans le cerveau prévoit la pertinence clinique de l’imagerie multimodale.31 Le système de classification ATN est agnostique par rapport aux syndromes cliniques et saisit le spectre complet des maladies neurodégénératives à travers le prisme des biomarqueurs de la MA. Après avoir été développé et affiné, l’ATN, grâce à une catégorisation objective des biomarqueurs in vivo, devrait améliorer considérablement la précision du diagnostic clinique et améliorer la qualité des soins.
Conclusion
La neuro-imagerie offre des informations uniques sur l’étiologie sous-jacente des troubles cognitifs et facilite l’orientation des patients et des familles à travers une expérience craintive et incertaine. Toutes les maladies neurodégénératives présentent une hétérogénéité clinique importante et, avant les progrès les plus récents de l’imagerie moléculaire, aucune ne pouvait être diagnostiquée définitivement avant le décès. La technologie moderne d’imagerie cérébrale est capable de détecter une multitude d’épiphénomènes reflétant la neuropathologie sous-jacente, dont certains sont assez proches de la source de la maladie. Le diagnostic clinique le plus sûr repose actuellement sur l’intégration de l’histoire clinique, des observations du médecin, de l’examen physique, du bilan médical, des tests neuropsychologiques et de l’interprétation éclairée de la neuro-imagerie diagnostique. Au fur et à mesure que les biomarqueurs de l’ATN seront affinés, les diagnostics cliniques seront établis plus tôt et de manière plus définitive chez les patients vivants, ils reposeront moins sur la classification des symptômes et offriront des possibilités d’intervention thérapeutique plus précoce susceptible de modifier la trajectoire de la maladie neurodégénérative.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Paramètre de pratique : diagnostic de la démence (une revue basée sur des preuves). Rapport du sous-comité des normes de qualité de l’Académie américaine de neurologie. Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation de la démence : une étude systématique de l’utilité des paramètres de pratique de l’American Academy of Neurology. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. Échelles d’évaluation visuelle IRM dans le diagnostic de la démence : évaluation dans 184 cas confirmés post-mortem. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. L’atrophie du lobe temporal médian à l’IRM différencie la maladie d’Alzheimer de la démence à corps de Lewy et des troubles cognitifs vasculaires : une étude prospective avec vérification pathologique du diagnostic. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias : a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion tensor imaging of normal-appearing white matter in mild cognitive impairment and early Alzheimer disease : preliminary evidence of axonal degeneration in the temporal lobe. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Modifications de l’imagerie de la matière blanche dans la déficience cognitive subjective et légère. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Les altérations des tractus structurels prédisent l’accumulation de tau en aval chez les personnes âgées amyloïdes. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Cartographie guidée par les caractéristiques de surface des changements métaboliques cérébraux chez les personnes âgées cognitivement normales et légèrement altérées. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. La TEP-FDG améliore la précision de la distinction entre la démence fronto-temporale et la maladie d’Alzheimer. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Métabolisme cérébral du glucose chez les patients atteints de démence frontotemporale. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardized 18F-FDG PET diagnosis of mild cognitive impairment, Alzheimer’s disease, and other dementias. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Mémo de décision pour la tomographie par émission de positrons (FDG) et d’autres dispositifs de neuro-imagerie pour la suspicion de démence (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Consulté le 4 mai 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Hubs corticaux révélés par la connectivité fonctionnelle intrinsèque : cartographie, évaluation de la stabilité et relation avec la maladie d’Alzheimer. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Les maladies neurodégénératives ciblent les réseaux cérébraux humains à grande échelle. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Précision du diagnostic clinique de la maladie d’Alzheimer aux centres de la maladie d’Alzheimer du National Institute on Aging, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imagerie de l’évolution et de la physiopathologie de la maladie d’Alzheimer. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. La valeur diagnostique de la TEP au FDG et à l’amyloïde dans la maladie d’Alzheimer – une revue systématique. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Mise en scène neuropathologique des changements liés à la maladie d’Alzheimer. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imagerie de l’amyloïde cérébrale dans la maladie d’Alzheimer avec le composé B de Pittsburgh. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prévalence de la positivité de la TEP amyloïde dans les syndromes de démence : une méta-analyse. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. Norme de procédure SNMMI/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Précision prédictive de l’imagerie amyloïde pour la progression de la déficience cognitive légère vers la maladie d’Alzheimer avec différentes durées de suivi : une méta-analyse. . Médecine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Critères d’utilisation appropriée pour la TEP de l’amyloïde : un rapport de l’Amyloid Imaging Task Force, la Société de médecine nucléaire et d’imagerie moléculaire, et l’Association Alzheimer. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association de la tomographie par émission de positrons amyloïde avec un changement ultérieur dans la gestion clinique chez les bénéficiaires de l’assurance-maladie avec une déficience cognitive légère ou une démence. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Validation autoradiographique du nouveau traceur TEP tau -MK-6240 sur le tissu cérébral post-mortem humain. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Premiers résultats cliniques d’imagerie TEP avec le nouveau radioligand PHF-tau -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Évaluation de l’imagerie tau dans la mise en scène de la maladie d’Alzheimer et la révélation des interactions entre la bêta-amyloïde et la tauopathie. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr, Bennett DA, Blennow K, et al. Cadre de recherche NIA-AA : Vers une définition biologique de la maladie d’Alzheimer. Alzheimers Dement. 2018;14(4):535-562.
MRA et DS ne signalent aucune divulgation.
LGA a été membre d’un conseil consultatif pour Eli Lilly.