- Introduction
- Méthodes
- Sujets et conception
- Acquisition de l’IRM et évaluation du volume standard
- Traitement préalable des images
- Segmentation tissulaire par clustering discriminant
- Estimation du volume partiel
- Évaluation neuropsychologique
- Analyse statistique
- Résultats
- Caractéristiques des sujets
- Volumes des LMM partiels et autres résultats de l’IRM
- Volumes partiels de LMM comme prédicteurs de la performance cognitive
- Discussion
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Matériel supplémentaire
- Abréviations
- Notes de bas de page
Introduction
La maladie des petits vaisseaux cérébraux (MVC) est la cause la plus fréquente de déficience cognitive vasculaire et de démence. Les lésions de la substance blanche (LMV) sont le marqueur central de la MVD sur l’imagerie cérébrale, avec les infarctus lacunaires, les micro-saignements et l’atrophie cérébrale. Il a été démontré que tous ces éléments influent sur les résultats cliniques et cognitifs (Jokinen et al., 2011, 2012 ; Muller et al., 2011 ; Poels et al., 2012). L’étude Leukoaraiosis and Disability (LADIS), entre autres, a démontré que les LMW sont liés au déclin cognitif, à l’altération des capacités fonctionnelles, à la dépression et aux troubles de la marche et de l’équilibre (LADIS Study Group, 2011).
L’imagerie par résonance magnétique (IRM) a été la méthode standard pour évaluer les LMW. Malgré d’importantes améliorations récentes des techniques d’analyse quantitative des images, l’un des principaux obstacles de l’IRM reste sa résolution spatiale finie, qui entraîne des effets de volume partiel. Avec le bruit et l’inhomogénéité, cela pose des difficultés aux techniques de segmentation du cerveau. Souvent, une analyse minutieuse des frontières entre les tissus sains et pathologiques est nécessaire pour délimiter l’étendue et la gravité des lésions, en appliquant un « seuil de décision » implicite pour la segmentation des lésions. De plus, les hyperintensifications en IRM semblent ne représenter que le stade final du processus pathologique. Des lésions tissulaires plus étendues peuvent être associées au LMW, non visibles sur l’IRM de routine (Schmidt et al., 2011). Il n’existe pas de norme pour évaluer ces stades précoces de lésions tissulaires, car leurs valeurs d’intensité ne sont pas suffisamment distinctes de celles des tissus normaux.
La plupart des méthodes de segmentation modernes reposent sur des informations préalables, telles que des atlas cérébraux moyens (Smith et al., 2004 ; Ashburner et Friston, 2005 ; Goebel et al., 2006) ou un étiquetage manuel (Wismüller et al., 2004 ; Lee et al., 2009 ; Cruz-Barbosa et Vellido, 2011). Récemment, une nouvelle méthode de segmentation des tissus basée sur les données a été proposée, sur la base d’une stratégie de clustering discriminatif (DC), dans une approche d’apprentissage automatique supervisée (Gonçalves et al., 2014). Cette méthode réduit au minimum l’utilisation d’informations préalables, et utilise des données IRM multispectrales. Contrairement à d’autres méthodes, qui ne ciblent que les tissus sains (Pham et Prince, 1998 ; Van Leemput et al., 1999 ; Zhang et al., 2001 ; Manjón et al., 2010) ou des types spécifiques de lésions (Van Leemput et al., 2001 ; Zijdenbos et al., 2002 ; Styner et al., 2008 ; Cruz-Barbosa et Vellido, 2011), la DC permet d’étudier un large éventail de types de tissus normaux et anormaux. Un autre atout majeur de la méthode proposée est sa capacité à estimer les probabilités tissulaires pour chaque voxel, nécessaire pour une caractérisation adéquate de l’évolution du LME. Les voxels peuvent être classés selon qu’ils contiennent une petite (encore trop faible pour être clairement visible), une moyenne ou une forte proportion de LME. Ceux qui contiennent une petite proportion de lésion sont généralement en dehors du « seuil de décision » de la segmentation conventionnelle, et indiquent un LEMP de stade précoce.
L’objectif de la présente étude est d’observer comment les différents stades de lésions sont liés aux performances cognitives dans un échantillon de sujets âgés présentant un LEMP léger à modéré. Les données utilisées consistaient en des mesures IRM collectées au cours d’une période de suivi de 3 ans, et des évaluations neuropsychologiques annuelles au cours de cette période. En particulier, nous avons voulu déterminer si même les petits volumes partiels de LMP les plus précoces, dans un tissu cérébral d’apparence normale, sont capables de prédire indépendamment le déclin cognitif futur, en plus de la charge de LMP évaluée de manière conventionnelle.
Méthodes
Sujets et conception
Les sujets étaient un sous-groupe de participants (n = 78) de trois centres (Amsterdam n = 21, Graz n = 18, Helsinki n = 39) de l’étude LADIS, une étude multicentrique européenne étudiant l’impact du LME lié à l’âge dans la transition de l’indépendance fonctionnelle vers le handicap. Le protocole de l’étude LADIS et les caractéristiques de l’échantillon ont été présentés en détail ailleurs (Pantoni et al., 2005). En résumé, 639 sujets ont été recrutés dans 11 centres selon les critères d’inclusion suivants : (a) âge de 65-84 ans, (b) LMP léger à sévère selon l’échelle révisée de Fazekas (Pantoni et al., 2005), (c) pas ou peu de déficience dans l’échelle des activités instrumentales de la vie quotidienne (≤ 1 des 8 items compromis) (Lawton et Brody, 1969), et (d) présence d’un informateur régulièrement joignable. Les critères d’exclusion étaient : (a) une maladie grave susceptible d’entraîner l’abandon du suivi (insuffisance cardiaque, hépatique ou rénale, néoplasique ou autre maladie systémique pertinente), (b) une maladie neurologique grave non apparentée ou un trouble psychiatrique, (c) des leucoencéphalopathies d’origine non vasculaire (immunologique-démyélinisante, métabolique, toxique, infectieuse), et (d) l’incapacité ou le refus de subir une IRM.
L’évaluation de base comprenait une IRM cérébrale et des évaluations médicales, fonctionnelles et neuropsychologiques approfondies. Les évaluations cliniques ont été répétées à 12 mois d’intervalle lors de trois évaluations de suivi ultérieures.
Pour permettre une comparaison valide entre les sujets/centres, les séquences IRM obtenues dans chaque centre devaient être les mêmes, et chaque patient devait disposer de trois séquences, sans artefacts majeurs. Les 78 sujets inclus dans cette étude ne différaient pas de la cohorte LADIS complète en termes d’âge, de sexe, de score de base au Mini-Mental State Examination (MMSE) ou de volume du WML, mais ils avaient un niveau d’éducation significativement plus élevé (9,3 contre 11,7 ans ; t = -4,6, p < 0,001).
L’étude a été approuvée par les comités d’éthique de chaque centre participant à l’étude LADIS (LADIS Study Group, 2011). Tous les sujets ont reçu et signé un consentement écrit éclairé. Les collaborateurs de l’étude LADIS sont listés dans l’annexe II.
Acquisition de l’IRM et évaluation du volume standard
Tous les examens d’IRM axiale utilisés ont été acquis avec un équipement 1.5T, suivant le même protocole dans chaque centre, y compris des images de transfert de magnétisation (TE = 10-14 ms, TR = 740-780 ms), des images d’écho de spin rapide pondérées en T2 (TE = 100-120 ms, TR = 4000-6000 ms) et des images de récupération d’inversion atténuée par le fluide (FLAIR) (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Toutes les séquences avaient une taille de voxel de 1 × 1 × 5-7,5 mm3, un FOV = 250 et un écart entre les coupes de 0,5 mm.
L’étendue des hyperintensités sur les régions de la substance blanche, y compris la région infratentorielle, a été évaluée sur les images FLAIR axiales avec une analyse volumétrique semi-automatique (VFLAIR) à l’aide d’une station de travail Sparc 5 (SUN) (van Straaten et al., 2006). Les lésions ont été marquées et les limites ont été fixées sur chaque coupe en utilisant un seuillage local (logiciel Show_Images développé en interne, version 3.6.1). Aucune distinction n’a été faite entre les hyperintensités sous-corticales et périventriculaires. Les zones d’hyperintensité sur les images pondérées en T2 autour des infarctus et des lacunes n’ont pas été prises en compte. Le nombre de lacunes a été enregistré dans la substance blanche et dans la substance grise profonde en utilisant une combinaison d’images FLAIR, d’échos de gradient à acquisition rapide préparés par magnétisation et d’images T2 pour distinguer les lacunes des espaces périvasculaires et des microbleeds (Gouw et al., 2008). En outre, l’atrophie du cerveau a été évaluée selon une échelle d’évaluation basée sur un modèle sur les images FLAIR séparément sur les régions corticales et sous-corticales (Jokinen et al…, 2012).
Traitement préalable des images
Pour garantir que les informations multispectrales contenues dans chaque voxel provenaient exactement du même endroit chez chaque sujet, un recalage intra-patient a été appliqué pour toutes les séquences disponibles, en utilisant la boîte à outils SPM5 (Friston, 2003), et en appliquant une transformation affine avec l’image de plus faible résolution, typiquement FLAIR, comme modèle. En outre, les voxels de tissus extra-méningés ont été masqués, en utilisant une méthode automatique standard (BET2) (Smith et al., 2004).
Segmentation tissulaire par clustering discriminant
Les progrès récents des techniques d’apprentissage automatique ont montré des résultats compétitifs dans la segmentation tissulaire, dépassant souvent les précisions obtenues par les méthodes classiques de croissance de région ou basées sur des seuils (Styner et al., 2008). En particulier, par rapport à la délimitation manuelle, elles sont plus robustes et moins subjectives. La méthode de segmentation des tissus utilisée dans cette étude est une telle technique d’apprentissage automatique, basée sur une méthodologie auto-supervisée axée sur les données, enracinée dans une stratégie DC (Gonçalves et al., 2014). Semblable aux algorithmes de regroupement non supervisés, tels que k-voisins les plus proches, la stratégie DC regroupe les données d’entrée en fonction de leurs informations multidimensionnelles de distribution du niveau de gris. Dans l’étude actuelle, ces distributions sont tridimensionnelles, ce qui correspond au nombre total de séquences utilisées. L’atout majeur du DC est sa capacité à utiliser un petit ensemble d’informations étiquetées pour soutenir l’affectation du clustering. Cette caractéristique conduit à une nette amélioration des résultats de segmentation, au-delà des techniques traditionnelles de clustering (Gonçalves et al., 2014).
L’objectif global de DC peut alors être résumé comme étant de partitionner l’espace de données en régions clusterisées avec des distributions plutôt uniformes tout au long, et des informations d’étiquettes cohérentes pour tous les voxels appartenant à chaque cluster. Une explication plus détaillée est donnée dans l’annexe I, avec la description mathématique complète présentée dans Gonçalves et al. (2014).
Estimation du volume partiel
DC donne la probabilité d’appartenance de chaque voxel à toutes les classes de tissus, permettant l’estimation de l’information sur le volume partiel. Comme nous avions l’intention de concentrer notre étude sur les voxels lésionnés, nous n’avons analysé que ceux pour lesquels la proportion de tissu lésionnel présent est pertinente.
Dans cette étude, trois catégories de lésions différentes ont été identifiées, conduisant à une quantité correspondante d’estimation de volume : le volume des voxels qui ont une probabilité ÉLEVÉE (VDC100), INTERMÉDIAIRE (VDC66) ou PETITE (VDC33) d’être une lésion. VDC100 et VDC66 sont les volumes dans lesquels le tissu principal des voxels a une probabilité d’être une lésion de >66% et < 66%, respectivement. Puisque les deux volumes VDC100 et VDC66 contiennent une majorité de tissu de lésion, VFLAIR1 peut être approximé par la somme : VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. Par conséquent, en utilisant le DC, la meilleure estimation possible du volume de la lésion visible est atteinte par VDCHARD. La dernière catégorie, VDC33 correspond au volume des voxels où la lésion est le deuxième type de tissu le plus probable, avec des probabilités ≥ 33%. Notez que, ce volume n’est pas considéré comme une lésion dans les méthodes de segmentation normales, comme celle estimant le VFLAIR, puisque la lésion n’y est jamais le type de tissu principal.
La capacité de la présente méthode de segmentation à détecter des lésions de stade précoce a été vérifiée dans un sous-groupe de patients (n = 19) avec des données IRM de suivi, c.f. Supplementary Materials : Annexe I). Nous y montrons que de petits volumes partiels de LMP indiquent les emplacements futurs possibles de lésions entièrement développées.
Évaluation neuropsychologique
La batterie de tests cognitifs de l’étude LADIS comprenait le MMSE (Folstein et al., 1975), l’échelle d’évaluation de la démence vasculaire – sous-échelle cognitive (VADAS) (Ferris, 2003), le test de Stroop (MacLeod, 1991) et le test de traçage (Reitan, 1958). Aux fins de la présente étude, nous avons utilisé les scores totaux du MMSE et du VADAS comme mesures globales de la fonction cognitive. En outre, trois mesures composées psychométriquement robustes ont été constituées pour l’évaluation de domaines cognitifs spécifiques en utilisant les scores standards moyens des sous-tests individuels, comme décrit précédemment (Moleiro et al., 2013) : (1) vitesse et contrôle moteur = scores z (Trail making A + labyrinthe + annulation de chiffres)/3 ; (2) fonctions exécutives = scores z de /4 ; et (3) mémoire = scores z (rappel immédiat de mots + rappel différé + reconnaissance de mots + empan de chiffres)/4.
La proportion de valeurs manquantes dans les variables des tests neuropsychologiques variait entre 0 et 6,4 % au départ, et entre 24,4 et 32,1 % lors de la dernière évaluation de suivi. Cette perte de données était due au décès des sujets (n = 2), à l’abandon des évaluations neuropsychologiques de suivi (visite de la dernière année, n = 17), ou à l’incapacité de compléter la batterie de tests complète (n = 6).
Analyse statistique
Les prédicteurs de la performance cognitive longitudinale ont été analysés à l’aide de modèles mixtes linéaires (estimation du maximum de vraisemblance restreinte), qui sont capables de traiter les valeurs manquantes et les structures de covariance complexes. L’année d’évaluation (base, 1ère, 2ème et 3ème) a été utilisée comme variable intra-sujet, et une structure de covariance non structurée a été adoptée. Les résultats des tests cognitifs ont été définis comme variables dépendantes. Les volumes des lésions partielles (VDC33, VDC66 et VDC100) ont été testés comme prédicteurs, un par un. Dans tous les modèles, l’âge, le sexe et le nombre d’années d’études ont été utilisés comme covariables. Les modèles ont été répétés en ajoutant le VFLAIR comme autre covariable, afin de déterminer la valeur prédictive des mesures de volume partiel en plus de celle du volume du LMP évalué de manière conventionnelle. De même, le centre d’étude a été ajouté comme facteur de confusion potentiel, mais comme il n’avait pas d’effet essentiel sur les résultats, il a été laissé de côté dans les analyses finales. En raison de distributions asymétriques pouvant compromettre l’hypothèse de linéarité des modèles de mélange, une transformation logarithmique a été appliquée aux trois mesures de volume partiel et au VFLAIR. Les résultats ont été analysés avec le module mixte IBM SPSS Statistics 22. La signification statistique a été fixée à p < 0,05 pour toutes les analyses.
Résultats
Caractéristiques des sujets
Les caractéristiques des sujets au départ sont indiquées dans le tableau 1. Selon l’échelle révisée de Fazekas, 28 (35,9 %) sujets présentaient une LMM légère, 26 (33,3 %) modérée et 24 (30,8 %) sévère.

Tableau 1. Caractéristiques de base des sujets, n = 78.
Volumes des LMM partiels et autres résultats de l’IRM
Le tableau 1 montre les volumes obtenus par la méthode de segmentation conventionnelle, les volumes des lésions partielles estimés par DC, et le coefficient de similarité de Dice comparant les deux méthodes de segmentation. La figure 1 présente une comparaison entre l’image FLAIR originale (1A), le volume d’hyperintensité estimé par la méthode conventionnelle, VFLAIR (1B), et les résultats obtenus pour les volumes de lésions partielles VDC100 (1C), VDC66 (1D), et VDC33 (1E). Les images 1F-1J montrent les images correspondantes dans la zone zoomée dénotée par le rectangle blanc de l’image 1A. Les images 1H-J montrent l’évolution autour des foyers de lésion, depuis l’explosion complète au centre jusqu’au stade intermédiaire et à la petite proportion de lésion sur les bords. Notez que les voxels classés comme VDC33 ne sont pas inclus dans le VFLAIR, mais sont indicatifs des emplacements possibles de futures lésions. La figure 2 montre des résultats similaires à un niveau plus élevé, le centrum semiovale. La procédure de segmentation DC a utilisé trois séquences différentes (FLAIR, T2, T1). Ici, seule la FLAIR est présentée à des fins d’illustration.
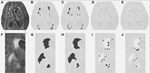
Figure 1. Lésions de la substance blanche (LMS) à une hauteur de niveau moyen. (A) Image FLAIR pour un sujet donné. (B) Lésion de la substance blanche estimée de manière conventionnelle. (C-E) LMS estimée, à l’aide de l’algorithme de segmentation proposé, pour une lésion complète, intermédiaire et de faible proportion. (F-J) Images similaires pour la partie zoomée représentée par la boîte blanche dans (A).
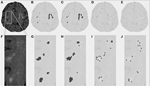
Figure 2. Lésions de la substance blanche (LMS) dans le centrum semiovale. (A) Image FLAIR pour un sujet donné. (B) Lésion de la substance blanche estimée de manière conventionnelle. (C-E) LMS estimée à l’aide de l’algorithme de segmentation proposé, pour une lésion complète, intermédiaire et de faible proportion. (F-J) Images similaires pour la partie zoomée représentée par la boîte blanche dans (A).
Pour l’ensemble de l’ensemble de données utilisé, les trois mesures de volume de LMM partiel sont corrélées de manière significative les unes avec les autres : VDC33*VDC66 r = 0,87 ; VDC33*VDC100 r = 0,47 ; VDC66*VDC100 r = 0,47 (p < 0,001). Elles étaient également corrélées de manière significative avec le VFLAIR : VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023) et VDC100 r = 0,87 (p < 0,001), respectivement. Cependant, les mesures n’étaient pas significativement associées à la présence d’infarctus lacunaires (aucun/peu/beaucoup) ou au score d’atrophie cérébrale globale (corticale et sous-corticale) (p > 0,05).
La figure 3 identifie les segmentations partagées et disparates entre la segmentation conventionnelle (VFLAIR), et la DC (VDCHARD) pour le sujet de la figure 1. Il y a un chevauchement clair entre les deux segmentations, comme le montre le grand nombre de pixels verts. Pour le sujet présenté dans cette figure, il y a une petite différence entre VFLAIR et VDCHARD.
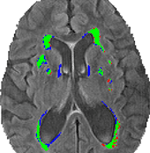
Figure 3. Comparaison des méthodes de segmentation. Cette image montre la segmentation obtenue en utilisant l’analyse volumétrique semi-automatique (VFLAIR) et le clustering discriminant (VDCHARD) pour le sujet de la figure 1. Les régions représentées en vert correspondent à la segmentation chevauchante entre les deux approches. En rouge sont représentées les régions classées comme lésion uniquement par la méthode conventionnelle, tandis que le bleu correspond au voxel classé comme lésion uniquement par le DC.
L’estimation de la classification tissulaire complète d’un sujet, en utilisant le DC sur un PC avec un processeur Intel® Core™ i5-4590@ 3,30 GHz et 16 Go de RAM, a pris environ 25 min. L’estimation des étiquettes, sur ledit ordinateur, a pris environ 70 min. Une amélioration de cette dernière estimation devrait rationaliser la procédure de manière significative.
Volumes partiels de LMM comme prédicteurs de la performance cognitive
Les relations entre les volumes partiels de LMM et la performance cognitive longitudinale sont résumées dans le tableau 2. Les modèles mixtes linéaires ajustés pour l’âge, le sexe et l’éducation ont montré des associations négatives significatives entre le VDC33 et le score composé pour les fonctions exécutives. Premièrement, le CDV33 était associé à un effet principal significatif sur le niveau global de performance exécutive (scores moyens des quatre évaluations temporelles). Deuxièmement, l’interaction entre le CDV33 et le temps (année d’évaluation) a indiqué une valeur prédictive significative du CDV33 sur le changement de la performance exécutive au cours du suivi de 3 ans. Plus précisément, une charge plus élevée du VDC33 était liée à une performance plus faible au départ et à un déclin plus marqué des fonctions exécutives à chaque année d’évaluation ultérieure. Après un ajustement supplémentaire pour le VFLAIR, ces résultats sont restés inchangés. En outre, il y avait une faible association au départ entre le VDC33 et le score total du VADAS, mais ce résultat n’était plus significatif après avoir contrôlé le VFLAIR.Le VDC33 n’avait pas d’effets principaux significatifs ou d’interactions avec le temps dans le MMSE, le VADAS, la vitesse de traitement ou les fonctions de mémoire.
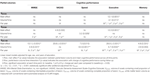
Tableau 2. Relation entre les volumes des lésions partielles de la substance blanche et la performance cognitive dans le suivi de 3 ans.
Le VDC66 était lié à des effets principaux significatifs indiquant un niveau de performance global plus faible dans le VADAS et les fonctions exécutives. L’interaction entre le VDC66 et le temps n’était significative que pour la vitesse de traitement. L’inspection des résultats aux points de temps individuels a montré une association significative au départ (VADAS, fonctions exécutives) ainsi qu’un changement longitudinal à la première (VADAS, fonctions exécutives), deuxième (MMSE, fonctions exécutives) et troisième (fonctions exécutives) année de suivi. Le contrôle du VFLAIR a eu un effet minime sur ces résultats (tableau 2).
Enfin, le VDC100 a été associé à des effets principaux significatifs dans tous les scores neuropsychologiques. Les interactions VDC100* temps ont indiqué une relation significative avec le changement au cours du suivi dans quatre des cinq mesures cognitives. À ce stade, les lésions étaient systématiquement associées aux performances cognitives déjà présentes au départ. De plus, un déclin plus marqué des performances était évident de la première à la dernière évaluation de suivi, avec une certaine variation dans les différentes mesures cognitives. La plupart de ces résultats sont restés même après un contrôle supplémentaire du VFLAIR malgré sa corrélation élevée avec le VDC100 (tableau 2).
Malgré le VDC33 et le VDC66, le VFLAIR est resté un prédicteur significatif de la performance globale au cours de la période de suivi dans le VADAS et les fonctions exécutives. Cependant, le VFLAIR n’avait pas de valeur prédictive indépendante incrémentale par rapport à celle du VDC100 sur aucune des mesures cognitives.
Discussion
Cette étude a examiné l’impact cognitif longitudinal de la LMW partielle, des plus faibles changements dans la matière blanche d’apparence normale aux lésions entièrement développées. L’enquête a utilisé une nouvelle méthode de segmentation tissulaire multispectrale auto-supervisée par IRM basée sur la DC (Gonçalves et al., 2014) et des évaluations neuropsychologiques répétées annuellement dans le cadre d’un suivi de 3 ans. Différents types de tissus ont été identifiés en utilisant simultanément toutes les séquences IRM disponibles. Les LMM ont ensuite été catégorisés en fonction des volumes partiels comme petite, intermédiaire et lésion complète.
Contrairement à la segmentation manuelle conventionnelle des tissus, où la décision est basée sur un seuil implicite de niveau de gris, la méthode proposée donne accès à des informations » sous le seuil » concernant les lésions. Cela permet de mieux évaluer la progression de la lésion (information qualitative), ainsi que la volumétrie des sous-voxels (information quantitative). Il existe d’autres méthodes qui fournissent des informations sur les proportions des tissus (Van Leemput et al., 2003 ; Manjón et al., 2010). Pourtant, elles utilisent certains prieurs qui les rendent inadaptées à la détection des LMM, comme l’hypothèse selon laquelle un voxel ne peut pas contenir plus de deux types de tissus.
La principale conclusion de la présente étude est que même le plus petit volume partiel de LMM, le VDC33, était significativement associé à une moins bonne performance exécutive déjà au départ et prédisait un déclin futur des fonctions exécutives au cours du suivi de 3 ans. Cet effet était indépendant des facteurs démographiques et, notamment, également du volume d’hyperintensité conventionnellement évalué sur les images FLAIR. Dans un sous-groupe de sujets, nous avons en outre montré que les CDV33 représentent probablement les changements les plus précoces dans la substance blanche d’apparence normale, car leur détection, au départ, indiquait les emplacements futurs des lésions pleinement développées après le suivi (annexe I).
Les lésions de stade intermédiaire, CDV66, étaient indépendamment associées à un déclin cognitif plus important, y compris des changements dans la vitesse de traitement et les fonctions exécutives, ainsi que dans les fonctions cognitives globales. De plus, les lésions complètes, VDC100, étaient liées à des effets encore plus prononcés s’étendant à tous les domaines cognitifs évalués, tant au départ qu’au cours du suivi. Il n’est pas surprenant que la VDC100 soit un puissant prédicteur du déclin cognitif. Puisque le VDC100 était fortement corrélé avec le VFLAIR, qui a précédemment montré une forte association avec le changement cognitif (Jokinen et al., 2011 ; Kooistra et al., 2014), il devrait détenir un pouvoir prédictif assez similaire.
Le résultat nouveau et le plus important de la présente recherche est que le volume des lésions détectées sous le seuil de décision permet déjà de prédire des scores cognitifs particuliers. Les premiers signes de déclin cognitif ont été trouvés spécifiquement dans les fonctions exécutives, dont on suppose qu’elles dépendent essentiellement de l’intégrité des connexions préfrontales-sous-corticales de la substance blanche (O’sullivan et al., 2001), Les fonctions exécutives comprennent les processus de contrôle cognitif tels que la flexibilité mentale, l’inhibition et la planification liées à un comportement complexe dirigé vers un but. Ces fonctions sont cruciales pour les capacités fonctionnelles d’un individu dans la vie de tous les jours (Tomaszewski Farias et al., 2009).
Les résultats présentés dans cet article soutiennent l’hypothèse selon laquelle les hyperintensifications de la LMM ne représentent qu’une » partie émergée de l’iceberg « , alors qu’en fait, les dommages à la substance blanche dans la MVD évoluent comme un processus graduel affectant des zones plus larges du cerveau (Schmidt et al., 2011 ; Maillard et al., 2013). Des études d’imagerie de diffusion ont montré que des changements microstructuraux subtils, même dans le tissu cérébral d’apparence normale, sont liés à la déficience cognitive et permettent de prédire de mauvais résultats cognitifs et cliniques lors du suivi (Schmidt et al., 2010 ; Jokinen et al., 2013). L’intégrité microstructurale est particulièrement réduite à proximité de l’AMM, comme le montre l’anisotropie fractionnelle (Maillard et al., 2011). Ce phénomène appelé » pénombre d’HMM » pourrait être lié aux volumes partiels d’HMM à un stade précoce observés dans notre étude. Pourtant, les débuts de la lésion peuvent également se produire à une certaine distance du LMP entièrement développé, comme illustré en détail dans l’annexe I. A notre connaissance, la relation entre ces changements focaux subliminaux et les résultats cognitifs n’a pas été démontrée auparavant.
L’échantillon actuel est constitué d’un groupe mixte de sujets âgés, stratifié de manière égale à tous les degrés de sévérité du LWM, de léger à sévère. Les participants ont été recrutés dans différents contextes, sur la base de motifs d’orientation variés, représentant la diversité des patients atteints de LMW rencontrés dans la pratique clinique (LADIS Study Group, 2011). Cette hétérogénéité des sujets peut toutefois masquer les effets les plus subtils entre les résultats d’imagerie et le déclin cognitif. Comme c’est généralement le cas dans les études longitudinales sur le vieillissement et les maladies cérébrovasculaires, certaines données ont été perdues en raison de l’abandon du suivi par les sujets ou de l’impossibilité de réaliser l’intégralité des évaluations.
Comme limitation, le protocole d’imagerie de LADIS n’a pas été conçu initialement pour la présente méthode de segmentation quantitative, de sorte que seule une partie des données d’imagerie originales a pu être utilisée. De plus, le bruit de l’image, la résolution et les artefacts de mouvement sont tous des facteurs qui peuvent influencer les résultats d’une étude multicentrique comme celle présentée ici. Cela est particulièrement vrai lorsqu’il s’agit d’effets de volume partiel. Malgré ces limites, et après avoir corrigé certains des facteurs de confusion susmentionnés, nous avons pu détecter des indications subtiles de progression des lésions, sur la base de voxels ayant une faible probabilité d’être des lésions.
Pour améliorer la fiabilité des résultats présentés dans ce manuscrit, une cohorte plus importante aurait pu être envisagée. En raison des préoccupations concernant la cohérence entre les centres et les changements dans les installations d’imagerie à différents moments, une politique plus stricte devrait être utilisée concernant les séquences IRM employées.
Les points forts de cette étude comprennent une méthode d’analyse d’image nouvelle, robuste, auto-supervisée et axée sur les données qui permet l’identification des types de tissus et la quantification des changements cérébraux pathologiques, à un stade très précoce, où l’évaluation IRM conventionnelle ne serait pas utile. L’étude bénéficie également d’évaluations neuropsychologiques détaillées, réalisées à intervalles annuels dans le cadre d’un suivi de 3 ans.
En conclusion, les changements précoces dans la matière blanche d’apparence normale donnent déjà un indice de détérioration progressive et de mauvais résultats cognitifs. À ce stade, les fonctions exécutives sont principalement affectées, mais l’effet néfaste sur la cognition devient plus global lorsque les changements se transforment progressivement en LMM à part entière, éventuellement détectable également par segmentation tissulaire en IRM conventionnelle. Ces résultats affirment la méthode de segmentation tissulaire IRM multispectrale proposée comme un outil prometteur ayant une valeur additive pour reconnaître le risque de SVD et le déclin cognitif progressif cliniquement significatif.
Contributions des auteurs
Tous les auteurs ont effectué des révisions critiques du manuscrit pour le contenu intellectuel important. En plus de cela, le travail le plus central de chaque auteur pour l’étude était le suivant : HJ ; Enquêteur responsable et auteur correspondant, conception et conceptualisation de l’étude, acquisition de données neuropsychologiques et cliniques, analyse statistique et interprétation, rédaction et finition du manuscrit. NG : investigateur responsable, conception et conceptualisation de l’étude, développement de la méthode de segmentation IRM, analyse des données IRM, rédaction et finalisation du manuscrit. RV : Développement de la méthode de segmentation IRM, analyse des données IRM, conception et conceptualisation de l’étude. JL ; Expertise en analyse et interprétation statistiques. FF ; Conception de l’étude LADIS, responsable des méthodes d’IRM. RS : Conception de l’étude LADIS, responsable des méthodes d’IRM. FB : Conception de l’étude LADIS, responsable des méthodes d’IRM. SM ; Construction de la batterie de tests neuropsychologiques, acquisition des données neuropsychologiques et cliniques. AV : Acquisition des données neuropsychologiques et cliniques. DI ; Coordinateur de l’étude, membre du comité directeur de LADIS, conception de l’étude LADIS. LP ; Coordination et conception de l’étude LADIS. TE : membre du comité directeur de LADIS, conception de l’étude LADIS, conceptualisation et conception de l’étude. HJ et NG ont contribué à parts égales à ce travail.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
L’étude Leukoaraiosis and Disability Study a été soutenue par l’Union européenne (subvention QLRT-2000-00446). Le travail de HJ a été soutenu par des subventions de l’Institut de recherche clinique et du Fonds de recherche médicale de l’Hôpital central de l’Université d’Helsinki, ainsi que par la Fondation Ella et Georg Ehrnrooth. NG a été financé par la subvention numéro SFRH/BD/36178/2007 de la Fundação para a Ciência e Tecnologia.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Abréviations
DC, discriminative clustering ; FLAIR, fluid-attenuated inversion recovery ; LADIS, Leukoaraiosis and Disability Study ; MMSE, Mini-Mental State Examination ; IRM, imagerie par résonance magnétique ; SVD, small vessel disease ; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale ; VDC33, volume des voxels contenant une petite proportion de la lésion ; VDC66, volume des voxels contenant une proportion intermédiaire de la lésion ; VDC100, volume des voxels contenant une proportion complète de la lésion ; VDCHARD = VDC100 + VDC66 ; VFLAIR, volume de la LMM tel que mesuré avec une analyse semi-automatique conventionnelle sur les images FLAIR ; LMM, lésion de la substance blanche.
Notes de bas de page
1. ^VFLAIR, volume du LMM tel que mesuré par l’analyse conventionnelle semi-automatique sur les images FLAIR.
2. ^VDCHARD, volume correspondant aux voxels où la majorité des tissus sont des lésions.
Ashburner, J., et Friston, K. J. (2005). Unified segmentation. Neuroimage 26, 839-851. doi : 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., et Vellido, A. (2011). Analyse semi-supervisée de la tumeur cérébrale humaine à partir d’informations MRS partiellement étiquetées en utilisant des modèles d’apprentissage manifold. Int. J. Neural Syst. 21, 17-29. doi : 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). Mesures générales de la cognition. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi : 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini-mental state. une méthode pratique de gradation de l’état cognitif des patients pour le clinicien. J. Psychiatr. Res. 12, 189-198. doi : 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). « Statistical parameter mapping. a practical guide », dans Neuroscience Databases, ed R. Kötter (New York, NY : Springer), 237-250. Disponible en ligne à l’adresse suivante : http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., et Formisano, E. (2006). Analyse des données de concours d’analyse d’images fonctionnelles avec brainvoyager QX : du sujet unique à l’analyse de modèle linéaire général de groupe aligné sur le plan cortical et à l’analyse en composantes indépendantes de groupe auto-organisateur. Hum. Brain Mapp. 27, 392-401. doi : 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., et Vigário, R. (2014). Segmentation auto-supervisée des tissus IRM par clustering discriminatif. Int. J. Neural Syst. 24:1450004. doi : 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. (2008). Progression des hyperintensifications de la substance blanche et incidence de nouvelles lacunes sur une période de 3 ans : l’étude Leukoaraiosis and Disability. Stroke 39, 1414-1420. doi : 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. (2011). Incident lacunes influence cognitive decline : the LADIS study. Neurology 76, 1872-1878. doi : 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. (2012). L’atrophie cérébrale accélère le déclin cognitif dans la maladie des petits vaisseaux cérébraux : l’étude LADIS. Neurology 78, 1785-1792. doi : 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. (2013). Les changements de diffusion prédisent les résultats cognitifs et fonctionnels : l’étude LADIS. Ann. Neurol. 73, 576-583. doi : 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Lésions cérébrales vasculaires, atrophie cérébrale et déclin cognitif. l’étude SMART-MR (Second Manifestations of Arterial Disease-Magnetic Resonance). Neurobiol. Aging 35, 35-41. doi : 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011 : une décennie de l’étude LADIS (Leukoaraiosis And DISability) : qu’avons-nous appris sur les modifications de la substance blanche et les maladies des petits vaisseaux ? Cerebrovasc. Dis. 32, 577-588. doi : 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., et Brody, E. M. (1969). Évaluation des personnes âgées : maintien de l’autonomie et activités instrumentales de la vie quotidienne. Gerontologist 9, 179-186. doi : 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). Segmentation d’images RM en utilisant une approche de transformation de puissance. IEEE Trans. Med. Imaging 28, 894-905. doi : 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Un demi-siècle de recherche sur l’effet stroop : une revue intégrative. Psychol. Bull. 109, 163-203. doi : 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. (2013). Les signaux IRM FLAIR et de diffusion sont des prédicteurs indépendants des hyperintensifications de la substance blanche. Am. J. Neuroradiol. 34, 54-61. doi : 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. (2011). Pénombre d’hyperintensité de la matière blanche. Stroke 42, 1917-1922. doi : 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., et Robles, M. (2010). Estimations améliorées des coefficients de volume partiels à partir de l’IRM cérébrale bruyante en utilisant le contexte spatial. Neuroimage 53, 480. doi : 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. (2013). Analyse factorielle confirmatoire de la batterie d’évaluation neuropsychologique de l’étude LADIS : une analyse longitudinale. J. Clin. Exp. Neuropsychol. 35, 269-278. doi : 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., et Geerlings, M. I. (2011). Atrophie du cerveau et cognition : interaction avec la pathologie cérébrovasculaire ? Neurobiol. Aging 32, 885-893. doi : 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., et Markus, H. S. (2001). Evidence for cortical « disconnection » as a mechanism of age-related cognitive decline. Neurology 57, 632-638. doi : 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. (2005). Impact of age-related cerebral white matter changes on the transition to disability-the LADIS study : rationale, design and methodology. Neuroepidemiology 24, 51-62. doi : 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., and Prince, J. L. (1998). L’estimation du volume partiel et l’algorithme des C-means flous. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Les micro-saignements cérébraux sont associés à une plus mauvaise fonction cognitive : l’étude rotterdam scan. Neurology 78, 326-333. doi : 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). Validité du trail making test comme indicateur de lésions cérébrales organiques. Percept. Mot. Skills 8, 271-276. doi : 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. (2010). Imagerie pondérée par diffusion et cognition dans l’étude sur la leucose et le handicap chez les personnes âgées. Stroke 41, e402-e408. doi : 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. (2011). Hétérogénéité des modifications de la substance blanche liées à l’âge. Acta Neuropathol. 122, 171-185. doi : 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage 23(Suppl. 1), S208-S219. doi : 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. (2008). « La segmentation 3D dans la clinique : un grand défi II : segmentation des lésions de la SEP, » Journal MIDAS, Atelier MICCAI 2008. Disponible en ligne à l’adresse suivante : http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). Longitudinal changes in memory and executive functioning are associated with longitudinal change in instrumental activities of daily living in older adults. Clin. Neuropsychol. 23, 446-461. doi : 10.1080/138540802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., et Suetens, P. (1999). Classification automatisée des tissus basée sur un modèle des images RM du cerveau. IEEE Trans. Med. Imaging 18, 897-908. doi : 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., et Suetens, P. (2001). Segmentation automatisée des lésions de la sclérose en plaques par détection des aberrations du modèle. IEEE Trans. Med. Imaging 20, 677-688. doi : 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., et Suetens, P. (2003). Un cadre unificateur pour la segmentation volumique partielle des images IRM du cerveau. IEEE Trans. Med. Imaging 22, 105-119. doi : 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). Impact de la méthode de notation des hyperintensifications de la substance blanche sur les corrélations avec les données cliniques : l’étude LADIS. Stroke 37, 836-840. doi : 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., et Ritter, H. (2004). Fully automated biomedical image segmentation by self-organized model adaptation. Neural Netw. 17, 1327. doi : 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., et Smith, S. (2001). Segmentation des images IRM du cerveau par un modèle de champ aléatoire de Markov caché et l’algorithme de maximisation de l’espérance. IEEE Trans. Med. Imaging 20, 45-57. doi : 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002). Analyse automatique en pipeline des données IRM 3-D pour les essais cliniques : application à la sclérose en plaques. IEEE Trans. Med. Imaging 21, 1280-1291. doi : 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar