- Contexte et introduction
- Présentation du cas
- Discussion
- Pathophysiologie de l’ADI
- Recherche documentaire
- Causes de l’IAD
- Présentation clinique de la DJA
- Complications associées de l’IAD
- Approches de gestion de l’IDA
- Conclusion
- Data Availability
- Ethics Statement
- Consentement à participer
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
- Remerciements
Contexte et introduction
Le diabète insipide adipique hypothalamique (DIA), un syndrome rare avec une présentation clinique hétérogène, est caractérisé par une congregation de défauts dans les mécanismes homéostatiques de l’équilibre hydrique. Ceux-ci comprennent le mécanisme d’osmorégulation de la soif, la sécrétion d’arginine vasopressine et la capacité rénale à concentrer l’urine. Moins d’une centaine de cas sévères ont été rapportés dans le monde au cours des quatre dernières décennies (1).
La prise en charge de ces patients est extrêmement difficile car ces patients ont tendance à souffrir de larges oscillations du sodium plasmatique même lorsque l’ID est bien contrôlée (2).
Nous rapportons un cas d’IDA sévère qui s’est produit en postopératoire après une chirurgie de malformation artério-veineuse (MAV) cérébrale. Nous décrivons la pathogénie possible dans ce cas et passons en revue la littérature pour tous les cas rapportés de manière similaire et décrivons les mécanismes potentiels impliqués, la présentation clinique, la gestion aiguë ainsi que chronique et le pronostic.
Présentation du cas
Une dame de 27 ans a présenté une hémorragie intracérébrale frontale gauche avec extension intraventriculaire secondaire à un grand complexe ganglionnaire basal (MAV) avec des nourrices artérielles complexes provenant des artères cérébrales moyennes (ACM) gauches, et des artères cérébrales antérieures (ACA) avec une échelle de classement de Spetzler Martin de 3 (3).
Après une récupération initiale après une craniotomie décompressive et une chirurgie d’évacuation du caillot, elle a subi une chirurgie élective d’excision de la MAV ~2 semaines plus tard. Pendant la chirurgie de la MAV, les chirurgiens ont signalé une hémorragie rapide des vaisseaux nourriciers (l’ACM, l’ACA et les vaisseaux choroïdes) avec une hémorragie intracérébrale et une hémorragie intra-ventriculaire sévères nécessitant une transfusion sanguine massive allant jusqu’à 32 unités en peropératoire. Elle a été placée sous coma induit par des barbituriques et sous hypotension induite pour minimiser l’œdème cérébral (4).
Elle a commencé à avoir une polyurie avec de grands volumes d’urine en per-opératoire peu après l’épisode de saignement per-opératoire abondant. Bien que ses concentrations de sodium étaient normales avant l’opération, les concentrations de sodium étaient plus élevées immédiatement (dans la première heure) après l’opération, dans une fourchette de 151 à 160 mmol/L, parallèlement à une faible osmolalité urinaire (<130 mosm/L). Une DI transitoire a été considérée et elle a été mise sous desmopressine intraveineuse (IV desmopressine) 1 mcg qui a été administrée quotidiennement en même temps qu’une perfusion saline demi forte de 3,5-4 L pendant 3 jours consécutifs.
Cependant, elle a depuis développé un œdème pulmonaire (probablement une conséquence de la transfusion sanguine massive peropératoire, des fluides hypotoniques intraveineux et de la desmopressine IV concomitante) le jour postopératoire 4, la desmopressine IV a été arrêtée, et du plasma frais congelé et des diurétiques (furosémide 40 mg intraveineux) ont été administrés pour réduire l’œdème extra-vasculaire. Dans l’heure qui a suivi, elle a recommencé à développer une polyurie avec un débit urinaire de 800 ml en une heure et ses concentrations de sodium ont augmenté jusqu’à 172 mmol/l. Compte tenu de l’œdème cérébral postopératoire concomitant, il a été décidé d’abaisser les concentrations de sodium de manière ciblée de sorte que le taux de diminution du sodium reste dans les limites de 5-10 mmol/L/jour, avec un niveau cible de 155 mmol/L. Une faible dose de desmopressine IV de 0,25 mcg a été administrée, et un régime de titration a été suggéré en vue de maintenir un débit urinaire horaire inférieur à 100 ml/h. Elle a eu besoin d’une dose IV de 0,75 mcg de desmopressine au cinquième jour postopératoire, puis d’une dose IV de 0,25 mcg deux fois par jour au sixième jour lorsqu’elle a atteint un niveau cible de 155 mmol/l. Cette concentration de sodium a pu être maintenue avec le dosage de la desmopressine pendant encore 2 jours.
Le jour 9, en postopératoire, la desmopressine a été arrêtée car elle était capable de maintenir un faible débit urinaire sans desmopressine, et les concentrations de sodium étaient stables. À ce stade, on a estimé qu’elle avait développé un syndrome de sécrétion inappropriée d’hormone antidiurétique (SIADH) et les fluides ont été limités à 1 L/jour. Ses concentrations de sodium sont restées stables à 134-138 mmol/L pendant cette semaine.
Au jour 14 postopératoire, elle a développé à nouveau une polyurie avec une augmentation des concentrations de sodium et de l’osmolalité sérique. A ce moment, la desmopressine IV a été reprise à 0,25 mcg deux fois par jour. Les concentrations de sodium ont pu être maintenues à 138-150 mmol/L avec de la desmopressine IV (0,25 mcg deux fois par jour) et des liquides. Elle avait traversé une phase triphasique avec une période de DI transitoire, suivie d’une SIADH, puis d’une DI permanente (voir Figure 1). Les taux sériques de cortisol, d’hormone de croissance, de facteur de croissance analogue à l’insuline-1, de fonction thyroïdienne et de prolactine étaient tous dans la plage normale.

Figure 1. Graphique montrant toutes les mesures sérielles de notre patiente tout au long de son hospitalisation.
Après l’insertion d’une dérivation ventriculo-péritonéale (effectuée pour maintenir la pression intracrânienne) 6 semaines après l’excision de la MAV, elle a été transférée dans les services de rééducation et le régime de desmopressine intraveineuse a été converti en régime sous-cutané (SC) (voir Figure 1). Lorsque l’alimentation par sonde nasogastrique a été interrompue, nous avons essayé de réguler les fluides par la soif. Les analyses sanguines ont montré une augmentation des taux de sodium jusqu’à 165 mmol/L et elle n’a pas ressenti de soif pendant cette période d’hypernatrémie malgré une osmolalité sérique de 350 mosm/kg. Elle est restée adipique malgré la récupération de l’aphasie. Une échelle de soif n’a pas été utilisée car à l’interrogatoire, elle a verbalisé qu’elle ne ressentait aucune soif, et une échelle de soif ne pouvait pas être appliquée. Par conséquent, les fluides ont dû être régulés pour maintenir l’équilibre du sodium. Son débit urinaire était fixe et son équilibre sodique bien régulé par un régime SC de desmopressine 0,5 mcg le matin et 0,375 mcg le soir, avec des liquides régulés de 1,5-2 L par jour. Elle ne présentait aucun signe de troubles de la thermorégulation. Une cranioplastie en polyétheréthercétone (PEEK) a été réalisée ~4 mois après la chirurgie initiale.
Après 5 mois de rééducation multidisciplinaire intensive, elle avait toujours une main droite dominante non fonctionnelle et des déficits cognitifs résiduels importants, et un dosage sûr et une auto-administration de desmopressine sous-cutanée n’étaient pas possibles à long terme.
Un essai de desmopressine nasale et de desmopressine orale a montré une absorption variable significative entraînant des fluctuations plus importantes des concentrations de sodium. Par la suite, nous avons décidé d’utiliser la desmopressine sublinguale disponible sous le nom de desmopressine Melt. Après plusieurs essais de différents schémas posologiques, nous avons pu fixer le débit urinaire à environ 2 L/jour en utilisant la desmopressine Melt lyophilisée orale à 120 mcg (2 comprimés) le matin et 60 mcg (1 comprimé) le soir. Cependant, à cette dose, elle présentait une hyponatrémie à certains moments de la journée. Nous avons procédé à une nouvelle adaptation de la dose en coupant les comprimés de desmopressine à l’aide d’une pince à épiler/forceps pour les sortir de la plaquette thermoformée et les couper en quarts exacts (15 mcg chacun) à l’aide d’un coupe-pilule. Avec un régime de 90 mcg (1,5 comprimé) le matin et 75 mcg (1,25 comprimé) le soir, nous avons réussi à obtenir des résultats similaires à ceux obtenus avec le régime sous-cutané. Grâce à ce régime et à un apport hydrique régulé de 2 L/jour, ses concentrations de sodium ont été maintenues dans une fourchette de 135-150 mmol/L sans fluctuations majeures ni symptômes cognitifs. Ce dosage lui a également permis d’avoir une activité accrue dans la journée pour la rééducation et elle a pu bien dormir sans être perturbée par la polyurie la nuit.
Voir la figure 1 pour les mesures sérielles du sodium chez cette patiente tout au long de la période d’hospitalisation avec les événements décrits ci-dessus.
Au vu de l’histoire clinique et du fait que son hypophyse et son hypothalamus sont pour la plupart intacts, il est peu probable qu’elle ait eu des défauts significatifs de barorégulation.
Discussion
Pathophysiologie de l’ADI
Dans les conditions physiologiques, le sodium plasmatique, l’osmolalité et l’équilibre hydrique sont maintenus dans des plages étroites secondaires à une interaction minutieuse entre la soif et l’apport hydrique, la sécrétion de vasopressine neurohypophysaire et l’antidiurèse au niveau des tubules collecteurs distaux rénaux.
Les signaux périphériques (osmocapteurs oropharyngés, intestinaux, osmolalité sanguine) codent en temps réel des informations sur l’état d’hydratation actuel et celles-ci sont intégrées au niveau central (5). Un état de déshydratation entraînera des signaux stimulants vers l’organe subfornical (SFO) qui, hiérarchiquement, envoie des signaux à l’organum-vasculosum de la lamina terminalis (OVLT) et au noyau préoptique médian (MnPO) (6). Le MnPO, qui peut servir de « détecteur central », envoie des signaux stimulants aux noyaux hypothalamiques pour augmenter la libération de vasopressine et envoie également un signal de soif accrue à travers le SFO et l’OVLT (7, 8). Les voies neuronales liées à la soif qui relient le SFO et l’OVLT aux cortex cingulaire et insulaire entraînent la perception consciente de la soif (7, 8). Au contraire, dans l’état d’hydratation adéquate, les signaux provenant des capteurs périphériques conduisent à une inhibition de ces zones, et à une rétroaction négative de la MnPO conduisant à la suppression de la soif et à une diminution de la sécrétion et de la libération de vasopressine (circuit rouge). En effet, les neurones de la MnPO, de l’OVLT et de la SFO sont largement et réciproquement interconnectés puisque l’activation optogénétique et chimiogénétique des neurones de l’une de ces zones peut stimuler la soif (9). Par conséquent, la perturbation de l’apport sanguin entraînant des lésions cellulaires conduira à l’adipsie. Des cas d’IAD dus à l’auto-immunité des cellules neuronales de la SFO et de l’OVLT ont également été publiés, indiquant l’importance fonctionnelle de ces capteurs neuronaux dans le contrôle de la soif (10).
Les neurones AVP présentent une activité « phasique » des potentiels d’action avec des intervalles où l’AVP est libérée aux terminaisons de l’axone. La libération de vasopressine est régulée par les entrées osmosensorielles du MnPO, par les barorécepteurs et il existe également une régulation anticipée dans laquelle la libération de vasopressine est stimulée avant les repas (prandial), lors d’une hyperthermie et selon un schéma circadien (11). Il existe un schéma circadien quotidien de sécrétion de la vasopressine dans la circulation avec une augmentation des niveaux entre 24h00 et 02h00 et des niveaux qui diminuent progressivement au cours de la journée avec un nadir entre 16h00 et 20h00 (12). Cette augmentation circadienne à minuit causée par une augmentation de la libération de vasopressine résulte en partie d’une excitation synaptique accrue des neurones neurosécrétoires magnocellulaires par le noyau suprachiasmatique qui est connu pour réguler le rythme circadien (11). Dans l’IAD, la régulation osmosensorielle de la sécrétion de vasopressine est la plus affectée et les autres effets peuvent être variables selon le site et l’étendue de la lésion alors que la réponse baroréceptrice est connue pour être préservée chez de nombreux patients avec des lésions limitées comme l’a démontré une étude (13).
L’AVP agit sur les canaux collecteurs rénaux via les récepteurs de la vasopressine-2 (V2) pour augmenter la perméabilité à l’eau ce qui entraîne une diminution de la formation d’urine. La réabsorption de l’eau est contrôlée par la régulation du canal hydrique, l’aquaporine-2 (AQP2). L’AVP induit à court terme la translocation intracellulaire des vésicules portant l’AQP2 vers la membrane plasmique apicale, régulant ainsi le trafic de l’AQP2. A long terme, avec des concentrations adéquates d’AVP, elle régule la transcription du gène AQP2 pour augmenter l’abondance de la protéine AQP2 dans le canal collecteur (14). Dans l’IAD, nous postulons qu’il est probable que la réponse osmosensorielle aiguë soit plus affectée que la réponse chronique. Par conséquent, il y aura une abondance relative d’aquaporine mais le trafic aigu vers la membrane apicale sera affecté.
Voir la figure 2 pour une illustration détaillée des mécanismes.
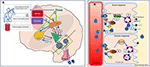
Figure 2. Représentation schématique de la régulation de l’équilibre hydrique chez l’homme. (A) Le contrôle et la régulation de la sécrétion de vasopressine dans le cerveau. (A) Les signaux périphériques (osmocapteurs oropharyngés, intestinaux, osmolalité sanguine) codent des informations sur l’état actuel d’hydratation en temps réel (1) et intégrées de manière centrale (2). Un état de déshydratation entraîne des signaux stimulants pour la SFO qui, hiérarchiquement, envoie des signaux à l’OVLT et à la MnPO (3). Le MnPO, qui peut servir de « détecteur central », envoie des signaux stimulants aux noyaux hypothalamiques pour augmenter la libération de vasopressine (4), et envoie également un signal de soif accrue à travers le SFO et l’OVLT (5, circuit bleu dans le schéma). Au contraire, dans l’état d’hydratation adéquate, les signaux provenant des capteurs périphériques, il y a une inhibition de ces zones et une rétroaction négative de la MnPO conduisant à la suppression de la soif et à la diminution de la sécrétion et de la libération de vasopressine (circuit rouge 6). Les voies neuronales liées à la soif reliant la SFO et l’OVLT au cortex cingulaire et insulaire aboutissent à la perception consciente de la soif (7). Dans la DI adipsique, en l’absence de stimuli osmosensoriels, les circuits neuronaux associés, en raison des dommages cellulaires, de la libération stimulante ou de l’inhibition de la vasopressine, et la perception consciente de la soif sont tous deux perturbés. (B) Le mécanisme d’action de la vasopressine sur les tubules collecteurs rénaux. (B) La vasopressine dans la circulation sanguine se fixe au récepteur 2 de la vasopressine sur la surface luminale des cellules principales du tubule collecteur distal des reins (1). Dans la phase aiguë, via la synthèse de l’AMPc à partir de l’ATP par l’AC (adénylate cyclase), elle forme la protéine kinase A (2) qui stimule la translocation de l’aquaporine de la vésicule de stockage vers la membrane apicale et la surface luminale du sang (3). Il en résulte que l’eau est transportée dans la cellule (4) et absorbée ensuite dans la circulation (5). Dans la phase chronique, par le biais du contrôle transcriptionnel du gène de l’aquaporine médié par l’AMPc (6), des niveaux accrus du canal hydrique aquaporine peuvent être trouvés dans les cellules principales (7). Dans l’ID adipeuse, la réponse aiguë est susceptible d’être plus affectée que la réponse chronique, car la sécrétion de vasopressine liée à l’osmosensoriel est affectée.
Recherche documentaire
Nous avons effectué une recherche documentaire systématique incluant Pubmed, Scopus et Embase pour les cas rapportés en tant que rapport de cas ou série de cas d’ID adipeuse des années 1980 à 2018. Nous avons utilisé le terme de recherche : Adipsia, Adipsic disorder, et Adipsic DI et nous avons limité la recherche à la langue anglaise et aux Humains. Nous avons également recherché toute autre référence identifiée lors de la lecture de chaque rapport de cas/série de cas. Nous avons trouvé 25 références (10, 13, 15-39) avec un total de 45 cas rapportés dans la littérature. Nous avons résumé tous les rapports de cas dans le tableau 1.
Tableau 1. Données démographiques, étiologie, présentation clinique, prise en charge et pronostic des patients atteints de diabète insipide adipeux rapportés dans la littérature.
Causes de l’IAD
Quarante pour cent (17/46) des cas d’IAD décrits dans la littérature sont survenus secondairement à une rupture d’anévrisme de l’artère communicante antérieure (ACOM) et à un clippage post-chirurgical utilisant une approche de craniectomie frontale. Dans un cas, la double pathologie d’un craniopharyngiome et d’un anévrisme de l’ACOM a été décrite (15). L’alimentation artérielle de l’OVLT a été décrite comme provenant de quatre sources (40) : (1) une source médiane supérieure qui se ramifie à partir de l’artère communicante antérieure, (2) et (3) deux sources latérales provenant d’artères qui se ramifient à partir de chaque artère cérébrale antérieure sous l’artère communicante antérieure, et (4) une source médiane inférieure qui monte sous le chiasma optique. De manière caractéristique, les capillaires qui tapissent cet organe se trouvent en dehors de la barrière hémato-encéphalique et, par conséquent, un changement d’osmolalité peut être facilement perçu par ces organes (41). Il faut noter que l’amélioration des techniques chirurgicales et l’utilisation du coiling au lieu du clipping peuvent réduire ces complications. Chez les patients en bonne condition clinique présentant une rupture d’anévrisme de la circulation antérieure et pouvant être traités par coiling, les données d’une méta-analyse montrent que le coiling est associé à un meilleur résultat (42). Par rapport au clippage dans lequel les deux extrémités de l’ACA sont clippées avec une interruption de l’alimentation en sang de l’hypothalamus, la procédure d’insertion d’un coil dans l’anévrisme est capable de préserver les alimentations de l’hypothalamus dans la plupart des cas.
La deuxième cause d’IAD a été décrite comme un craniopharyngiome suprasellaire (17/46). Ces cas impliquent souvent une excision trans-frontale et une récupération après chirurgie a été décrite dans certains cas. Un cas d’hémangiome caverneux avec une manifestation similaire après un épisode hémorragique a également été décrit (26).
Les tumeurs hypothalamiques incluant l’hamartome, la tumeur de la glande pinéale et la tumeur des cellules germinales peuvent présenter une DJA (26, 29, 30). Un cas de carcinome hépatocellulaire avec métastase dans l’hypothalamus et une DJA résultante a été rapporté (31).
Il est intéressant de noter que seuls deux cas de tumeurs hypophysaires avec DJA ont été décrits (18, 32). Ces deux cas présentaient une tumeur agressive avec de multiples résections trans-frontales et une hémorragie intracrânienne en per-opératoire. Un cas chacun a été décrit en relation avec un traumatisme crânien et une exposition au toluène également (13).
Quatre cas ont été décrits avec une présentation aiguë soudaine de polyurie et d’hypernatrémie. Ces patients ne présentaient aucune anomalie structurelle de l’hypothalamus et des examens détaillés ont révélé la présence d’anticorps dirigés contre les organes de l’OVLT. Ces cas ont été postulés comme ayant une pathologie auto-immune sous-jacente (10, 33).
Des cas congénitaux ou de la petite enfance chez des patients ayant des problèmes de développement du corps calleux ont également été décrits avec une manifestation de l’ADI (34-38). Un cas de neurosarcoïdose affectant largement l’hypophyse antérieure, l’hypophyse postérieure et l’hypothalamus avec une DJA a également été décrit (39).
Présentation clinique de la DJA
La présentation clinique dans la plupart des cas décrits est une polyurie dans la semaine immédiate après le clippage chirurgical pour une MAV ou après une craniotomie. La présentation biochimique est une hypernatrémie avec une augmentation de l’osmolalité sérique en présence d’une urine diluée de manière inappropriée dans de grands volumes. Si la sensation de soif est évaluée à l’aide d’une échelle de soif, ces patients atteints d’IAD signalent une soif faible ou minimale malgré l’hypernatrémie. Il est intéressant de noter que ces patients ont une réponse normale à l’hypotension et que leur mécanisme barorécepteur est intact (13).
Notre patient a traversé une phase triphasique d’une DI initiale, suivie d’une SIADH puis d’une DI permanente. Ce schéma décrit comme une réponse triphasique a été décrit après des chirurgies de l’hypophyse et du craniopharyngiome. La physiopathologie de la réponse triphasique semble s’expliquer par un dysfonctionnement hypothalamique précoce (caractérisé par une polyurie et une hypernatrémie), une libération ultérieure de vasopressine préformée à partir des vésicules de stockage dans l’hypophyse postérieure (non liée à un stimulus) (caractérisée par une SIADH) et, enfin, un épuisement des réserves de vasopressine (DI permanente) (43). Chez notre patient, il est probable qu’à la troisième phase, le déficit de la réponse à l’osmolalité dans la libération de la vasopressine soit démasqué après la résolution du SIADH, plutôt qu’une déplétion absolue de la vasopressine.
Complications associées de l’IAD
Peu de rapports de cas ont décrit des troubles de la thermorégulation. Le panhypopituitarisme a été rapporté dans des cas de craniopharyngiome et dans des cas de tumeur hypophysaire seulement et n’était pas présent chez notre patient.
Bien que n’étant pas systématiquement rapportées, d’autres complications importantes de l’hypernatrémie incluent la thrombose veineuse profonde ; par conséquent, l’héparine de faible poids moléculaire peut être indiquée pendant la maladie aiguë et l’immobilisation (18).
L’obésité hypothalamique et l’apnée du sommeil ont été couramment rapportées également (18). Dans une série de cas (13), où ils ont évalué la réponse de l’AVP à l’hypotension, ils ont trouvé que les patients avec des craniopharyngiomes avaient également une perte de la réponse de l’AVP baro-régulée. Ces patients présentaient des signes de panhypopituitarisme, ce qui indique que la chirurgie de leurs tumeurs avait laissé des dommages plus étendus à l’hypophyse, y compris l’hypophyse postérieure qui est la dernière voie commune pour la sécrétion d’AVP.
Approches de gestion de l’IDA
La gestion de ces cas a été décrite (15, 18). L’éducation du patient et de sa famille sur les principes de l’équilibre hydrique et de sa gestion est cruciale. L’apport hydrique peut être fixé à 1,5-2 L par jour, puis la titration de la desmopressine effectuée. Le suivi quotidien du poids est utile pour détecter une déshydratation ou une surcharge hydrique. Il est recommandé d’effectuer des concentrations hebdomadaires de sodium plasmatique pour surveiller les fluctuations. Malgré une surveillance stricte, il est difficile de reproduire un contrôle permanent des concentrations plasmatiques de sodium qui imite l’osmorégulation physiologique. Compte tenu du risque de fluctuations rapides des concentrations de sodium et des symptômes d’hyponatrémie observés dans la plage de référence basse, il est conseillé de maintenir les concentrations de sodium dans la plage de référence supérieure.
La desmopressine l’analogue synthétique de l’AVP a été introduite pour la première fois dans le traitement de l’ID en 1972 (44). La plupart des patients se portent bien avec de faibles doses de desmopressine administrées deux fois par jour. Il existe un équilibre fin et les niveaux de sodium peuvent osciller jusqu’à des niveaux très bas avec des escalades de dose infimes.
Notre patient s’est très bien comporté avec de très faibles doses d’administrations parentérales qui sont connues pour avoir la plus faible variabilité de biodisponibilité (45). L’absorption des formulations intranasales est très variable, en particulier chez les enfants ou les adultes ayant des problèmes cognitifs, car ils peuvent ne pas inhaler la solution de manière cohérente (46, 47). Les formulations orales sont une bonne option car l’augmentation de la dose entraîne une durée d’action plus longue mais n’a pas d’effet maximal (48-50). Nous avons essayé cette forme à des doses variables de 50-100 mcg, mais nous avons constaté des variations importantes des effets d’un jour à l’autre avec cette formulation. La desmopressine sublinguale (Minirin Melt) est disponible depuis 2005. Des études pharmacologiques ont démontré que la voie sublinguale entraîne une biodisponibilité supérieure de ~60% par rapport à la voie orale (49, 50). Des doses affinées de desmopressine sublinguale ont pu être obtenues en coupant chaque comprimé de 60 mcg, ce qui permet d’ajuster la dose de 65 à 90 mcg par voie sublinguale. Un profil pharmacocinétique similaire de ces comprimés fractionnés a été décrit (51). La prise concomitante d’aliments est connue pour diminuer la vitesse et l’étendue de l’absorption de 40% ; il est donc préférable d’éviter toute consommation d’aliments dans l’heure qui précède et qui suit l’administration des comprimés de desmopressine sublinguale. Un protocole détaillé d’administration de fluides avec surveillance quotidienne du sodium avec de la desmopressine sous-cutanée à dose fixe a récemment été décrit (28), démontrant la difficulté de la surveillance quotidienne. Un autre rapport de cas récent (27) a également rapporté l’utilisation de la forme sublinguale de la desmopressine pour l’ADI à la dose de 60 et 120 mcg par jour. L’utilisation de la desmopressine sublinguale peut être une alternative utile dans les cas où les effets optimaux ne peuvent être atteints avec d’autres formulations. Ces patients nécessitent une surveillance stricte du poids quotidien, du volume d’urine et de l’apport en liquide 24 heures sur 24. Compte tenu des troubles cognitifs et de la mémoire, ces patients ont tendance à avoir, ils ont généralement besoin d’un soignant pour surveiller la prise de liquide afin de s’assurer qu’ils boivent le volume requis.
Dans notre revue de cas, 6 patients ont eu une rémission de l’ADI dont 2 étaient liés à un anévrisme de l’ACOM (15, 16) et 4 étaient liés à un craniopharyngiome (15, 26). Un patient atteint de neurosarcoïdose a eu une rémission sous traitement par Infliximab (39). De telles observations peuvent suggérer que les osmorécepteurs régulant la soif et leurs voies efférentes font preuve de plus de neuroplasticité que ceux régulant la production d’AVP (26).
Conclusion
L’IAD est une complication extrêmement rare des troubles hypothalamiques qui entraîne une perte de fonction du centre de la soif. En raison du contrôle hiérarchique du centre de la soif, l’absence de soif est également associée à une perte de régulation de la vasopressine et à une polyurie. Les sujets souffrant d’IAD doivent être délicatement pris en charge avec de faibles doses de desmopressine et un équilibre hydrique. Avec les approches actuelles de surveillance et de soins personnalisés, il n’est toujours pas possible d’imiter l’osmorégulation quasi-physiologique 24 heures sur 24.
Data Availability
Tous les ensembles de données générés pour cette étude sont inclus dans le manuscrit/les fichiers complémentaires.
Ethics Statement
Un consentement éclairé écrit a été obtenu de la ou des personnes pour la publication de toute image ou donnée potentiellement identifiable incluse dans cet article.
Consentement à participer
Nous avons obtenu la permission écrite du plus proche parent du patient pour écrire et publier ce manuscrit.
Contributions des auteurs
RD était l’endocrinologue principal qui a géré l’équilibre des fluides du patient, a conceptualisé l’idée, a écrit le manuscrit, a fait la revue de la littérature, a acquis les données, a écrit et a revu le manuscrit final. HC, AC et JH étaient des résidents impliqués dans la prise en charge de ce patient et ont révisé le manuscrit final. HT était l’anesthésiste en charge de ce patient pendant la phase de soins intensifs, a conceptualisé l’idée et a évalué de manière critique le manuscrit final. KC était le principal spécialiste de la réadaptation en charge de ce patient ; elle a conceptualisé l’idée et évalué de manière critique le manuscrit final. BB a conceptualisé l’idée et évalué de manière critique le manuscrit final.
Funding
RD a été soutenu en partie par la subvention de centre du Conseil national de la recherche médicale (NMRC/CG/017/2013) et la bourse de clinicien scientifique du Conseil national de la recherche médicale (MOH-CSAINV17nov-0006).
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions la patiente et ses parents de nous avoir permis d’écrire et de publier ce manuscrit.
1. Eisenberg Y, Frohman LA. Le diabète insipide adipique : une revue. Endocr Pract. (2016) 22:76-83. doi : 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Anomalies de la régulation de la soif. Kidney Int. (1984) 25:460-9. doi : 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Un système de classification proposé pour les malformations artério-veineuses. J Neurosurg. (1986) 65:476-83. doi : 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. L’utilisation du coma induit par les barbituriques pendant les procédures de neurochirurgie cérébrovasculaire : une revue de la littérature. Brain Circ. (2015) 1:140-6. doi : 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi : 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Architecture neuronale hiérarchique qui sous-tend la régulation de la soif. Nature. (2018) 555:204-9. doi : 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Régulation de la soif et de la libération de vasopressine. Annu Rev Physiol. (2019) 81:359-73. doi : 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Des organes sensoriels circumventriculaires au cortex cérébral : voies neurales contrôlant la soif et la faim. J Neuroendocrinol. (2019) 31:e12689. doi : 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Le noyau préoptique médian : front et centre pour la régulation des fluides corporels, du sodium, de la température, du sommeil et de l’homéostasie cardiovasculaire. Acta Physiol. (2015) 214:8-32. doi : 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunity to the sodium-level sensor in the brain causes essential hypernatremia. Neuron. (2010) 66:508-22. doi : 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmorégulation de la sécrétion de vasopressine et de la soif dans la santé et la maladie. Clin Endocrinol. (1998) 29:549-76. doi : 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. La base neurale de la soif homéostatique et anticipée. Nat Rev Nephrol. (2018) 14:11-25. doi : 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Barorégulation de la libération de vasopressine dans le diabète insipide adipeux. J Clin Endocrinol Metab. (2002) 87:4564-8. doi : 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Mécanismes moléculaires régulant l’aquaporine-2 dans le canal collecteur du rein. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi : 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Modèles hétérogènes de récupération de la soif chez les patients adultes atteints de diabète insipide adipeux. QJM. (2016) 109:303-8. doi : 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Adaptation compensatoire rénale pour la manipulation de l’eau chez un patient atteint de diabète insipide adipique après le clippage d’un anévrisme rompu de l’artère communicante antérieure. Clin Nephrol. (2017) 88:112-6. doi : 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus after clipping of aneurysm anterior communicating artery. BMJ. (1991) 303:1465-7. doi : 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Syndrome adipocytaire hypothalamique : diagnostic et prise en charge. Clin Endocrinol. (1997) 47:405-9. doi : 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsic hypernatremia and diabetes insipidus following anterior communicating artery aneurysm clipping : diagnostic and therapeutic challenges in the amnestic rehabilitation patient. Brain Injury. (2001) 15:975-80. doi : 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Hypernatrémie et hypothermie chroniques après une hémorragie sous-arachnoïdienne. Postgrad Med J. (1986) 62:467-741. doi : 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsie et hypothermie après une hémorragie sous-arachnoïdienne. BMJ. (1971) 3:411-2. doi : 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Aperçus cliniques sur le diabète insipide adipsique : une grande série de cas. Clin Endocrinol. (2007) 66:475-82. doi : 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypothalamic obesity complicated by adipsic central diabetes insipidus following surgical resection of a craniopharyngioma. J Clin Hypertens. (2009) 11:608-10. doi : 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Rhabdomyolyse sévère due à une hypernatrémie adipique après une chirurgie du craniopharyngiome. Arq Bras Endocrinol Metabol. (2007) 51:7. doi : 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia : case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi : 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Évaluation objective de la récupération de la soif chez les patients atteints de diabète insipide adipeux. Pituitaire. (2011) 14:307-11. doi : 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Diabète insipide adipique secondaire à une résection de craniopharyngiome. BMJ Case Rep. (2019) 12:e225903. doi : 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Protocole de surveillance quotidienne du sodium et de l’apport liquidien : prévention des hospitalisations récurrentes dans le diabète insipide adipeux. J Endoc Soc. (2019) 3:882-6. doi : 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsie chez un patient atteint de diabète insipide. Case Rep Oncol. (2015) 8:385-8. doi : 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Goutte à début juvénile et diabète insipide adipeux : un rapport de cas et une revue de la littérature. J Int Med Res. (2018) 46:4829-36. doi : 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Hyperosmolarité et hypernatrémie sévères chez une jeune femme adipeuse. Clin Nephrol. (2011) 76:407-11. doi : 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Diabète insipide adipique après une chirurgie hypophysaire pour un macroprolactinome. Pituitaire. (2006) 9:59-64. doi : 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia without hypothalamic lesions accompanied by autoantibodies to subfornical organ. Brain Pathol. (2017) 27:323-31. doi : 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasie du corps calleux associée à une hypernatrémie adipique et à un hypogonadotropinisme hypothalamique : rapport de cas et revue de la littérature. Pediatr Int. (2001) 43:683-7. doi : 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Hypernatrémie chronique provenant d’un défaut congénital dans l’osmorégulation de la soif et de la vasopressine. J Pediatr. (1983) 102:703-8. doi : 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essential hypernatremia, antidiuretic hormone and neurohypophysin secretion : response to chlorpropamide. Acta Endocrinol. (1981) 96:145-53. doi : 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Adipsic hypernatremia in two sisters. Am J Dis Child. (1991) 145:321-5. doi : 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. A case of chronic hypernatremia with corpus callosum agenesis. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Rémission radiologique et récupération de l’appréciation de la soif après un traitement à l’infliximab dans un diabète insipide adipeux secondaire à une neurosarcoïdose. QJM. (2015) 108:657-9. doi : 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi : 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Les organes circumventriculaires : un atlas d’anatomie comparative et de vascularisation. Brain Res Rev. (2007) 56:119-47. doi : 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. (2018) 8:CD003085. doi : 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Water balance disorders after neurosurgery : the triphasic response revisited. NDT Plus. (2010) 3:42-4. doi : 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effets du DDAVP, un analogue synthétique de la vasopressine, chez les patients atteints de diabète insipide crânien. Acta Med Scand. (1972) 192:21-7. doi : 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Pharmacocinétique et pharmacodynamique de la desmopressine administrée par voie orale versus intraveineuse de jour versus de nuit chez des hommes sains âgés de 55 à 70 ans. Eur J Clin Pharmacol. (2004) 60:397-402. doi : 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressine 30 ans d’utilisation clinique : un examen de la sécurité. Curr Drug Saf. (2007) 2:232-8. doi : 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Traitement du diabète insipide neurohypophysaire. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi : 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Pharmacocinétique de la vasopressine 1-déamino-8-D-arginine après diverses voies d’administration chez des volontaires de santé. Clin Endocrinol. (1993) 38:177-82. doi : 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Pharmacocinétique, pharmacodynamique, efficacité à long terme et sécurité de la vasopressine 1-désamino-8-D-arginine orale chez les patients adultes atteints de diabète insipide central. Br J Clin Pharmacol. (1996) 42:379-85. doi : 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasma pharmacokinetics of desmopressin following sublingual administration : an exploratory dose-escalation study in healthy male volunteers. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi : 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Lyophilisat de desmopressine pour le traitement du diabète insipide central : première expérience chez de très jeunes nourrissons. Int J Endocrinol Metab. (2014) 12:e16120. doi : 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar
.