- Introduction
- Matériels et méthodes
- Critères d’inclusion
- Stimulation ovarienne et prélèvement d’ovocytes
- Politique de transfert d’embryons
- Mesures des résultats primaires et analyse statistique
- Résultats
- Paramètres des ovocytes et des embryons
- Résultats de la grossesse et taux de naissances vivantes cumulatif (CLBR)
- Discussion
- Conclusion
- Disponibilité des données
- Déclaration d’éthique
- Contributions des auteurs
- Financement
- Déclaration de conflit d’intérêts
- Remerciements
Introduction
Récemment, un nouveau système, les critères POSEIDON, a été développé pour classer les patients infertiles de faible pronostic subissant un traitement par technologie de reproduction assistée (ART) (1). Il s’agit d’un système utile pour l’identification et la classification des patientes présentant une réserve ovarienne altérée ou une faible réponse ovarienne (ROP), qui permet de guider le diagnostic et la prise en charge de ces patientes (2). Quatre sous-ensembles ont été proposés sur la base de paramètres quantitatifs et qualitatifs, notamment l’âge, les biomarqueurs de la réserve ovarienne et la réponse ovarienne. Les nouveaux critères, en introduisant une stratification plus détaillée de la ROP, ont considérablement réduit l’hétérogénéité des patientes répondant aux critères de Bologne (3), ce qui pourrait différencier des sous-ensembles de patientes au sein de la population de ROP qui pourraient être identifiés et bénéficier d’interventions spécifiques (4). Bien que les critères POSEIDON aient été établis, ainsi que certaines recommandations de traitement spécifiques proposées pour les sous-groupes de patients spécifiques (5), les preuves restent insuffisantes pour soutenir la validité des paramètres utilisés dans les critères POSEIDON, ainsi que l’évaluation des résultats des différents sous-groupes.
Parmi les quatre groupes basés sur les critères POSEIDON, le groupe 1 est sans aucun doute le groupe de meilleur pronostic compte tenu de leur jeune âge et de leur réserve ovarienne normale, tandis que le groupe 4 a le pire pronostic en raison de l’âge avancé et de la réserve ovarienne diminuée. Cependant, une question intéressante est de savoir qui obtiendrait de meilleurs résultats en matière de grossesse, les femmes plus âgées (groupe 2) avec une réserve ovarienne normale ou les jeunes femmes (groupe 3) avec une réserve ovarienne diminuée. Le taux cumulatif de naissances vivantes (TCVV) est considéré comme une mesure préférable du succès du traitement par FIV (6). Jusqu’à présent, il y a eu très peu de rapports sur les CLBR des quatre groupes de patientes définis par les critères POSEIDON.
Les caractéristiques et le pronostic des patientes devraient être utilisés pour développer des stratégies de gestion clinique. L’objectif de cette étude est de caractériser les patients à faible pronostic afin de faciliter la prise de décision thérapeutique. Dans cette étude, les caractéristiques de base et les résultats des groupes de patients définis par les critères POSEIDON ont été analysés, et le CLBR résultant d’un cycle de fécondation in vitro (FIV)/injection de spermatozoïdes intracytoplasmiques (ICSI) aspiré a été proposé comme mesure de résultat primaire pour les patients à faible pronostic subissant un traitement par FIV (7).
Matériels et méthodes
Cette étude rétrospective a inclus 18 455 cycles de FIV à aspiration fraîche avec transferts ultérieurs d’embryons congelés de janvier 2014 à janvier 2017 dans notre centre. Le résultat de la naissance vivante a été suivi pendant au moins 2 ans jusqu’en janvier 2019. L’étude a été approuvée par le comité d’éthique pour l’application clinique des techniques de reproduction humaine assistée de l’hôpital pour femmes et enfants du Nord-Ouest (n° 2018002). Le comité d’éthique a approuvé cette étude en supprimant la nécessité d’obtenir un consentement éclairé. Toutes les recherches ont été effectuées conformément aux directives et règlements pertinents.
Critères d’inclusion
Les patients ont été catégorisés selon les critères POSEIDON :
Patients à faible pronostic
Groupe 1 (n = 879 cycles) : Âge < 35, nombre de follicules antraux (AFC) ≥ 5, nombre d’ovocytes prélevés ≤ 9 au cours du cycle précédent;
Groupe 2 (n = 482 cycles) : Âge ≥ 35, AFC≥5, nombre d’ovocytes prélevés ≤ 9 au cours du cycle précédent;
Groupe 3 (n = 858 cycles) : Âge < 35, AFC < 5;
Groupe 4 (n = 1 306 cycles) : Âge ≥ 35, AFC < 5;
Patientes au pronostic non faible
Groupe 5 (n = 664 cycles) : AFC ≥ 5, stimulation ovarienne antérieure > 9 ovocytes;
Groupe 6 (n = 13708 cycles) : AFC ≥ 5, pas de stimulation ovarienne antérieure.
Le diagramme de flux et la procédure de traitement des données sont indiqués dans la figure 1. Les caractéristiques démographiques et basales des patientes sont présentées dans le tableau 1.
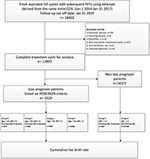
Figure 1. Organigramme et traitement des données.
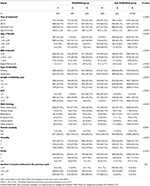
Tableau 1. Données démographiques et caractéristiques de base.
Stimulation ovarienne et prélèvement d’ovocytes
Le protocole de stimulation ovarienne (OS) a été déterminé individuellement en fonction de l’âge de la femme, de l’indice de masse corporelle (IMC), de l’hormone folliculo-stimulante (FSH) basale et du nombre de follicules antraux (AFC). 94,33% des patientes en FIV ont reçu des gonadotrophines recombinantes et/ou urinaires (rFSH/hMG) dans le cadre d’un protocole agoniste de la GnRH ou d’un protocole antagoniste de la GnRH suivi d’une FIV ou d’une ICSI. Pour les femmes dont la réserve ovarienne est diminuée, on a utilisé le protocole de stimulation légère ou de stimulation ovarienne en phase lutéale ou le cycle naturel. La gonadotrophine ménopausique humaine (hMG, Li Zhu, Chine) a été ajoutée dans le protocole d’ovulation douce ou le protocole de Shanghai en fonction de la réponse des patientes à la stimulation. La gonadotrophine chorionique humaine (hCG) 4 000-10 000 UI ou la hCG recombinante (r-hCG, MerckSerono S.p.A.) 250μg a été administrée lorsque 2-3 follicules ont atteint la taille de 17 mm ou plus. Trente-six heures plus tard, le prélèvement d’ovocytes a été effectué par aspiration guidée par échographie transvaginale. Les paramètres de stimulation ovarienne de chaque groupe sont listés dans le tableau 2.

Tableau 2. Paramètres de stimulation ovarienne.
Politique de transfert d’embryons
Les procédures de traitement des ovocytes et de développement des embryons ainsi que le système de notation des embryons ont été décrits dans nos articles précédents (8, 9). Les embryons de grade 1-3 au jour 3 étaient considérés comme des embryons utilisables, et les embryons de grade 1-2 étaient considérés comme des embryons de bonne qualité. Tous les transferts d’embryons (TE) frais ont été réalisés au jour 3 ou au jour 5. Dans les cas où le nombre d’embryons de bonne qualité au jour 3 était suffisant (≥ 3-4), le transfert de blastocystes au jour 5 était pratiqué. Outre les embryons transférés, les embryons supplémentaires des patientes étaient vitrifiés au jour 3 ou au stade de blastocyste (jour 5-6). Les embryons de stade de clivage 1-3 au jour 3 et les blastocystes avec un score de Gardner supérieur à 4CC ont été cryoconservés (Cryo-top, système ouvert, Kuwayama). Les méthodes et la procédure d’ET congelée sont détaillées dans une étude de vérification précédente de notre équipe (8, 9). En cas d’échec de l’implantation en cycle frais, le transfert d’embryons congelés-décongelés (TEC) était réalisé en utilisant les embryons ou blastocystes vitrifiés restants. Les patientes de moins de 35 ans ayant des embryons de bonne qualité étaient encouragées à bénéficier d’un transfert d’un seul embryon. Une politique de transfert d’un seul embryon était également appliquée pour les patientes présentant un utérus anormal (par exemple, utérus cicatriciel, malformation utérine) et/ou d’autres cas incompatibles avec une grossesse gémellaire. L’injection intramusculaire de progestérone (60 mg/jour) a été administrée pour le soutien de la phase lutéale à partir du jour de prélèvement des ovocytes jusqu’à une bêta-hCG sérique négative ou 8 semaines de grossesse.
Mesures des résultats primaires et analyse statistique
Le résultat primaire était la naissance vivante cumulative (CLB) définie comme au moins une naissance vivante résultant d’un cycle de TAR aspiré dans l’ET frais ou dans le FET ultérieur par rapport au nombre d’ovocytes prélevés. Le numérateur du calcul du CLBR était la somme des naissances vivantes obtenues dans les FET et des naissances vivantes dans les cycles frais. Seul le premier accouchement a été pris en compte dans l’analyse si une patiente a eu plusieurs accouchements. Le CLBR a été défini comme le nombre cumulé de naissances vivantes par prélèvement transvaginal d’ovocytes, conformément à la définition de la terminologie (7, 10). Un cycle de traitement complet se référait à un cycle de traitement qui a atteint la naissance vivante ou à un cycle de traitement qui n’a pas atteint la naissance vivante avec tous les embryons transférés. Le taux cumulé de naissances vivantes dans cette étude a été calculé sur la base du cycle de traitement complet, de sorte que les patientes (n = 337) de traitement non complet ont été exclues.
Le traitement des données et l’analyse statistique ont été effectués à l’aide du logiciel EmpowerStats (www.empowerstats.com) et des progiciels statistiques R. Pour évaluer l’odds ratio (OR) du CLBR dans les différents groupes de patients, un modèle de régression à variables multiples a été établi avec les facteurs de confusion potentiels comme variables et ajusté pour l’année de traitement, l’IMC féminin, le type d’infertilité, la durée de l’infertilité, la gravidité, la parité, l’étiologie principale, le protocole OS, le type de gonadotrophine et la dose initiale de FSH. Les patients ont été inscrits pendant 3 ans, période au cours de laquelle la procédure de FIV a été révisée. Pour éliminer le biais causé par ce facteur, le taux cumulé de naissances vivantes a été ajusté en fonction de l’année de traitement. L’IMC féminin, le type d’infertilité, la durée de l’infertilité, la gravidité, la parité et l’étiologie principale étaient des facteurs importants affectant la grossesse et la naissance vivante selon l’expérience ou la littérature. Le protocole OS, le type de gonadotrophine et la dose de départ de FSH sont les indicateurs clés pour affecter le nombre d’ovocytes prélevés et finalement les chances cumulées de naissances vivantes.
Résultats
Paramètres des ovocytes et des embryons

Tableau 3. Paramètres des ovocytes et des embryons et CLBR.
Résultats de la grossesse et taux de naissances vivantes cumulatif (CLBR)
Incompatible avec le modèle de distribution du nombre d’ovocytes et d’embryons par groupe, le CLBR dans l’ordre du plus élevé au plus bas était de 44.6% dans le groupe 1(n = 879), 35,5% dans le groupe 3(n = 858), 24,5% dans le groupe 2 (n = 482) et 12,7% dans le groupe 4 (n = 1306). Une analyse de régression à variables multiples a été réalisée avec les variables pouvant agir comme facteurs de confusion décrites dans les tableaux 1, 2. Les odds ratios (OR) ajustés du CLBR avec leurs intervalles de confiance (IC) à 95 % sont présentés dans le tableau 4. Conformément à la tendance des résultats non ajustés, le CLBR du groupe 3 (OR 0,9, IC à 95 % 0,7-1,2, p = 0,615) était légèrement inférieur et celui du groupe 5 (OR 1,3, IC à 95 % 0,9-1,7, p = 0,111) était légèrement supérieur au CLBR du groupe 1 sans différence statistique significative. Le CLBR du groupe 2 était significativement plus bas que celui du groupe 1 (OR 0,6, IC 95 % 0,4-0,8, p = 0,004) et le CLBR du groupe 4 était le plus bas (OR 0,4, IC 95 % 0,3-0,6, p < 0,001) par rapport au groupe 1. Le tableau 5 montre les résultats de grossesse par transfert frais ou FET chez les patients à faible pronostic. Les taux d’implantation dans les groupes âgés (groupe 2 et groupe 4) étaient significativement plus faibles que dans les groupes jeunes (groupe 1 et groupe 3).

Tableau 4. Analyse de régression logistique pour les CLBR.

Tableau 5. Résultats de grossesse par transfert à la fois d’embryons frais et congelés chez les patients à faible pronostic.
La figure 2 a montré le tableau de tendance des événements clés chez les patients à faible pronostic. Il y avait un croisement des lignes de tendance entre le groupe 2 et le groupe 3 après le transfert d’embryon. Les patientes du groupe 2 (âge ≥35 ; AFC ≥ 5) avaient un AFC plus élevé, plus d’ovocytes prélevés, plus d’embryons et plus d’embryons de bonne qualité, mais un taux d’implantation et un CLBR diminués. Au contraire, bien que les patients du groupe 3 (âge < 35 ; AFC < 5) aient eu moins d’ovocytes et d’embryons, le CLBR s’est avéré plus élevé que celui du groupe 2. L’analyse SWOT de 4 groupes de patients à faible pronostic définis par les critères POSEIDON est présentée dans la figure 3.
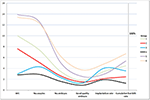
Figure 2. Graphique de tendance des événements clés chez les patients à faible pronostic. On observe un croisement des lignes de tendance entre le groupe 2 (rouge) et le groupe 3 (bleu) après le transfert d’embryon. L’axe X représente le nombre moyen d’AFC, le nombre d’ovocytes, le nombre d’embryons, le nombre d’embryons de bonne qualité, le taux d’implantation et le taux de naissance vivante cumulée. L’axe Y à gauche représente le nombre des quatre premières variables (n) et l’axe Y à droite représente le taux des deux dernières variables (%).

Figure 3. Analyse SWOT des 4 groupes de patients à faible pronostic définis par les critères POSEIDON.
Discussion
La principale conclusion de cette étude rétrospective dans la population définie par les critères POSEIDON était que le CLBR était le plus élevé dans le groupe 1, suivi du groupe 3 et du groupe 2, et le plus bas dans le groupe 4. D’après nos résultats, le CLBR des jeunes femmes ayant une faible réserve ovarienne (groupe 3) était légèrement inférieur à celui des jeunes femmes ayant une bonne réserve ovarienne et ayant déjà répondu faiblement au traitement (groupe 1). Bien que les patientes du groupe 2 (âge ≥ 35 ; AFC ≥ 5) aient eu une meilleure réserve ovarienne, plus d’ovocytes et plus d’embryons, le CLBR et le taux d’implantation, à l’inverse, étaient plus faibles que chez les patientes du groupe 3 ayant une moins bonne réserve ovarienne, moins d’ovocytes et moins d’embryons. Cette constatation pourrait faciliter le développement de stratégies de prise en charge des patientes à faible pronostic.
Les critères innovants de POSEIDON visent à identifier et à stratifier les patientes à faible pronostic en quatre groupes distincts en fonction de l’âge de la femme, de l’AFC et de la réponse ovarienne lors du cycle précédent (4). Les patientes du groupe 2 se caractérisaient par une bonne réserve ovarienne et un âge avancé, exactement à l’opposé des patientes du groupe 3 dont la réserve ovarienne est faible mais qui sont plus jeunes. Des études (11-13) ont montré que la CLBR augmente avec le nombre d’ovocytes prélevés, même chez les femmes d’un âge avancé (14). Il a été suggéré que le nombre d’ovocytes prélevés est une variable très importante associée de manière indépendante à la RBPC. On s’attendait à ce que les patientes du groupe 2 ayant un nombre plus élevé d’ovocytes aient un meilleur pronostic que les patientes du groupe 3, car les patientes du groupe 2 avaient plus d’embryons à transférer. Cependant, la RBPC et le taux d’implantation étaient inversement plus élevés dans le groupe 2 que dans le groupe 3.
Nos résultats sont cohérents avec les études précédentes (15, 16) sur l’association de la réserve ovarienne et du résultat de la grossesse. Chang et al. (15) ont constaté que les taux de fécondation normale, de clivage, d’embryons de haute qualité, d’implantation et de grossesse étaient plus faibles chez les femmes âgées que chez les femmes plus jeunes dont la réserve ovarienne était réduite. La principale raison était l’impact négatif du vieillissement des ovocytes sur l’issue de la grossesse (faible taux d’implantation et taux élevé de perte de grossesse) en raison d’anomalies chromosomiques (17) et d’un dysfonctionnement cytoplasmique (18). Le déclin de la fertilité avec le vieillissement concerne à la fois la quantité et la qualité de l’ovocyte. L’implantation et les fausses couches sont liées à la qualité des ovocytes mais pas nécessairement à la réserve ovarienne (16). La bonne réserve ovarienne du groupe 2 augmenterait la possibilité d’obtenir plus d’ovocytes et d’embryons à transférer, mais en même temps, le taux d’aneuploïdie plus élevé entraînerait un faible taux d’implantation et un taux élevé de fausses couches.
En ce qui concerne la prise en charge des patientes du groupe 2, il convient d’accorder plus d’attention au développement de stratégies d’amélioration de la qualité des ovocytes plutôt que de la quantité d’ovocytes ou d’embryons. Parce que plus d’embryons sont obtenus au jour 3 dans le groupe 2, la culture des embryons jusqu’au stade de blastocyste pour le transfert est une bonne option. Les embryons du jour 5-6 ont un taux plus faible d’aneuploïdie segmentaire (19) et une viabilité plus élevée pour l’implantation (20) que les embryons du jour 2-3. Les tests génétiques préimplantatoires pour les aneuploïdies (PGT-A) sont également bénéfiques pour les femmes avancées afin de sélectionner un embryon euploïde à transférer (21). Un régime de stimulation ovarienne optimal pour améliorer la qualité des ovocytes (22, 23) pourrait être une option alternative. Des suppléments tels que la déhydroépiandrostérone ont été essayés pour améliorer le développement folliculaire (24), bien qu’il n’y ait pas de preuves suffisantes pour soutenir leur utilisation chez ces patientes.
Les patientes du groupe 3 (âge < 35 ; AFC < 5) avaient une faible réserve ovarienne, qui étaient attendues comme des mauvaises répondeuses avec un mauvais résultat de grossesse. Il est intéressant de noter que le taux de production d’ovocytes (145,3 % d’ovocytes prélevés par CCF) dans le groupe 3 était significativement plus élevé que dans les autres groupes, bien que la dose initiale de FSH n’ait pas été augmentée de manière significative (Tableau 2). Cela suggère que la réponse des follicules antraux à la gonadotrophine a peut-être atteint la limite de sa capacité, et qu’il n’y aura donc aucun avantage supplémentaire en termes de nombre d’ovocytes à augmenter davantage les doses quotidiennes de gonadotrophine (25). L’évaluation de la sensibilité ovarienne à la FSH est un élément clé pour améliorer les taux de réussite de la FIV chez ces patientes au faible pronostic et ouvrir de nouvelles perspectives de traitement (26). Le taux élevé de production d’ovocytes par AFC dans le groupe 3 a également soutenu la recommandation rapportée d’une dose quotidienne maximale de 300 UI de rFSH (5). Pour les patientes du groupe 3, plus d’efforts devraient être concentrés sur l’augmentation du nombre d’ovocytes, car le résultat clinique de la grossesse est rassuré une fois que les ovocytes sont acquis.
Les patientes du groupe 5 étaient les patientes à pronostic non faible qui avaient une bonne réponse ovarienne (plus de 9 ovocytes dans le prélèvement précédent), cependant la plupart de ces patientes n’ont pas réussi à vivre la naissance dans le cycle de FIV précédent. Si l’on compare avec d’autres patientes au pronostic non faible ayant reçu un premier traitement de FIV (groupe 6), bien que les patientes du groupe 5 aient plus d’AFC et de nombre d’ovocytes prélevés, le développement embryonnaire et le résultat de la grossesse étaient inférieurs à ceux du groupe 6. Par conséquent, l’échec chez les patientes ayant reçu un premier traitement de FIV avec une bonne réponse ovarienne peut être le mauvais pronostic pour un traitement de FIV ultérieur.
Le facteur pelvien-tubaire est la cause la plus fréquente d’infertilité, représentant environ 10,8-78,3% des femmes infertiles en Chine (27, 28). Le facteur tubaire implique principalement une occlusion tubaire et une pathologie péritonéale causant des adhérences, qui ont été diagnostiquées par hystérosalpingographie et laparoscopie. La cause la plus fréquente de l’infertilité due au facteur tubaire a été attribuée à une maladie inflammatoire pelvienne (MIP), une salpingite et une endométriose (29). Dans les groupes de patientes de cette étude, le facteur tubaire est la principale étiologie de l’infertilité, allant de 62,9 à 71,4%, ce qui était plus élevé que celui des femmes infertiles d’autres pays et régions. Par conséquent, il faut être prudent pour interpréter les implications plus larges des résultats.
Les limitations sont liées à la nature rétrospective de l’étude et le fait que les données provenaient d’un seul centre affaiblit également l’universalité de nos observations. D’autres limitations potentielles pourraient être que le protocole non analogue à la GnRH a été utilisé chez certaines femmes ayant une réserve ovarienne diminuée plutôt que chez celles ayant une réserve ovarienne normale. Les cycles frais qui n’ont pas donné d’ovocyte n’ont pas été inclus dans cette étude, par exemple, les cycles avec annulation de la stimulation ovarienne.
Les résultats de cette étude peuvent fournir de nouvelles perspectives pour le développement de stratégies de gestion pour les patients à faible pronostic. Une analyse SWOT a été réalisée pour aider à la prise en charge des patientes à faible pronostic en clinique, à partir des rapports POSEIDON (1, 2, 4, 5) et des données de cette étude. La réactivité des follicules antraux à la gonadotrophine était extrêmement élevée dans le groupe 3 que dans les autres groupes. Compte tenu du résultat gratifiant du CLBR dans le groupe 3, afin d’augmenter le rendement ovocytaire, nous suggérons d’essayer plus de stimulations ovariennes mais pas une stimulation ovarienne plus forte par une dose quotidienne excessive de gonadotrophine. Bien que les patientes du groupe 2 aient une réserve ovarienne plus importante ainsi qu’un plus grand nombre d’ovocytes et d’embryons, le CLBR était plus faible que prévu. La stratégie de gestion du groupe 2 devrait être d’améliorer le taux de naissance vivante plutôt que d’augmenter le nombre d’ovocytes prélevés.
Conclusion
En conclusion, en contradiction avec le schéma de distribution de la quantité d’ovocytes et de la quantité d’embryons par groupe de patientes, les CLBR dans l’ordre du plus élevé au plus bas étaient dans le groupe 1 (jeunes femmes avec une bonne réserve ovarienne), le groupe 3 (jeunes femmes avec une faible réserve ovarienne), le groupe 2 (femmes d’âge avancé avec une bonne réserve ovarienne), et enfin le groupe 4 (femmes d’âge avancé avec une faible réserve ovarienne.
Disponibilité des données
Les données brutes soutenant les conclusions de ce manuscrit seront mises à disposition par les auteurs, sans réserve indue, à tout chercheur qualifié.
Déclaration d’éthique
L’étude a été approuvée par le comité d’éthique pour l’application clinique des techniques de reproduction humaine assistée de l’hôpital pour femmes et enfants Northwest (n° 2018002). Le comité d’éthique qui a approuvé cette étude a renoncé à la nécessité d’obtenir un consentement éclairé. Toutes les recherches ont été effectuées conformément aux directives et règlements pertinents.
Contributions des auteurs
WS et JS ont conçu et conçu l’étude. WS et WZ ont rédigé et révisé le manuscrit. WS, ZZ et WZ ont analysé et interprété les données. LT, ZZ et HZ ont collecté et nettoyé les données. Tous les auteurs ont lu et approuvé la version finale du manuscrit.
Financement
L’étude a été financée par les projets généraux de développement social de la province du Shaanxi (n° 2018SF-247) et le programme de formation du personnel de l’hôpital des femmes et des enfants du Nord-Ouest (2018ZD02).
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions tous les cliniciens, scientifiques et embryologistes de l’Hôpital des femmes et des enfants du Nord-Ouest pour leur aide à la collecte de données, et tous les patients pour leur contribution à cette étude. Nous remercions vivement le Dr Xinglin Chen du département d’épidémiologie et de biostatistique, X&Y solutions Inc. à Boston pour sa contribution au support statistique.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. Une nouvelle stratification plus détaillée des faibles répondeurs à la stimulation ovarienne : d’une réponse ovarienne pauvre à un concept de faible pronostic. Fertil Steril. (2016) 105:1452-3. doi : 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. La nouvelle stratification POSEIDON des « patients à faible pronostic dans la technologie de reproduction assistée » et son marqueur proposé de résultat réussi. F1000Res. (2016) 5:2911. doi : 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. Consensus ESHRE sur la définition de la « mauvaise réponse » à la stimulation ovarienne pour la fécondation in vitro : les critères de Bologne. Hum Reprod. (2011) 26:1616-24. doi : 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Définir les patients à faible pronostic soumis à la technologie de reproduction assistée : POSEIDON criteria-the why. Front Endocrinol. (2018) 9:461. doi : 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Facteurs liés à la grossesse clinique après un transfert d’embryon vitrifié-chauffé : une analyse de régression logistique rétrospective et multivariée de 2313 cycles de transfert. Hum Reprod. (2013) 28:1768-75. doi : 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Taux cumulatifs de naissances vivantes en fonction du nombre d’ovocytes prélevés après la première stimulation ovarienne pour une fécondation in vitro/injection intracytoplasmique de spermatozoïdes : une analyse multinationale multicentrique incluant environ 15 000 femmes. Fertil Steril. (2018) 110:661-70 e1. doi : 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Association entre le nombre d’ovocytes prélevés et le taux cumulatif de naissances vivantes chez les femmes âgées de 35 à 40 ans subissant des cycles longs de FIV/ICSI aux agonistes de la GnRH. Arch Gynecol Obstet. (2017) 296:1005-12. doi : 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Cumulative live birth rate prognosis based on the number of aspirated oocytes in previous ART cycles. Hum Reprod. (2019) 34:171-80. doi : 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Taux cumulatif de naissances vivantes et nombre d’ovocytes prélevés chez les femmes d’âge avancé. Une analyse dans un seul centre incluant 4500 femmes >/ = 38 ans. Hum Reprod. (2018) 33:2010-17. doi : 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Egg quality and pregnancy outcome in young infertile women with diminished ovarian reserve. Med Sci Monit. (2018) 24:7279-84. doi : 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients. Fertil Steril. (2017) 108:980-7. doi : 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Le vieillissement ovocytaire sous-tend le vieillissement reproductif féminin : mécanismes biologiques et stratégies thérapeutiques. Reprod Med Biol. (2015) 14:159-69. doi : 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi : 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparaison des résultats de grossesse après vitrification au stade du clivage et du blastocyste : une méta-analyse. J Assist Reprod Genet. (2018) 35:127-34. doi : 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteal phase ovarian stimulation may improve oocyte retrieval and oocyte quality in poor ovarian responders undergoing in vitro fertilization : preliminary results from a single-center prospective pilot study. Adv Ther. (2018) 35:847-56. doi : 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacité de la déhydroépiandrostérone (DHEA) pour surmonter l’effet du vieillissement ovarien (DITTO) : une preuve de principe en double aveugle randomisée contre placebo. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi : 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Understanding follicular output rate (FORT) and its implications for POSEIDON criteria. Front Endocrinol. (2019) 10:246. doi : 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Étude épidémiologique sur l’infertilité dans trois provinces de la Chine. Thèse de doctorat, Graduate School of Peking Union Medical College, Pékin, Chine (2011).
Google Scholar
28. Zhu Hui-li HW. Épidémiologie et étiologie de l’infertilité de l’oviducte. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar
.