- Introduction
- Matériels et méthodes
- Participants
- Procédures de l’étude, acquisition des données EEG et analyse
- Résultats
- Participants
- L’EEG à l’état de repos
- Comparaison des densités spectrales de puissance (DSP) du canal Fp1
- Canal Fp1 Comparaison test/retest EEG de repos
- Discussion
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
- Reconnaissance
Introduction
Les troubles neurodégénératifs représentent d’énormes besoins médicaux mondiaux non satisfaits et nécessitent le développement de nouvelles thérapies modifiant la maladie. Compte tenu de la nature insidieuse de ces troubles et du coût élevé de nombreux tests de diagnostic, il existe un besoin important de biomarqueurs largement disponibles, fiables et peu coûteux pour suivre la progression des processus neurodégénératifs dans des délais adaptés au développement de médicaments. Dans ce contexte, l’EEG pourrait avoir un potentiel remarquable. Bien que l’EEG soit sensible aux facteurs connus liés au mode de vie et aux médicaments, il présente de nombreux avantages considérables. L’EEG reflète l’activité synaptique, qui est un dénominateur commun de l’impact fonctionnel des processus neurodégénératifs. L’EEG est une technologie non invasive, portable, sûre et peu coûteuse, largement acceptée et nécessitant un temps d’acquisition relativement court. L’EEG qualitatif est couramment utilisé dans la pratique clinique pour le diagnostic de l’épilepsie. Plus récemment, l’intégration d’un biomarqueur EEG quantitatif (qEEG) et l’évaluation du clinicien ont été proposées pour l’évaluation du trouble déficitaire de l’attention/hyperactivité (TDAH) et ont reçu de la FDA (Food and Drug Administration) la désignation de classe II pour soutenir l’évaluation clinique du TDAH (Lenartowicz et Loo, 2014 ; Snyder et al., 2015). Le qEEG est en phase de recherche pour être utilisé comme critère d’évaluation des maladies neurodégénératives dans les essais cliniques. Cependant, les progrès récents dans les analyses de données, l’interprétation et l’amélioration de la résolution spatiale ont augmenté le potentiel de l’EEG en tant que biomarqueur fiable et précis de la progression des maladies neurodégénératives. De nombreuses analyses observationnelles de l’EEGq au repos confirment sa valeur potentielle en tant que biomarqueur pour la détection des signatures neurales de la neurodégénérescence survenant dans la maladie d’Alzheimer (Babiloni et al, 2011 ; Moretti et al., 2011 ; Berka et al., 2014 ; Chen et al., 2015 ; Garn et al., 2015 ; Ruffini et al., 2016 ; Waninger et al., 2016), la maladie de Parkinson (Sarnthein et Jeanmonod, 2007 ; Babiloni et al., 2011 ; Soria-Frisch et al, 2014 ; Shani Waninger et al., 2015 ; Kroupi et al., 2017) et la démence frontotemporale (Pijnenburg et al., 2008 ; Nishida et al., 2011 ; Caso et al., 2012 ; Goossens et al., 2016).
Au fil des années, la technologie matérielle de l’EEG a également évolué et plusieurs systèmes multicanaux sans fil ont émergé, qui délivrent des signaux EEG et physiologiques de haute qualité dans un design plus simple, plus pratique et plus confortable que les systèmes traditionnels encombrants. Les systèmes EEG traditionnels nécessitent un assemblage et une application longs, impliquant généralement une abrasion du cuir chevelu du patient. Le temps d’application et l’inconfort rendent ces systèmes traditionnels difficiles à utiliser dans les populations touchées par la démence, où la coopération avec de longues procédures cliniques est souvent difficile. Cependant, plusieurs systèmes sans fil actuellement disponibles peuvent être appliqués en 20 minutes ou moins, sans gêne pendant l’application et avec un ajustement confortable pendant les acquisitions. Combinés aux progrès des techniques de détection des signaux et d’analyse quantitative, les systèmes sans fil sont des candidats idéaux pour une évaluation clinique relativement rapide et tolérable de populations de démence potentiellement difficiles, telles que la démence frontotemporale à variante comportementale, caractérisée par des changements proéminents de comportement et de personnalité.
Plus récemment, il y a également eu un marché croissant pour les technologies portables grand public conduisant à des systèmes à canal limité disponibles pour un usage personnel, comme la méditation et l’entraînement à la relaxation. Il est concevable que ces systèmes, malgré leur couverture limitée, puissent également être utilisés dans certaines études cliniques. L’application de ces systèmes grand public dans la recherche sur les essais cliniques n’a cependant pas été explorée en profondeur et la précision et la fiabilité de ces systèmes pour des mesures répétées n’ont pas été bien établies. En outre, il n’est pas certain que l’acquisition à canaux limités puisse fournir des données et une couverture anatomique suffisantes pour évaluer les signatures neurales chez les patients atteints de maladies neurodégénératives.
L’étude actuelle a été conçue pour fournir une première évaluation du potentiel des systèmes EEG grand public pour les essais cliniques, en comparant la facilité d’utilisation, la précision et la fiabilité de deux systèmes EEG sans fil multicanaux de qualité médicale, B-Alert X24, et Enobio 20, avec deux systèmes grand public à canaux limités, Muse et Mindwave.
Matériels et méthodes
Participants
La population étudiée comprenait cinq participants en bonne santé qui répondaient aux critères d’admissibilité de l’étude (tableau 1). Les sujets étaient exclus si, après examen de leurs antécédents médicaux, des médicaments concomitants et de leur mode de vie (consommation d’alcool et de caféine ainsi que statut tabagique), ils n’étaient pas considérés comme étant en bonne santé. Plus précisément, ils ont été exclus de l’étude s’ils avaient des antécédents d’épilepsie ou d’autres troubles du sommeil, neurologiques ou psychiatriques, ou s’ils prenaient des médicaments ou avaient un mode de vie connu pour affecter le signal EEG, comme le tabagisme et une consommation considérable d’alcool et de caféine.

Tableau 1. Démographie de la population de l’étude et caractéristiques de base.
Un consentement éclairé écrit a été obtenu de tous les participants à l’étude en suivant les directives pour l’investigation expérimentale avec des sujets humains requises par le Chesapeake Institutional Review Board.
Procédures de l’étude, acquisition des données EEG et analyse
Pour éviter la variabilité potentielle des signaux EEG associée à l’apport nutritionnel et aux variations circadiennes, toutes les visites ont eu lieu le matin après un petit-déjeuner standard pauvre en glucides et riche en protéines (pour minimiser la somnolence post-prandiale) sur le site d’étude des laboratoires de recherche Advanced Brain Monitoring (ABM). En outre, il a été demandé aux participants d’éviter les boissons alcoolisées la veille de la visite d’étude, ainsi que de rester à jeun et d’éviter la caféine le matin de la visite.
Les données EEG ont été acquises au cours de deux visites distinctes à ~1 semaine d’intervalle à partir de deux systèmes EEG médicaux multicanaux (20 canaux), B-Alert (Advanced Brain Monitoring, ABM) et Enobio (Neuroelectrics) (Figure 1, Tableau 2) et de deux systèmes grand public à canaux limités, Muse (Interaxon, 2 canaux) et Mindwave (Neurosky, un canal) (Figure 1, Tableau 2) dans l’ordre suivant : Muse, Mindwave, B-Alert, Enobio. Le système EEG B-Alert X24 et l’Enobio sont tous deux des systèmes sans fil à 20 canaux, certifiés médicalement CE, appliqués dans le montage international standard 10-20 et acquièrent le signal EEG à une fréquence d’échantillonnage de 256 Hz. En outre, B-Alert a été autorisé par la FDA pour une utilisation en tant que dispositif médical.
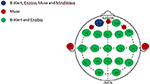
Figure 1. Distribution anatomique des canaux des systèmes EEG à canaux multiples et limités. Représentation des canaux partagés et uniques parmi les quatre systèmes EEG évalués. Le canal commun aux quatre systèmes EEG, Fp1 (bleu) ; canaux uniques au système Muse (rouge) ; canaux partagés entre les systèmes multicanaux, B-Alert et Enobio (vert).

Tableau 2. Comparaisons des systèmes EEG.
B-Alert utilise les mastoïdes comme canal de référence. Enobio peut être utilisé avec une référence mastoïde, un clip d’oreille ou en utilisant d’autres emplacements du cuir chevelu. Mindwave a également une référence sur le glissement d’oreille et Muse a trois canaux de référence sur le front. Tous les systèmes incluaient une vérification de la qualité du signal, cependant, contrairement aux systèmes EEG médicaux, les deux systèmes grand public ont des électrodes sèches et aucune vérification de l’impédance.
Ces technologies ont été sélectionnées en fonction de leur capacité à fournir aux utilisateurs finaux des sorties EEG brutes par le biais d’un accès pratique et non prohibitif.
Dix minutes d’EEG au repos ont été acquises pendant les yeux ouverts (EO) avec fixation visuelle sur un symbole de croix présenté sur un écran d’ordinateur (5 min) ainsi que pendant les yeux fermés (EC) pendant 5 min.
Puisque les quatre systèmes ne partagent que le canal FP1 (figure 1), les schémas EEG (bruts et décontaminés), les densités spectrales de puissance (DSP) et les comparaisons de fiabilité test/retest entre les quatre systèmes EEG évalués dans l’étude ont été réalisés en se concentrant sur l’électrode Fp1 dans les conditions EO et EC.
Les données EEG de chaque système ont été chargées dans MATLAB (Mathworks) à l’aide de fonctions personnalisées. Les données EEG enregistrées pendant les pauses et les instructions ont été écartées avant l’analyse. La densité spectrale de puissance de l’EEG pour chaque époque de 1 s a été calculée à l’aide de la méthode du périodogramme modifié de Welch avec une fenêtre de Hamming de 1 s de longueur. Les DSP ont été calculées sur l’EEG au repos pendant les périodes yeux ouverts et yeux fermés. Pour permettre des unités égales (μV), un facteur de correction de 1,25 (Muse), 0,25 (MindWave) ou 1 000 (Enobio 20) a été appliqué. Toutes les données PSD du canal Fp1 ont été moyennées pour les cinq sujets pour chaque visite. Le test-retest a été effectué en calculant et en traçant Vist1/Visit2.
Résultats
Participants
Les participants étaient tous des volontaires sains d’un âge moyen de 27 ans, ils étaient tous droitiers et non-fumeurs, et majoritairement des hommes (60%). Leurs données démographiques et leurs caractéristiques de base sont résumées dans le tableau 1.
L’EEG à l’état de repos
Les données EEG ont été recueillies avec succès à partir des quatre systèmes testés. Comme prévu, en raison des électrodes sèches et du nombre limité de canaux, le temps de configuration était considérablement plus court pour les systèmes EEG grand public. Cependant, aucune différence n’a été observée dans la tolérance et l’acceptation des sujets entre les quatre systèmes.
Des modèles de données EEG brutes dans les conditions EO (figure 2) et EC (figure 3) ont été collectés et évalués à partir de chaque système. Muse et Mindwave étaient plus sujets aux artefacts dus aux clignements d’yeux et aux mouvements musculaires dans la région frontale avec l’ouverture des yeux (figure 2).
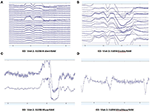
Figure 2. Extraits des données brutes d’OT de B-Alert (A) et Enobio (B) Muse (C) et MindWave (D) chez le même participant au cours de la même visite.
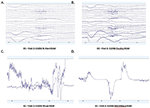
Figure 3. Extraits des données brutes EC de B-Alert (A) et Enobio (B) Muse (C) et MindWave (D) chez le même participant au cours de la même visite.
Comparaison des densités spectrales de puissance (DSP) du canal Fp1
Les DSP moyennes dans le canal Fp1 commun aux quatre systèmes EEG pour la visite 1 et la visite 2 ont été calculées et ont été tracées pour les conditions EO (figures 4A,B) et EC (figures 4C,D). Dans la condition EO, les spectres B-alert et Enobio étaient approximativement égaux, tandis que Mindwave était légèrement augmenté mais suivait une courbe similaire. Une augmentation à large bande de la puissance a été observée pour les DSP acquis avec le système Muse. De même, dans la condition EC (Figures 4C,D), les DSP de B-Alert, Enobio et Mindwave étaient similaires, mais une augmentation de la puissance à large bande a été observée pour les spectres Muse, qui semblaient également présenter une variation plus élevée que les autres systèmes. Des pics à 8-12 Hz (bande alpha) étaient visibles dans les spectres acquis avec les systèmes B-Alert, Enobio et Mindwave à chaque visite. Alors qu’il y avait un pic alpha clair pour les spectres de puissance de Muse à la visite 2, aucun pic n’a été observé dans les spectres de la visite 1.
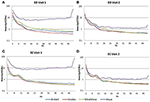
Figure 4. Densités spectrales de puissance (DSP) Fp1 des quatre systèmes EEG dans la condition EO à la visite 1 (A) et à la visite 2 (B) et dans la condition EC à la visite 1 (C) et à la visite 2 (D).
Canal Fp1 Comparaison test/retest EEG de repos
Dans la condition EC, le rapport spectral de puissance était compris entre 0,975 et 1,025 pour B-Alert, Enobio et Mindwave (figure 5A). Les rapports PSD du système Muse présentaient plus de variation que les trois autres systèmes, avec des rapports compris entre 1,125 et 1,225. Dans la condition EO, il semblait y avoir un peu plus de variation pour Enobio dans les ondes lentes Delta (1-3 Hz), Theta (3-7 Hz), et alpha lent (8-10) et pour B-Alert et Mindwave dans les ondes plus rapides Beta (13-30 Hz) et Gamma (25-40 Hz). Cependant, les ratios étaient toujours compris entre 0,975 et 1,05. De même que pour la condition EC, le test/retest pour Muse présentait une plus grande variation, avec des ratios allant jusqu’à 1,2 (figure 5B).
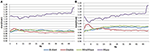
Figure 5. Rapports test-retest pour la condition EC (A) et EO (B).
Discussion
Cette étude a comparé le signal EEG quantitatif et la fiabilité test-retest des systèmes EEG médicaux et grand public afin d’évaluer leur application potentielle dans la recherche et les essais cliniques. Les systèmes EEG grand public récemment popularisés ont été évalués en raison de leur faible coût, de leur grande accessibilité et de leur potentiel pour les études à domicile dans des populations difficiles. Parmi les applications populaires des systèmes EEG grand public figurent l’entraînement à la méditation et à la relaxation ainsi que la gestion de l’anxiété ou de la douleur. Des recherches récentes ont exploré leur utilité au-delà du jeu : NeuroSky s’est révélé capable de détecter le début du stade 1 du sommeil (Van Hal et al., 2014) et l’évaluation de l’EEG grand public dans le cadre d’interfaces cerveau-ordinateur a également suscité un certain intérêt (Bialas et Milanowski, 2014 ; Kim et al., 2015 ; Taherian et al., 2017). L’application de systèmes EEG plus simples (6 canaux, par exemple) est également étudiée pour les situations d’urgence (Jakab et al., 2014). Une évaluation antérieure, bien qu’utilisant un casque plus complexe, a montré que les systèmes EEG grand public multi-canaux disponibles dans le commerce, tels que le capuchon à 16 électrodes Emotiv EPOC, peuvent également avoir une valeur pour évaluer les conditions cliniques (Schiff et al., 2016).
Cette étude a fourni des preuves que des données EEG d’assez bonne qualité peuvent être collectées avec succès à partir d’EEG grand public. Cependant, il y avait des distinctions dans l’augmentation de la puissance, le retest et la forme du pic alpha observé à 8-13 Hz. Mindwave a montré des spectres de puissance Fp1 globalement similaires à ceux des systèmes médicaux, avec une légère augmentation à large bande par rapport à B-Alert et Enobio. Muse a montré une augmentation à large bande dans les spectres de puissance, ce qui peut refléter un artefact dans les données acquises par une électrode sèche.
Les systèmes EEG grand public ont montré une installation nettement plus pratique et plus rapide,ce qui est optimal pour leur utilisation prévue dans les applications de divertissement et d’auto-assistance. Cependant, la qualité de leurs données a été globalement affectée négativement par la susceptibilité aux artefacts associée à l’électrode sèche. Comme on pouvait s’y attendre, la qualité des données était particulièrement réduite pendant l’OE. L’absence de capacité de test d’impédance et l’application à la région frontale, qui est particulièrement sujette aux clignements d’yeux et aux mouvements musculaires lors de l’ouverture des yeux, ont probablement contribué à cet artefact relatif. En outre, l’évaluation effectuée par les systèmes EEG grand public est, par nature, limitée et confinée à la seule région anatomique du cerveau couverte par les quelques canaux, ce qui exclut les évaluations multiréseaux.
Les électrodes sèches peuvent également être plus susceptibles d’entraîner une gêne au fil du temps et présentent un risque plus élevé de mauvais positionnement sur le front, ce qui entraîne une acquisition du signal et un test/retest inexacts. Par rapport aux équipements de qualité médicale, la fiabilité du test/retest était plus faible dans les systèmes EEG grand public. La fiabilité a été mesurée par une acquisition test-retest pour tous les systèmes (figure 5). Si B-Alert, Enobio et Mindwave ont obtenu des résultats raisonnables, Muse a présenté une fiabilité relativement faible. De plus, alors qu’un pic alpha clair a été démontré pour Muse lors de la visite 2 (figure 4), l’absence de pic alpha lors de la visite 1 suggère un manque de cohérence qui pourrait être dû à un artefact. Des mesures cohérentes et fiables de l’activité cérébrale sont cruciales dans les essais cliniques pour suivre l’évolution de la maladie et évaluer l’efficacité d’une thérapie expérimentale. Bien que les systèmes grand public puissent être utiles pour une évaluation rapide lorsque le temps est limité, ces limites de l’EEG grand public pourraient entraver leurs applications dans les contextes de recherche et d’essais cliniques et un système de qualité médicale avec une fiabilité test-retest élevée est recommandé pour une utilisation comme critère pharmacodynamique dans les évaluations cliniques.
En définitive, la comparaison des systèmes EEG médicaux et grand public dans des conditions expérimentales a mis en évidence une différenciation des performances et, en particulier, des limites d’utilisation spécifiques qui pourraient entraver les applications des systèmes grand public dans les contextes de recherche et d’essais cliniques. D’autre part, les systèmes médicaux multi-dérivations sont moins idéaux pour les loisirs qui nécessitent une installation rapide et un traitement des données à partir d’un nombre minimal d’électrodes. La principale limite de cette étude réside dans la petite taille de la population étudiée et l’absence de randomisation de l’ordre des systèmes utilisés pour l’acquisition. Les données ont été acquises dans le même ordre des systèmes afin d’éviter les effets du temps d’acquisition qui peuvent avoir un impact sur l’EEG en raison des rythmes circadiens. Cependant, la mesure de la puissance EEG s’est avérée très fiable et reproductible pour les individus lorsqu’on utilise des systèmes EEG standard. Pour cette raison, la taille de l’échantillon sélectionné a été considérée comme informative.
En conclusion, les données EEG peuvent être collectées avec succès à partir des quatre systèmes testés, y compris les systèmes EEG grand public, avec des limitations variables sur la facilité d’utilisation, la qualité des données et la fiabilité qui guident leurs applications optimales, y compris dans les contextes d’essais cliniques. La susceptibilité aux artefacts et la variabilité de la fiabilité test/retest associée aux systèmes EEG grand public actuels suggèrent l’utilisation d’un système EEG de qualité médicale pour des collectes de données EEG transversales et longitudinales cliniques robustes.
Contributions des auteurs
ER et AV : ont participé à la conception et au design du projet, à l’analyse et à l’interprétation des données et à la préparation du manuscrit. SW, CB et GR : ont participé à la conception et au design du projet, à son exécution, à l’analyse et à l’interprétation des données et à la préparation du manuscrit. Tous les auteurs ont participé à la rédaction, l’écriture et la révision du manuscrit et ils ont tous lu et approuvé la version finale du manuscrit.
Funding
Cette étude a été soutenue par Biogen.
Déclaration de conflit d’intérêts
ER et AV : employé de Biogen. SW et CB : employé de Advanced Brain Monitoring, Inc. GR : employé de Neuroelectrics.
Reconnaissance
Nous tenons à remercier les participants à l’étude pour leur temps et leurs contributions à cette étude. L’équipe Biogen a participé à la conception de l’étude, à l’analyse et à l’interprétation des données, à la rédaction du rapport et à la décision de soumettre l’article pour publication.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Sources corticales des rythmes électroencéphalographiques à l’état de repos dans la démence liée à la maladie de Parkinson et la maladie d’Alzheimer. Clin. Neurophysiol. 122, 2355-2364. doi : 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., et Johnson, R. (2014). « Développement de biomarqueurs EEG pour la maladie d’Alzheimer », dans GTC Biomarkers Summit (San Diego, CA).
Bialas, P., et Milanowski, P. (2014). Une interface cerveau-ordinateur basée sur le potentiel évoqué visuellement à l’état stable à haute fréquence utilisant un casque EEG de qualité grand public. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi : 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). EEG quantitatif et LORETA : des outils précieux pour discerner la DFT de la MA ? Neurobiol. Aging 33, 2343-2356. doi : 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., and ChiehLee, T. (2015). La puissance fréquentielle et la cohérence de l’électroencéphalographie sont corrélées à la sévérité de la maladie d’Alzheimer : une analyse multicentrique à Taïwan. J. Formos Med. Assoc. 114, 729-735. doi : 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Les marqueurs EEG quantitatifs sont liés à la gravité de la maladie d’Alzheimer dans le registre prospectif de la démence en Autriche (PRODEM). Clin. Neurophysiol. 126, 505-513. doi : 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). Le pic de fréquence dominant de l’EEG différencie la maladie d’Alzheimer et la dégénérescence lobaire fronto-temporale. J. Alzheimers Dis. 55, 53-58. doi : 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Nouveau système d’électroencéphalographie sans fil avec un temps de préparation minimal pour une utilisation dans les urgences et les soins préhospitaliers. Biomed. Eng. Online 13:60. doi : 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., et Jo, S. (2015). Évaluation quantitative d’une interface hybride non invasive à faible coût basée sur l’EEG et les mouvements oculaires. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi : 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). « Deep networks using auto-encoders for PD prodromal analysis », in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., et Loo, S. K. (2014). Utilisation de l’électroencéphalogramme pour diagnostiquer le TDAH. Curr. Psychiatry Rep. 16:498. doi : 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011). Le substrat anatomique et les marqueurs EEG du scalp sont corrélés chez les sujets atteints de troubles cognitifs et de la maladie d’Alzheimer. Front Psychiatry 1:152. doi : 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Differences in quantitative EEG between frontotemporal dementia and Alzheimer’s disease as revealed by LORET. Clin. Neurophysiol. A 122, 1718-1725. doi : 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Investigation of resting-state EEG functional connectivity in frontotemporal lobar degeneration. Clin. Neurophysiol. 119, 1732-1738. doi : 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., et Soria-Frisch, A. (2016). « EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients », dans Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhague).
Google Scholar
Sarnthein, J., et Jeanmonod, D. (2007). Haute cohérence thêta thalamocorticale chez les patients atteints de la maladie de Parkinson. J. Neurosci. 27, 124-131. doi : 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Un système d’enregistrement électroencéphalographique peu coûteux et convivial pour l’évaluation de l’encéphalopathie hépatique. Hepatology 63, 1651-1659. doi : 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., et Johnson, R. (2015). « Une nouvelle évaluation portable des biomarqueurs neurocognitifs pour la maladie de Parkinson », dans GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., et Stein, M. A. (2015). Intégration d’un biomarqueur EEG avec l’évaluation du TDAH par un clinicien. Brain Behav. 5:e00330. doi : 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). « Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG », in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., et Claire Davies, T. (2017). Are we there yet ? Évaluation de l’interface cerveau-ordinateur de qualité commerciale pour le contrôle des applications informatiques par les personnes atteintes de paralysie cérébrale. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi : 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., et Bossemeyer, R. (2014). Détection du sommeil basée sur l’EEG à faible coût. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi : 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., et Verma, A. (2016). » Identification de biomarqueurs neurophysiologiques de MCI à l’aide de l’état de repos, EEG « , dans Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar
.