Lorsque l’hydrogène est lié par covalence à un atome hautement électronégatif, comme le fluor, le chlore, l’oxygène ou l’azote, l’atome H a une charge positive partielle, écrite Hδ+.
Hδ+ est physiquement très petit, donc la densité de charge sur lui est exceptionnellement élevée.
Imaginez un autre atome négatif ou électronégatif, disons sur une molécule différente, s’approche du Hδ+;il y aura une attraction mutuelle, résultant en une attraction dipôle-dipôle particulièrement forte.Cette attraction est appelée une liaison hydrogène.
En général, les liaisons hydrogène sont plus faibles que les liaisons ioniques et covalentes, mais sont plus fortes que les forces de van der Waals.

La liaison hydrogène dans l’eau
L’exemple le plus connu de liaison hydrogène est l’eau :
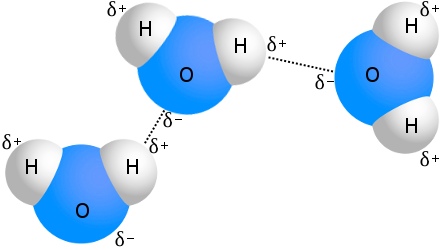
Chaque molécule d’eau peut être liée par une liaison hydrogène à pas moins de quatre autres molécules d’eau.Dans l’eau à température ambiante, le nombre moyen de liaisons hydrogène par molécule d’eau est de 3,6.
Le mouvement thermique aléatoire des molécules fait que la durée de vie de toute liaison hydrogène individuelle dans l’eau est courte, en moyenne seulement 10 picosecondes.Cependant, le temps de formation d’une nouvelle liaison est encore plus court.
Rompre de façon permanente une seule liaison hydrogène dans l’eau nécessite 21 kJ mol-1, un apport d’énergie important.Le résultat est que les points de fusion et d’ébullition de l’eau sont beaucoup plus élevés que ce à quoi on pourrait s’attendre pour une molécule de si faible poids moléculaire.
Considérez l’eau vs le méthane.Les molécules d’eau sont plutôt fortement attirées les unes vers les autres par la liaison hydrogène, alors que les forces de van der Waals prévalent dans le méthane.Ainsi, bien que leurs masses moléculaires soient similaires, à 18 pour l’eau et 16 pour le méthane, leurs propriétés physiques sont très différentes.Par exemple, l’eau fond à 0,00 °C et bout à 99,98 °C ; le méthane fond à -182,5 °C et bout à -161,5 °C.
La liaison hydrogène dans l’eau vs le sulfure d’hydrogène
Le soufre est dans le groupe 16 du tableau périodique, le même que l’oxygène. Le soufre est plus lourd que l’oxygène, doncH2S devrait avoir des points de fusion et d’ébullition plus élevés que H2O.Cependant, ce n’est pas le cas car le soufre est moins électronégatif que l’oxygène, et donc la liaison hydrogène dans H2S est faible.

Mol. Masse : 16
Pt. de fusion : 0,00 °C
Pt. d’ébullition : 99,98 °C
Electronégativité de O (Pauling) : 3,44
Ethalpie de liaison hydrogène : 21 kJ mol-1

Mol. Mass : 34
Pt. de fusion : -82 °C
Pt. d’ébullition : -60 °C
Electronégativité de S (Pauling) : 2.58
Ethalpie de liaison hydrogène : ≅ 3 kJ mol-1
La liaison hydrogène dans l’ammoniac et le fluorure d’hydrogène
Le fluor et l’azote sont les éléments les plus électronégatifs dans leurs groupes du tableau périodique, et la liaison hydrogène est observée dans le fluorure d’hydrogène et l’ammoniac.
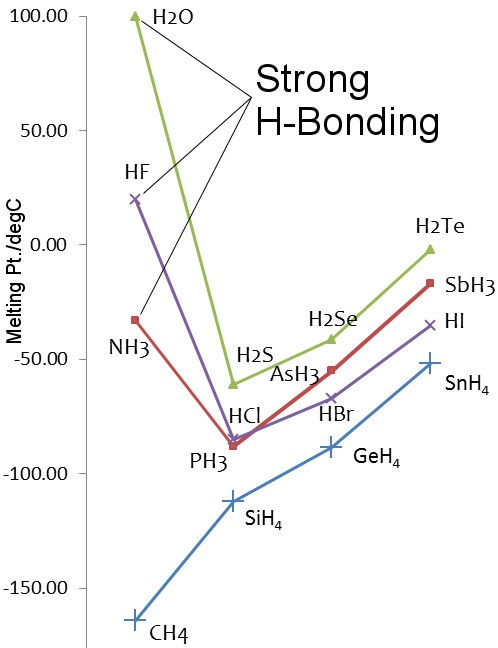
Comme pour l’eau, les points de fusion et d’ébullition du fluorure d’hydrogène et de l’ammoniac sont plus élevés que les hydrures des éléments plus lourds de leurs groupes.
Points de fusion des hydrures des éléments des groupes 14 à 17
La liaison hydrogène dans l’ADN
Les paires de bases de l’ADN relient ses deux chaînes d’hélices.Les paires de bases portent l’information génétique de l’ADN.
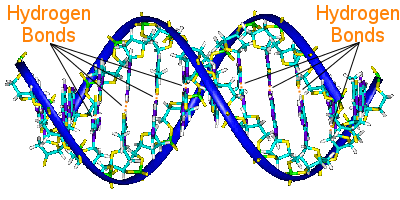
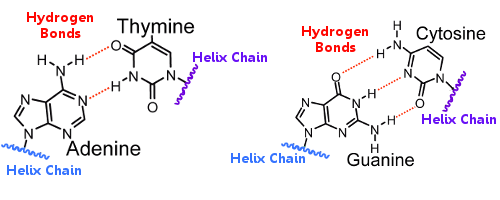
Les paires de bases d’une hélice sont liées aux paires de bases de l’autre hélice par des liaisons hydrogène.Ainsi, la liaison hydrogène maintient les hélices ensemble, créant la fameuse double hélice.
Lorsque l’ADN se réplique, les liaisons hydrogène se rompent, permettant aux deux hélices de se séparer.Ainsi, la liaison hydrogène joue un rôle essentiel dans le mécanisme de verrouillage des paires de bases lors de la réplication de l’ADN.
La liaison hydrogène dans la laine
Comme d’autres fibres protéiques, la laine présente des liaisons hydrogène.L’image ci-dessous montre comment les liaisons hydrogène (points orange) relient les spires de la chaîne d’hélices α de la laine (vert).
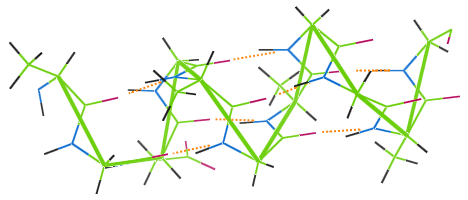
Si un vêtement en laine est lavé à haute température, les liaisons hydrogène sont détruites, les bobines perdent leur élasticité, et le vêtement devient mishapen.

.