Thomas A. Oetting, MS, MD
La conversion à l’extraction extra-capsulaire de la cataracte (ECCE) arrive souvent à un moment difficile. Le cristallin est sur le point de tomber au sud, le vitré s’est prolongé et le chirurgien est stressé. Il est essentiel de comprendre les étapes et le processus de conversion à l’ECCE. Une étude avant la crise permettra d’apaiser le stress lorsque ce processus inévitable se produira. Nous couvrirons plusieurs domaines : l’identification des patients à risque pour la nécessité d’une conversion à l’ECCE, les indications de conversion, la conversion de topique à sub-Tenon’s, la préparation de la plaie, l’expression du matériau de la lentille, la fermeture de la plaie, la mise en place de l’IOL, les questions post-opératoires, et une brève section sur la vitrectomie antérieure.
Patients à risque de conversion en ECCE : L’une des parties les plus importantes du processus préopératoire pour les patients atteints de cataracte est d’évaluer les facteurs augmentant la difficulté chirurgicale qui peuvent conduire à la conversion à l’ECCE ou compliquer autrement la procédure.Vous pouvez vouloir ajouter du temps opératoire à votre programme ou demander un équipement supplémentaire. Il est possible que vous souhaitiez passer à une plaie limbique supérieure, qui facilite la conversion en ECCE, plutôt qu’à une incision cornéenne claire temporale. Vous voudrez peut-être faire un bloc rétrobulbaire plutôt qu’une anesthésie topique, car le cas peut durer plus longtemps ou est plus susceptible de se compliquer. Dans certaines situations, les facteurs de risque préopératoires vous font envisager d’inviter quelqu’un de plus expérimenté à faire le cas.
Facteurs de difficulté (par ordre décroissant d’importance)1
- Laxité zonulaire (pseudoexfoliation-PXF, antécédents de traumatisme, syndrome de Marfan, etc.)
- Lentille dure (lentille rouge ou noire)
- Taille de la pupille (pourquoi est-elle petite ? PXF, diabète s/p laser, synechies centrales postérieures – CPS, flasque de la tamsulosine/Flomax)
- Ne peut pas rester à plat très longtemps (ex. maladie pulmonaire obstructive chronique – MPOC, claustrophobie, tremblements, obésité sévère)
- Gros front limitant l’accès supérieur
- Angle étroit limitant l’espace de la chambre antérieure (CA)
- Prédisposition à la décompensation cornéenne : (par ex. dystrophie de Fuch ou guttata cornéenne, PPMD, noyau dur)
- Prédisposition à la décompensation cornéenne : (ex : dystrophie de Fuch ou guttata cornéenne, PPMD, noyau dur)
- Prédisposition au réflexe rouge faible cataracte blanche/noire rendant difficile le capsulorhexis curviligne continu (CCC)
- Précédent de chirurgie tel que trab existant ou vitrectomie pars plana passée (PPVx)
- Prédisposition à l’exposition : ex : botox, traumatisme passé des paupières, diabète sucré (DM)
- Anticoagulants (ex.g., warfarin/Coumadin, asparine)
- Patient monoculaire
| Facteur | Temps | Équipement/Anesthésie |
|---|---|---|
| Laxité zonulaire | Double |
|
| Lentille dure comme le roc | Ajouter 50% |
|
| Petite pupille | Ajouter 50% |
|
| Flomax | Ajouter 50% |
|
| Pauvre réflexe rouge | Ajouter 50% |
|
| Gros sourcil | Ajouter 25% |
|
| Angle étroit | Ajouter 25% |
|
| Prédisposition à la décompensation cornéenne | 0% |
|
| Blé de trabeculectomie existant | 0% |
|
| Vitrectomie préalable (PPVx) | 0% |
|
| Incapable de s’allonger | 0% |
|
| Anticoagulant utiliser | 0% |
|
| Patient monoculaire | 0% |
|
| (modifié de Oetting, Cataract Surgery for Greenhorns, http://medrounds.org/cataract-surgery-greenhorns) | ||
Indications de la conversion : La conversion en ECCE est indiquée lorsque la phacoémulsification est en échec. Cela est parfois dû à une lentille très dure qui ne se soumet pas aux ultrasons ou à une lentille suffisamment dure pour que le chirurgien craigne que l’énergie ultrasonore requise n’endommage une cornée provisoire (par exemple, dystrophie endothéliale de Fuchs ou dystrophie polymorphe postérieure ). Il arrive que l’on se convertisse à l’ECCE lorsqu’un capsulorhexis errant devient radial, en particulier avec un cristallin dur, lorsque le chirurgien craint que le risque de faire tomber le cristallin soit trop grand en poursuivant la phacoémulsification. Un chirurgien peut choisir de convertir en ECCE lorsque la capsule antérieure est difficile à voir et que le capsulorhexis doit être réalisé avec la technique de l’ouvre-boîte (cependant, avec l’utilisation de la coloration au bleu Trypan, cela est moins souvent indiqué). La conversion est plus souvent indiquée lorsque le cristallin est détaché en raison de zonules faibles ou d’une déchirure de la capsule postérieure qui rendent la phacoémulsification moins sûre que l’extension de la plaie et l’élimination du matériau résiduel du cristallin. Les indications pour la conversion à l’ECCE comprennent :
- Lentille cristalline dure ou endothélium instable
- Déchirure radiale dans la capsule antérieure avec lentille dure
- Mauvaise visualisation malgré le colorant Trypan
- Déchirure capsulaire postérieure
- Dialyse zonulaire
Conversion à l’anesthésie sous-ténonienne. Nous convertissons souvent des cas de cornée claire topique en ECCE. Bien que l’ECCE puisse être réalisé sous topique, il est généralement plus confortable et plus sûr d’administrer une anesthésie supplémentaire qui est généralement une injection sous-ténonale de bupivicaïne et de lidocaïne. Cela permet d’obtenir une certaine akinésie et une anesthésie supplémentaire. Il y a généralement une hémorragie sous-conjonctivale et si l’injection est trop antérieure, elle peut provoquer une chimioïsation et un ballonnement de la conjonctive. Les étapes de l’injection sous-ténonienne sont décrites ci-dessous :1
- Préparer une seringue de 3cc avec des parties égales de lidocaïne à 2%/0.75% de bupivacaïne
- Placez la canule lacrymale (ou canule de Masket) avec une courbe douce pour se rapprocher de celle du globe
- Précisez un quadrant pour le bloc (il est préférable d’opter pour un quadrant latéral pour éviter les muscles obliques)
- Demandez au patient de détourner le regard du quadrant choisi pour augmenter l’exposition
- Utilisez une pince .12 forceps pour rétracter la conjonctiva
- Faire une petite incision jusqu’à la sclérotique avec les ciseaux de Wescott
- Rediriger les ciseaux de Wescott avec la courbe vers le bas et disséquer sans ménagement à travers le quadrant
- Disséquer au-delà de l’équateur (similaire à l’utilisation des ciseaux de ténotomie de Stevens en pédiatrie/rétine)
- Utiliser .12 Forceps pour la contre traction
- Placez la canule à travers l’incision et dirigez au-delà de l’équateur avant d’injecter
- L’anesthésique local devrait couler facilement et causer peu de chimios — Si non, redissection avec les ciseaux de Wescott pour obtenir plus postérieur
- Utiliser 2-3 cc du mélange local
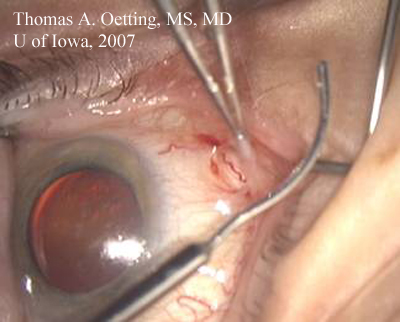
Forceps tenant ouvert le lambeau postérieur de dissection dans l’espace sous-ténonien. Canule lacrymale avec courbe douce se rapprochant de la courbe du globe, prête à insérer l’anesthésique local.
Conversion de la plaie : L’étape majeure vers la conversion à l’ECCE consiste soit à étendre la plaie existante, soit à la fermer et à en faire une autre. L’ECCE nécessitera une grande incision de 9-12 mm qui sera fermée par une suture. La décision d’étendre la plaie existante ou d’en faire une nouvelle dépend de plusieurs facteurs : l’emplacement de la plaie d’origine, la taille du front, les antécédents chirurgicaux et la nécessité éventuelle d’une intervention future.
| Plainte originelle | Avantages de la réalisation d’une nouvelle plaie pour l’ECCE | Avantages de l’extension de la plaie existante pour l’ECCE |
|---|---|---|
| Temporale |
|
|
| Supéro-temporal (oeil gauche) |
|
|
| Inférocetemporale (œil droit) |
|
|
| Supérieur |
|
. |
La réalisation d’une nouvelle incision pendant la conversion est identique à celle d’un ECCE planifié. L’incision d’origine est fermée avec une suture en nylon 10O. Le chirurgien et le microscope sont tournés, le chirurgien devant s’asseoir en position supérieure. Les étapes pour réaliser une nouvelle incision supérieure sont :
- Péritomie conjonctivale d’environ 170 degrés
- Utiliser une lame de 64 ou un croissant pour faire un sillon limbique avec une longueur de corde de 11mm
- Cautère bipolaire pour l’hémostase
- Utiliser le kératome pour réaliser l’incision initiale à partir du sillon dans l’AC
- Etendre l’incision initiale sur toute la longueur du sillon (avec des ciseaux ou un couteau)
- Les sutures de sécurité sont placées au préalable (généralement 7-0 Vicryl)
.
Extendre une incision existante peut être délicat et la technique est différente pour les tunnels scléraux par rapport aux incisions cornéennes claires. Cependant, dans les deux cas, l’extension originale est ramenée au limbe. Dans le cas d’une incision sclérale originale, l’incision est amenée en avant pour rejoindre le limbe à chaque extrémité avant de s’étendre le long du limbe sur une longueur de corde d’environ 11 mm. Dans le cas d’une incision cornéenne existante, l’incision cornéenne est amenée en arrière vers le limbe avant d’étendre la plaie le long du limbe sur une longueur de corde d’environ 11 mm. Lorsque des crochets d’iris sont utilisés dans une configuration en diamant, la plaie peut être étendue pour préserver le crochet sous-incisionnel et la grande pupille2.
- Péritomie conjonctivale d’environ 170 degrés
- Utiliser une lame de 64 ou un croissant de part et d’autre de la plaie existante pour réaliser un sillon limbique d’une longueur de corde de 11mm
- Cautérisation bipolaire pour l’hémostase
- Utiliser une lame en forme de croissant pour amener le sillon existant vers le haut. lame en croissant pour amener la plaie sclérale existante vers l’avant ou la plaie cornéenne existante vers l’arrière pour rejoindre le limbe
- Etendre l’incision initiale sur toute la longueur du sillon (avec des ciseaux ou un couteau)
- Des sutures de sécurité sont placées au préalable (généralement 7-0 Vicryl)
Enlever la lentille : Il faut être beaucoup plus prudent lors de l’enlèvement du noyau pendant la conversion typique en ECCE qui vient avec la perte de vitré. Tout d’abord, la capsule antérieure doit être suffisamment large pour permettre l’expression du nucléus, ce qui peut nécessiter des incisions de relaxation dans certains cas. Lorsque les zonules sont faibles ou que la capsule postérieure est déchirée, le cristallin ne peut pas être exprimé avec un fluide ou une pression externe, comme c’est souvent le cas lors d’un ECCE planifié avec une capsule/zonules intactes. Après avoir retiré le vitré (voir ci-dessous), le cristallin doit être soigneusement retiré de la chambre antérieure en exerçant une pression minimale sur le globe. Si la capsule postérieure et les zonlules sont intactes, alors la lentille peut être exprimée comme décrit avec un ECCE planifié.
Enlèvement de la lentille avec un complexe capsulaire intact :
- Mobiliser le cristallin (physiquement avec le cystotome ou avec l’hydrodissection–soyez prudent)
- Cristallin retiré avec une boucle de cristallin ou avec la technique de contre-.pression
- La plaie est fermée avec des sutures de sécurité et une suture centrale supplémentaire de Vicryl
- Le matériel cortical est retiré à l’aide d’un dispositif I/A (soit automatisé, soit manuel)
- Instiller un dispositif viscoélastique ophtalmique (OVD)
- Le cristallin est placé dans la chambre postérieure
- La plaie est fermée avec du nylon 10-O et les sutures de Vicryl sont retirées.
- L’OVD est retiré
Enlèvement de la lentille avec présence de vitré :
- Mobiliser la lentille avec le Viscoat canulla (incliner la lentille de façon à ce que le côté de la plaie soit antérieur)
- Glisser la boucle de la lentille sous la lentille, « lever le pied » de l’instrument, retirer la lentille
- La plaie est fermée avec des sutures de sécurité et une suture vicryl centrale supplémentaire
- Vitrectomie antérieure (voir ci-dessous)
- Le matériel cortical est retiré en utilisant une technique sèche ou un vitrecteur antérieur
- . technique sèche ou un vitrecteur antérieur
- Un dispositif viscoélastique ophtalmique (OVD)
- La lentille est placée dans le sulcus ou dans le chanfrein antérieur
- La plaie est fermée avec des sutures en nylon 10-O et les sutures Vicryl sont retirées
- L’OVD est retiré
Mise en place de la LIO : Le choix de l’IOL avec conversion ECCE dépend du complexe capsulaire résiduel.3,4 La clé du centrage de l’IOL est d’obtenir les deux haptiques au même endroit : soit les deux dans le sac, soit les deux dans le sulcus.
- Lorsque la capsule postérieure est intacte après une conversion à l’ECCE, l’ouverture capsulaire antérieure est généralement mal définie, ce qui peut rendre le placement du sac difficile. Si la capsule antérieure et donc le sac sont bien définis, alors placez une LIO acrylique d’une seule pièce sans la plier directement et doucement dans le sac en utilisant une pince Kelman.
- Lorsque la capsule postérieure est intacte et que la capsule antérieure est mal définie alors placez une LIO 3 pièces dans le sulcus comme une grande LIO en silicone ou l’acrylique MA50 en les plaçant directement et dépliées dans le sulcus avec une pince de Kelman. Assurez-vous que les deux haptiques sont dans le sulcus.
- Lorsque la capsule postérieure est endommagée, s’il reste suffisamment de capsule antérieure et de capsule postérieure pour supporter la LIO, définissez le sulcus avec du viscoat et placez la LIO directement dans le sulcus. Assurez-vous que les deux haptiques sont dans le sulcus. Si la LIO ne semble pas stable, placez alors des sutures McCannel pour fixer la LIO à l’iris ou retirez-la et remplacez-la par une LIO AC (n’oubliez pas de placer une iridectomie postérieure avec le vitréacteur).
- Lorsque la capsule est gravement endommagée et ne peut pas supporter une LIO alors placez la LIO dans la chambre antérieure. Utilisez la pince Kelman pour placer l’IOL, puis fixez la chambre, et utilisez un crochet Sinskey pour placer l’IOL AC dans sa position finale. (n’oubliez pas de placer une iridectomie périphérique avec le vitréomètre).
Problèmes postopératoires : Les soins postopératoires pour les patients après la conversion de la phaco à l’ECCE sont un peu plus compliqués et se concentrent sur la prévention de l’œdème maculaire cystoïde (OMC) et la limitation de l’astigmatisme induit. Souvent, les soins sont très similaires à ceux d’un ECCE planifié, avec environ 3 visites postopératoires (une le jour même ou le lendemain, une semaine plus tard et une 5-6 semaines plus tard). Selon l’importance de l’astigmatisme, le patient peut avoir besoin de plusieurs visites pour retirer séquentiellement les sutures tout en éliminant l’astigmatisme induit.
Première visite postopératoire : Cette visite a souvent lieu l’après-midi même (4 à 6 heures après la chirurgie) ou le lendemain matin, avec pour objectif principal de vérifier la PIO, de rechercher les fuites de la plaie et de rechercher du matériel résiduel de lentille ou du vitré dans la chambre antérieure. Il est certain que la plupart des fuites de la plaie doivent être suturées, mais si le CA n’est pas formé, il est obligatoire de les fermer. Le matériel nucléaire résiduel doit être retiré dans les jours suivants s’il est présent, mais le matériel cortical résiduel se dissout souvent avec peu d’inflammation. On peut s’attendre à une vision médiocre de l’ordre de 20/200 en raison de l’astigmatisme et de l’œdème. La chambre antérieure devrait être formée et présente généralement une cellule modérée (10-20 cellules/hpf avec un faisceau de 0,2 mm). Si la PIO est inférieure à 10 mmHg, il faut rechercher une fuite avec un indice de suspicion élevé en utilisant le test de Seidel. Si la PIO est comprise entre 10 et 29, tout va probablement bien, sauf si le patient est un vasculopathe, auquel cas votre limite supérieure de tolérance de la PIO doit être abaissée. Si la PIO est comprise entre 30 et 39, envisagez une suppression aqueuse. Si la PIO est >40, il faut envisager une suppression aqueuse et un « rot » ou une « purge » de la PIO par la paracentèse ou une ponction dans la chambre antérieure. La PIO doit être vérifiée de nouveau 60 à 90 minutes plus tard pour s’assurer du succès du traitement. Examinez le fond d’œil pour écarter la possibilité d’un décollement de la rétine (RD) et d’un épanchement ou d’une hémorragie choroïdienne. Généralement, les patients sont placés sous acétate de prednisolone 1% 1 goutte 4 fois par jour (QID), cyclogyl 1% 1 goutte 2 fois par jour (BID), et un antibiotique 1 goutte QID pour la semaine suivante.
Visite postopératoire de la semaine 1 : La vision et la pression devraient s’améliorer considérablement chez les patients au cours de la semaine suivante après un cas qui a été converti en ECCE. La vision devrait être de l’ordre de 20/100 avec une amélioration du sténopé à environ 20/50. La vision est généralement limitée par l’œdème résiduel et l’astigmatisme. Dans une étude de nos cas ECCE, nous avons trouvé environ 7,0 dioptries de cylindre à la visite d’une semaine. Vous devez vous attendre à une très faible inflammation et documenter l’absence de RD. Recherchez du matériel résiduel de lentille dans le segment antérieur et le pôle postérieur. Vous pouvez arrêter le cyclogyl et l’antibiotique. Réduisez lentement l’acétate de prednisolone (par exemple, 1 gtt QID pendant 7 jours supplémentaires, puis 1 gtt trois fois par jour pendant 7 jours, puis 1 gtt BID pendant 7 jours, puis 1 gtt QD pendant 7 jours), puis arrêtez. Si le patient présente un risque d’œdème maculaire cystoïde (OMC), comme cela est possible avec la perte de vitré, alors vous devez continuer la prednisolone à la fréquence la plus élevée (par exemple, QID) et commencer un non stéroïdien (comme le kétorolac topique ou équivalent 1 gtt QID) jusqu’à la prochaine visite 4 -6 semaines plus tard.
Visite postopératoire de la cinquième semaine : La vision devrait continuer à s’améliorer à mesure que l’astigmatisme s’installe et que la cornée se dégage davantage. L’oeil devrait être confortable. La vision devrait être de l’ordre de 20/80, s’améliorant à 20/40 avec le sténopé. Dans notre étude, l’astigmatisme induit par les sutures ECCE était d’environ 5,0 dioptries à l’incision. Le segment antérieur doit être calme et la PIO normale (sauf si le patient est un « répondeur aux stéroïdes »). Considérez l’EMC comme une possibilité chez les patients où une conversion a été nécessaire car ces cas sont souvent longs et peuvent impliquer une perte de vitré. Évaluer comme cliniquement indiqué par l’examen ou l’histoire avec la tomographie par cohérence optique (OCT) ou l’angiographie à la flourescéine (FFA).
À ce stade de la récupération, le principal problème est le contrôle astigmatique avec le retrait des sutures. Utilisez la kératométrie, la réfraction, la rétinoscopie en bandes ou la topographie pour guider votre retrait de suture. Si la kératométrie est de 45,00 à 90 degrés et de 40,00 à 180 degrés, recherchez les sutures serrées à environ 90 degrés (12 heures) qui causent un cylindre de 5 dioptries. Vous pouvez enlever une seule suture à 5 semaines, mais à l’évaluation de 8 semaines, vous pourriez envisager d’enlever 2 sutures à la fois. Le plan consiste à retirer une suture et à voir comment la cornée s’installe. Lorsque l’astigmatisme est inférieur à environ 1,0 à 1,5 dioptrie, vous devez arrêter de retirer les sutures et corriger tout astigmatisme résiduel par réfraction. Utilisez des gouttes antibiotiques à titre prophylactique pendant quelques jours après chaque retrait de suture. Après cette visite, vous devriez envisager les choix suivants à chaque visite (ne perdez pas trop de temps à penser à d’autres possibilités et rappelez-vous que tout le monde n’aura pas 20/20):
- tirer un point de suture (c’est-à-dire. le cylindre à l’axe du point est supérieur à 1,0 à 1,5 dioptrie sur la réfraction manifeste )
- donner des lunettes (c’est-à-dire qu’il n’y a pas de point à tirer ou que le cylindre est inférieur à 1 sur la RM)
- obtenir un FFA ou un OCT parce que vous soupçonnez un EMC
Vitrectomie antérieure. La conversion en ECCE s’accompagne presque toujours d’un vitré. Parfois, la conversion survient lorsque la lentille est trop dure et que la capsule est intacte, mais le plus souvent, il semble que la conversion survienne lorsque les zonules ou la capsule libèrent le vitré dans les mains réticentes du chirurgien du segment antérieur. Nous aborderons les causes et les signes du prolapsus du vitré et les principes de la vitrectomie antérieure dans diverses situations.
Causes du prolapsus du vitré. Le vitré vient soit autour des zonules, soit par une déchirure de la capsule postérieure. Les déchirures capsulaires postérieures sont généralement causées par 1) une déchirure antérieure s’étendant vers l’arrière – la plus fréquente, 2) une déchirure postérieure – secondaire à une aiguille phaco ou à un chopper trop profond, 3) pendant la manipulation avec l’instrument I/A, ou 4) une blessure préexistante (par exemple, une cataracte polaire postérieure, iatrogène de PPVx, ou d’un traumatisme pénétrant du cristallin). Les problèmes zonulaires sont souvent préexistants (par exemple, à la suite d’un traumatisme, d’une PXF ou d’un syndrome de Marfan), mais ils peuvent également être iatrogènes en raison d’une rotation forcée du cristallin ou d’une traction sur la capsule pendant l’I/A.
Signes de prolapsus vitreux. Le premier signe de prolapsus vitréen est le déni. Quelque chose ne va pas, mais vous n’arrivez pas à identifier le problème. Au début, vous niez l’existence d’un problème, mais il devient vite évident. Les autres signes révélateurs d’un prolapsus du vitré sont 1) l’approfondissement de la chambre, 2) l’élargissement de la pupille, 3) le matériau de la lentille n’est plus centré, 4) les particules de la lentille ne viennent plus à la phaco ou à l’I/A, et 5) la lentille ne tourne plus librement. Lorsque vous suspectez un prolapsus du vitré, vous devez placer un OVD dispersif dans l’œil avant de retirer l’aiguille de phaco ou l’I/A et vous pouvez vérifier la plaie avec un Weck-Cel (ou une éponge flèche similaire) pour le vitré.
Principes de base de la vitrectomie antérieure. La clé d’une vitrectomie antérieure réussie est de contrôler la fluidique de l’œil. La première étape consiste à fermer la chambre. C’est souvent difficile lorsque l’on s’est converti à un ECCE car la plaie est grande. Cependant, vous devez fermer la plaie de sorte que le seul point de sortie du fluide soit le dispositif d’aspiration/de coupe. Séparez le dispositif d’irrigation du dispositif d’aspiration/de coupe afin de créer une différence de pression telle que le vitré soit encouragé à aller vers le dispositif d’aspiration/de coupe. Le dernier point important est de couper bas et d’irriguer haut. Si vous pouvez placer le dispositif d’irrigation dans la chambre antérieure au-dessus du dispositif d’aspiration/coupe vers le bas près du plan de la capsule postérieure, alors le vitré quittera la chambre antérieure.
|
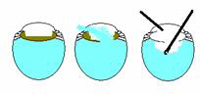 |
En général, la hauteur de la bouteille doit être basse – juste assez haute pour garder l’AC formé et pas trop haute pour pousser le fluide et éventuellement le vitré hors de l’œil. Le taux de coupe doit être aussi élevé que possible lors de la coupe du vitré et faible lors de la coupe du matériau de la lentille corticale. Nous aborderons séparément la perte de vitré au début, au milieu et à la fin du cas ci-dessous.
Vitré Présent au début du cas -alors que la plus grande partie du cristallin est dans l’œil : C’est le pire moment pour le prolapsus du vitré et il faut fortement envisager de se convertir à l’ECCE. Les étapes à considérer sont décrites ci-dessous :1
- Si topique, faire une injection sous-ténonienne (comme décrit ci-dessus)
- Envisager de fermer l’incision temporale avec 10-0 et faire une incision séparée avec péritomie supérieure surtout (comme discuté ci-dessus)
- Utiliser du viscoélastique dispersif pour soulever le cristallin près de la plaie et déplacer le vitré plus postérieurement.
- Peut nécessiter une vitrectomie de Weck-Cel pour nettoyer si le vitré est très prolabé
- Utiliser une boucle de lentille pour retirer la lentille (comme décrit ci-dessus)
- Avoir des ciseaux de Wescott à portée de main lors du retrait de la lentille en boucle pour couper le vitré
- Fixer avec 3 sutures de sécurité Vicryl 7-0 chacune (une au centre et une de chaque côté à 3 mm de distance, (une au centre et une de chaque côté à 3 mm de distance, permettant le retrait de la suture centrale pour placer une LIO de 6 mm)
- Peut avoir besoin d’ajouter un peu de nylon 10-0 sur les bords de la plaie pour s’assurer qu’elle est étanche
- Vitrectomie antérieure (comme discuté ci-dessus, séparer l’asp/cutter de l’irrigateur)
- Enlèvement à sec de la matière corticale résiduelle avec une seringue sur une canule de calibre 27
- Utiliser une canule J-ou une paracentèse si nécessaire pour le matériel sous-incisionnel
- Envisager une coloration avec du Kenalog (voir ci-dessous)
- Placer la LIO si possible dans le sulcus (ajuster la puissance) ou utiliser une LIO AC (ne pas oublier l’iridotomie périphérique)
- Miochol pour abaisser la pupille – asseoir la LIO dans le sulcus, La pupille inclinée aide à détecter le vitré
Vitré Présent au milieu du cas – pendant l’enlèvement du matériel cortical : Cela semble être le moment le plus fréquent pour la perte de vitré. Souvent, on obtiendra la capsule postérieure juste au moment où le dernier fragment nucléaire est prélevé. Bien sûr, il n’y a aucune raison de passer à l’ECCE dans ce cas. Les étapes suivantes sont utiles:1
- Placer le viscoat dans la zone de déchirure ou de dialyse avant de retirer les instruments
- Faire une incision séparée de 1 ou 1.5 mm pour la vitrectomie antérieure
- Séparer l’irrigation (par paracentèse) et l’asp/cutter (par une paracentèse plus large)
- Peut nécessiter de suturer la plaie d’origine pour maintenir la chambre formée
- Irriguer haut et couper/aspirer bas – crée un gradient de pression pour repousser le vitré
- Réglages faible vide 100 gamme, faible hauteur de bouteille 50 gamme, taux de coupe maximum
- Essayer d’obtenir une partie du matériel cortical résiduel
- Enlèvement à sec du matériel cortical résiduel avec une seringue sur une canule de calibre 27
- Utiliser une canule J-ou une paracentèse si nécessaire pour le matériel sous-incisionnel
- Envisager une coloration avec du kenalog (voir ci-dessous)
- Poser la LIO si possible dans le sulcus ou l’AC (si AC n’oubliez pas l’iridotomie périphérique)
- Miochol pour faire baisser la pupille
Comment traiter le vitré se présentant tardivement dans le cas – pendant le placement de la LIO : C’est le moment le moins problématique et le moins fréquent pour perdre du vitré. La question principale est de s’assurer que la LIO est stable tout en s’occupant du vitré et ensuite de fixer une LIO appropriée soit dans le CA, le sulcus ou le sac :1
- Placer un viscoat dans la zone de déchirure ou de dialyse avant de retirer les instruments
- Faire une incision séparée de 1 ou 1.5 mm pour la vitrectomie antérieure
- Irrigation séparée (par paracentèse) et asp/cutter (par une paracentèse plus large)
- Peut nécessiter la suture de la plaie d’origine pour maintenir la chambre formée
- Irrigation haute et cut/suck basse – crée un gradient de pression pour repousser le V
- Réglages vide bas 100 range, faible hauteur de bouteille 50 gamme, taux de coupe max
- Si le sulcus peut supporter une LIO, alors
- Déplacer une LIO 3 pièces existante dans le sulcus
- Remplacer une LIO monopièce existante avec-3 pièces dans le sulcus
- Envisager la capture de la capsule antérieure de l’optique si la CCC est ronde et centrée
- Si la déchirure dans la capsule postérieure est ronde et sécurisée
- Placer le viscoat dans le trou
- Poser délicatement la LIO en une seule pièce dans le sac (faire très attention avec la lentille en 3 pièces dans le sac)
- .pièce dans le sac)
- Miochol pour faire descendre la pupille
Coloration du vitré avec le Kenalog : Scott Burk, de Cincinatti Eye, a décrit l’utilisation de Kenalog en dehors des indications pour colorer le vitré qui avait prolongé dans la chambre antérieure5 (suivre le lien vers la vidéo Facebook). Comme le Kenalog n’est pas approuvé par la FDA pour cette indication et que certains chirurgiens rétiniens ont eu des endophtalmies stériles (et même infectieuses) après avoir utilisé le Kenalog, son utilisation est controversée. Cependant, il s’agit d’un adjuvant très utile à la vitrectomie antérieure. La méthode de mélange de la triamcinolone (Kenalog) à diluer 10:1 et de lavage du conservateur suit :
- Seringue TB pour retirer 0.2 ml de triamcinolone bien agité (40mg/ml)
- Retirer l’aiguille et la remplacer par un filtre à seringue de 5 (ou 22) microns (Sherwood Medical)
- Forcer la suspension à travers le filtre et jeter le véhicule rempli de conservateur
- Le Kenalog sera piégé sur le côté seringue du filtre
- Transférer le filtre dans une seringue de 5 ml remplie de. solution saline équilibrée (BSS)
- Frappez doucement la BSS à travers le filtre pour rincer davantage le conservateur
- Répétez le rinçage plusieurs fois
- Placez une aiguille de calibre 22 sur l’extrémité distale du filtre
- Aspirez 2 ml de BSS dans la seringue à travers le filtre pour remettre en suspension le Kenalog
- Le Kenalog (maintenant sans conservateur et dilué à 10 :1) va colorer en blanc les cordons vitréens
- Oetting, TA, Cataract Surgery for Greenhorns, disponible chez http://medrounds.org/cataract-surgery-greenhorns. consulté le 9 septembre 2007
- Dupps WJ Oetting TA, Configuration de l’écarteur d’iris en diamant pour la chirurgie de la cataracte extracapsulaire ou intracapsulaire à petite pupille. J Cataract Refract Surg Vol 30(12):2473-2475.
- Chang DF, Oetting TA, Kim T, Curbside Consultations in Anterior Segment Surgery, Slack Inc, Thorofare NJ, 2007.
- Henderson BA, Essentials of Cataract Surgery, Slack Inc, Thorofare NJ, 2007.
- Burk SE, Da Mata AP, Snyder ME, Schneider S, Osher RH, Cionni RJ. Visualisation du vitré à l’aide de la suspension Kenalog J Cataract Refract Surg. 2003 Apr;29(4):645-51.