Chimie de l’eau 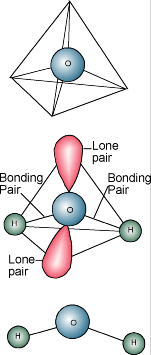 Vous savez probablement que la description chimique de l’eau est H2O. Une molécule d’eau est constituée d’un atome d’oxygène lié à deux atomes d’hydrogène. Les atomes d’hydrogène sont « attachés » à un côté de l’atome d’oxygène, ce qui fait que la molécule d’eau a une charge positive du côté où se trouvent les atomes d’hydrogène et une charge négative de l’autre côté, où se trouve l’atome d’oxygène. Comme les charges électriques opposées s’attirent, les molécules d’eau ont tendance à s’attirer les unes les autres, ce qui rend l’eau en quelque sorte « collante ». Le côté avec les atomes d’hydrogène (charge positive) attire le côté oxygène (charge négative) d’une autre molécule d’eau.
Vous savez probablement que la description chimique de l’eau est H2O. Une molécule d’eau est constituée d’un atome d’oxygène lié à deux atomes d’hydrogène. Les atomes d’hydrogène sont « attachés » à un côté de l’atome d’oxygène, ce qui fait que la molécule d’eau a une charge positive du côté où se trouvent les atomes d’hydrogène et une charge négative de l’autre côté, où se trouve l’atome d’oxygène. Comme les charges électriques opposées s’attirent, les molécules d’eau ont tendance à s’attirer les unes les autres, ce qui rend l’eau en quelque sorte « collante ». Le côté avec les atomes d’hydrogène (charge positive) attire le côté oxygène (charge négative) d’une autre molécule d’eau.
Toutes ces molécules d’eau s’attirant les unes les autres, elles ont tendance à s’agglutiner. C’est pourquoi les gouttes d’eau sont, en fait, des gouttes ! S’il n’y avait pas certaines forces terrestres, comme la gravité, une goutte d’eau aurait la forme d’une boule – une sphère parfaite. Même si elle ne forme pas une sphère parfaite sur Terre, nous devrions être heureux que l’eau soit collante.
L’eau est appelée le « solvant universel » car elle dissout plus de substances que tout autre liquide. Cela signifie que partout où l’eau va, que ce soit dans le sol ou dans notre corps, elle emporte des produits chimiques, des minéraux et des nutriments précieux.
L’eau pure a un pH neutre. L’eau pure a un pH, d’environ 7, qui n’est ni acide ni basique.
Les propriétés physiques de l’eau :
L’eau est unique en ce qu’elle est la seule substance naturelle que l’on trouve dans les trois états — liquide, solide (glace) et gazeux (vapeur) — aux températures que l’on trouve normalement sur Terre. L’eau de la Terre est constamment en interaction, en changement et en mouvement.
 L’eau gèle à 32° Fahrenheit (F) et bout à 212° F. En fait, les points de congélation et d’ébullition de l’eau sont la base avec laquelle la température est mesurée : 0° sur l’échelle Celsius est le point de congélation de l’eau, et 100° est le point d’ébullition de l’eau. L’eau est inhabituelle car sa forme solide, la glace, est moins dense que sa forme liquide, ce qui explique pourquoi la glace flotte.
L’eau gèle à 32° Fahrenheit (F) et bout à 212° F. En fait, les points de congélation et d’ébullition de l’eau sont la base avec laquelle la température est mesurée : 0° sur l’échelle Celsius est le point de congélation de l’eau, et 100° est le point d’ébullition de l’eau. L’eau est inhabituelle car sa forme solide, la glace, est moins dense que sa forme liquide, ce qui explique pourquoi la glace flotte.
L’eau a un indice de chaleur spécifique élevé. Cela signifie que l’eau peut absorber beaucoup de chaleur avant de commencer à devenir chaude. C’est pourquoi l’eau est précieuse pour les industries et dans le radiateur de votre voiture comme liquide de refroidissement. L’indice de chaleur spécifique élevé de l’eau aide également à réguler la vitesse à laquelle l’air change de température, ce qui explique pourquoi le changement de température entre les saisons est graduel plutôt que soudain, en particulier près des océans.
L’eau a une tension de surface très élevée. En d’autres termes, l’eau est collante et élastique, et a tendance à s’agglutiner en gouttes plutôt que de s’étaler en un film mince. La tension superficielle est responsable de l’action capillaire, qui permet à l’eau (et à ses substances dissoutes) de se déplacer dans les racines des plantes et dans les minuscules vaisseaux sanguins de notre corps.
Température de l’eau:
La température de l’eau n’est pas seulement importante pour les nageurs et les pêcheurs, mais aussi pour les industries et même les poissons et les algues. Une grande quantité d’eau est utilisée à des fins de refroidissement dans les centrales électriques qui produisent de l’électricité. Elles ont besoin d’une eau fraîche pour commencer, et elles rejettent généralement de l’eau plus chaude dans l’environnement. La température de l’eau rejetée peut affecter les habitats en aval. La température peut également affecter la capacité de l’eau à retenir l’oxygène ainsi que la capacité des organismes à résister à certains polluants.
pH:
Le pH est une mesure de l’acidité/base de l’eau. La fourchette va de 0 à 14, 7 étant neutre. Un pH inférieur à 7 indique une acidité, tandis qu’un pH supérieur à 7 indique une base. Le pH est en fait une mesure de la quantité relative d’ions hydrogène libre et hydroxyle dans l’eau. Une eau qui contient plus d’ions hydrogène libres est acide, tandis qu’une eau qui contient plus d’ions hydroxyle libres est basique. Comme le pH peut être affecté par les produits chimiques présents dans l’eau, il est un indicateur important de l’évolution chimique de l’eau. Le pH est exprimé en « unités logarithmiques », comme l’échelle de Richter, qui mesure les tremblements de terre. Chaque chiffre représente une variation de 10 fois de l’acidité/de la basicité de l’eau. Une eau dont le pH est de 5 est dix fois plus acide qu’une eau dont le pH est de 6.
La pollution peut modifier le pH d’une eau, ce qui peut nuire aux animaux et aux plantes qui vivent dans l’eau. Par exemple, l’eau qui sort d’une mine de charbon abandonnée peut avoir un pH de 2, ce qui est très acide et affecterait certainement tout poisson assez fou pour essayer d’y vivre ! En utilisant l’échelle logarithmique, cette eau de drainage des mines serait 100 000 fois plus acide que l’eau neutre — alors restez loin des mines abandonnées.
Conductance spécifique:
La conductance spécifique est une mesure de la capacité de l’eau à conduire un courant électrique. Elle dépend fortement de la quantité de solides dissous (comme le sel) dans l’eau. L’eau pure, comme l’eau distillée, aura une conductance spécifique très faible, tandis que l’eau de mer aura une conductance spécifique élevée. L’eau de pluie dissout souvent les gaz et les poussières en suspension dans l’air lorsqu’elle est dans l’air, et a donc souvent une conductance spécifique plus élevée que l’eau distillée. La conductance spécifique est une mesure importante de la qualité de l’eau car elle donne une bonne idée de la quantité de matière dissoute dans l’eau.
Probablement à l’école, vous avez fait l’expérience où vous branchez une batterie à une ampoule et passez deux fils de la batterie dans un bécher d’eau. Lorsque les fils sont mis dans un bécher d’eau distillée, la lumière ne s’allume pas. En revanche, l’ampoule s’allume lorsque le bécher contient de l’eau salée (saline). Dans l’eau salée, le sel s’est dissous, libérant des électrons libres, et l’eau conduira un courant électrique.
Turbidité:
La turbidité est une mesure du caractère trouble de l’eau. Elle est mesurée en faisant passer un faisceau de lumière à travers l’eau et en voyant quelle quantité est réfléchie par les particules dans l’eau. La turbidité de l’eau est causée par des matières, telles que la saleté et les résidus de feuilles, qui sont en suspension (flottant) dans l’eau. Une eau limpide, comme celle du lac Tahoe (où l’on travaille dur pour empêcher les sédiments de se déverser dans le lac), a une très faible turbidité. Mais regardez une rivière après un orage – elle est probablement brune. Vous voyez tous les sols en suspension dans l’eau. Heureusement pour nous, les matières qui causent la turbidité de notre eau potable se déposent ou sont filtrées avant que l’eau n’arrive dans notre verre à la maison. La turbidité se mesure en unités de turbidité néphélométrique (UTN).
Oxygène dissous :
Bien que les molécules d’eau contiennent un atome d’oxygène, cet oxygène n’est pas ce dont ont besoin les organismes aquatiques vivant dans nos eaux naturelles. Une petite quantité d’oxygène, jusqu’à environ dix molécules d’oxygène par million d’eau, est en fait dissoute dans l’eau. Cet oxygène dissous est respiré par les poissons et le zooplancton et leur est nécessaire pour survivre.
L’eau qui se déplace rapidement, comme dans un ruisseau de montagne ou une grande rivière, a tendance à contenir beaucoup d’oxygène dissous, tandis que l’eau stagnante en contient peu. Le processus par lequel les bactéries présentes dans l’eau aident les matières organiques, comme celles qui proviennent d’une usine de traitement des eaux usées, à se décomposer consomme de l’oxygène. Ainsi, un excès de matières organiques dans nos lacs et rivières peut provoquer une situation de carence en oxygène. La vie aquatique peut avoir du mal dans les eaux stagnantes qui contiennent beaucoup de matières organiques en décomposition, surtout en été, lorsque les niveaux d’oxygène dissous sont à un niveau saisonnier bas.
Dureté:
La quantité de calcium et de magnésium dissous dans l’eau détermine sa « dureté ». La dureté de l’eau varie à travers les États-Unis. Si vous vivez dans une région où l’eau est « douce », alors vous n’avez peut-être même jamais entendu parler de la dureté de l’eau. Mais si vous vivez en Floride, au Nouveau-Mexique, en Arizona, en Utah, au Wyoming, au Nebraska, au Dakota du Sud, en Iowa, au Wisconsin ou en Indiana, où l’eau est relativement dure, vous remarquerez peut-être qu’il est difficile de faire mousser l’eau lorsque vous vous lavez les mains ou les vêtements. De plus, les industries de votre région devront peut-être dépenser de l’argent pour adoucir leur eau, car l’eau dure peut endommager les équipements. L’eau dure peut même réduire la durée de vie des tissus et des vêtements ! Cela signifie-t-il que les étudiants qui vivent dans des régions où l’eau est dure ne suivent pas la dernière mode puisque leurs vêtements s’usent plus vite ?
Sédiments en suspension :
Les sédiments en suspension sont la quantité de terre qui se déplace dans un cours d’eau. Elle dépend fortement de la vitesse d’écoulement de l’eau, car une eau rapide peut ramasser et mettre en suspension plus de sol qu’une eau calme. Pendant les tempêtes, la terre est emportée des berges vers le cours d’eau. La quantité qui est emportée dans un cours d’eau dépend du type de terre dans le bassin de drainage de la rivière et de la végétation qui entoure la rivière.
Si la terre est perturbée le long d’un cours d’eau et que des mesures de protection ne sont pas prises, alors l’excès de sédiments peut nuire à la qualité de l’eau d’un cours d’eau. Vous avez probablement vu ces courtes clôtures en plastique que les constructeurs installent sur les bords de la propriété qu’ils développent. Ces clôtures à limon sont censées piéger les sédiments pendant une tempête de pluie et les empêcher de s’écouler dans un cours d’eau, car l’excès de sédiments peut nuire aux ruisseaux, aux rivières, aux lacs et aux réservoirs.
Les sédiments qui entrent dans un réservoir sont toujours une source de préoccupation ; une fois qu’ils y sont entrés, ils ne peuvent pas en sortir – la plupart d’entre eux se déposeront au fond. Les réservoirs peuvent « s’envaser » si trop de sédiments y pénètrent. Le volume du réservoir est réduit, ce qui entraîne une diminution de la surface pour la navigation de plaisance, la pêche et les loisirs, ainsi qu’une réduction de la capacité de production d’énergie de la centrale électrique du barrage.
Géochimie des solutions aqueuses:
Regardez un diagramme du cycle hydrogéochimique.
- Acide = substance contenant de l’hydrogène qui donne de l’hydrogène libre (H + ) lorsqu’elle est dissoute dans l’eau
- Base = substance contenant le groupe OH qui donne du (OH – ) libre lorsqu’elle est dissoute dans l’eau
-
Une solution acide est une solution contenant un excès de H + libre, et une base est une solution contenant un excès de OH – libre. Une réaction entre un acide et une base est généralement appelée neutralisation.
Par exemple :
-
HCl (acide) + NaOH (base) ==> H 2 O + NaCl
qui sont dissociés en ions :
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - c’est-à-dire que Na + et Cl – ne sont pas affectés.
- pH = logarithme inverse de la concentration (activité) de H + libre , ou pH = -log
-
L’eau se dissocie en H + et OH – ;
-
la constante de dissociation est : K eau = =10 -14
- Il doit donc y avoir 10 -7 moles chacune de H+ et de OH – dans un kilogramme de solution neutre à la température standard de 25°C. Une mole représente 6,023 x 10 23 atomes (ou molécules) et H 2 O a un poids moléculaire de 18 grammes par mole. Un kilogramme d’eau contient environ 1000/18 = 55,6 moles d’eau ou environ 3,35 x 10 25 atomes d’oxygène et environ deux fois ce nombre (6,7 x 10 25 atomes) de H + (la quantité de H + libre ou de OH – libre est relativement faible par rapport à la quantité de H 2 O non dissocié).
- Le pH varie à 25°C de 0 à 14 ; pH < 7 = solution acide ; pH > 7 = solution basique. Si on ajoute du HCl ou un autre acide, alors le pH diminue ; si on ajoute du NaOH ou une autre base, alors le pH augmente.
- Le pH augmente lorsque l’acide carbonique (un acide faible) se dissocie : Lorsque le dioxyde de carbone se combine à l’eau, comme ce qui se passe dans l’atmosphère lors de la combustion de combustibles fossiles, de l’acide carbonique se forme : H 2 O + CO 2 ==> H 2 CO 3 . Des H + libres sont rendus disponibles lors des dissociations successives :
-
H 2 CO 3 ==> H + + HCO 3- acide carbonique en bicarbonate, se produit à pH ~6,4
-
HCO 3 ==> H + + CO 32- bicarbonate en carbonate, se produit à pH ~10.3
Rappelez-vous, le H + libre n’est disponible que lorsqu’il est acide, ou lorsque le pH < ~7. La dissociation du bicarbonate en carbonate se produit lorsqu’il y a trop de OH – dans le système et que le H + est « libéré » pour équilibrer la base.
- Cations et anions dissous dans l’eau
Cations = donneurs d’électrons, chargés positivement : Na + , K + , Mg ++ , Ca ++ , Fe ++ ou Fe +++ , Mn ++ , Al +++
Anions = accepteurs d’électrons, chargés négativement : Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Métaux = agissent comme des cations principalement : Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, etc.
- Analyses de l’eau – Besoin d’avoir un équilibre cation-anion
millequivalent (MEQ) = charge équivalente en mole ou anion ou cation, mesure de la charge totale due à l’ion en question dissous dans la solution. Commencez par la concentration, divisez par le poids molaire, multipliez par la charge : XX mg/L / MW x CHG = MEQ
Exemple : NaCl en solution, Na = 50 mg/L (50 ppm) : 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm) : 77/35,5 x -1 = -2,17 MEQ
Donc, si les MEQ totales des cations et des anions ne sont pas équilibrées, il existe une erreur dans l’analyse.