INTRODUCTION
L’hypercholestérolémie familiale hétérozygote (HF) est une maladie génétique courante associée à une maladie cardiovasculaire athérosclérotique prématurée (ASCVD). Les enfants atteints d’HF non traitée présentent un risque accru d’ASCVD prématurée après l’âge de 20 ans.1 L’élévation sévère du taux de cholestérol des lipoprotéines de basse densité (LDL-C) commence dès le fœtus et entraîne une exposition soutenue de la paroi artérielle au LDL-C, ce qui accélère le dépôt de cholestérol et l’inflammation vasculaire et prédispose à l’initiation précoce de l’athérosclérose, en particulier dans les artères coronaires et l’aorte.
Les statines et autres thérapies hypolipidémiantes (LLT) abaissent efficacement le LDL-C, sont sans danger chez les enfants et les adolescents et restaurent la fonction endothéliale à un âge précoce2.-4 Récemment, le dépistage universel des enfants à partir de 2 ans et avant 8 ans a été proposé5,6 pour détecter les individus nécessitant un traitement. Cependant, cette approche est basée sur des considérations théoriques et n’a pas été prouvée dans la vie réelle.
Néanmoins, on sait peu de choses sur les caractéristiques des patients atteints d’HF âgés de moins de 18 ans, sur l’ATL utilisé chez ces patients et sur les objectifs lipidiques atteints dans la vie réelle. Le déficit d’information est encore plus important pour les données de suivi. Les registres nationaux peuvent être utilisés pour fournir ces informations cruciales, qui sont nécessaires pour améliorer les modèles de soins pour l’HF, les protocoles thérapeutiques et la politique de santé.7,8 L’étude SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) a été conçue pour améliorer la compréhension des facteurs pronostiques et des mécanismes influençant le développement des ASCVD et la mortalité dans une population FH.
Notre objectif était d’analyser les caractéristiques des patients et d’évaluer les objectifs de LLT et de lipides à l’inclusion et au cours du suivi chez les patients FH de moins de 18 ans inscrits à SAFEHEART et de déterminer les facteurs prédictifs de la probabilité de l’atteinte de ces objectifs.
METHODSStudy Design and Population
SAFEHEART est une étude de cohorte prospective à long terme, ouverte, multicentrique et nationale dans une population FH définie de manière moléculaire en Espagne. Le recrutement des participants issus de familles FH a commencé en 2004 et se poursuit encore. Les critères d’inclusion étaient les cas index avec un diagnostic génétique de FH et leurs parents de plus de 15 ans avec un diagnostic génétique de FH, ainsi que leurs parents sans diagnostic génétique de FH (groupe témoin). Néanmoins, des participants âgés de moins de 15 ans ont également été recrutés, à la demande de leurs parents. Cette étude a été approuvée par les comités d’éthique locaux. Toutes les personnes éligibles et/ou au moins un de leurs parents ou tuteurs légaux ont fourni un consentement éclairé écrit. Un centre de coordination basé à Madrid, en Espagne, était chargé de gérer le suivi des participants. Les patients et/ou leurs parents ont été contactés chaque année par un appel téléphonique standardisé afin d’enregistrer les changements pertinents dans les habitudes de vie et les médicaments, ainsi que tout événement cardiovasculaire ou autre problème médical. Les médecins qui inscrivaient les patients et les familles dans ce registre ont reçu une formation, avec des directives de meilleures pratiques renforcées lors de réunions annuelles auxquelles assistaient des médecins experts dans le domaine ; en outre, un programme électronique et des conseils par téléphone ont été utilisés et un programme de formation en ligne a été déployé pour soutenir davantage la prise en charge si nécessaire. Les décisions de traitement étaient exclusivement prises par le médecin de chaque patient.
Mesures cliniques et de laboratoire
Les caractéristiques démographiques et cliniques ont été enregistrées comme décrit ailleurs.9 Des échantillons de sang veineux ont été prélevés après 12h de jeûne. Les échantillons de sérum, de plasma et d’ADN ont été aliquotés et conservés à -80°C. Les taux sériques de cholestérol total, de triglycérides et de cholestérol des lipoprotéines de haute densité (HDL-C) ont été mesurés dans un laboratoire central à l’aide de méthodes enzymatiques. La concentration sérique de LDL-C a été calculée à l’aide de la formule de Friedewald. L’ADN a été isolé du sang total à l’aide de méthodes standard et le diagnostic génétique de l’HF a été réalisé à l’aide d’une puce à ADN.10 Les objectifs en matière de LDL-C ont été définis conformément aux recommandations et objectifs récents. Le cholestérol à lipoprotéines de basse densité
mg/dL était l’objectif principal.11 Un objectif alternatif pour les patients de moins de 14 ans consistait en un LDL-C mg/dL en l’absence de tout autre facteur de risque cardiovasculaire (tabagisme, HDL-C mg/dL, lipoprotéine (a) > 50mg/dL, ou LDL-C > 250mg/dL) ou de maladie cardiovasculaire prématurée chez les géniteurs ou les grands-parents.6 Les ASCVD familières prématurées ont été définies comme la survenue d’un premier événement avant 55 ans chez les hommes et avant 65 ans chez les femmes.Classification des traitements hypolipidémiants
La dose maximale de statine a été définie comme étant de 40 à 80mg/j d’atorvastatine ou de 20 à 40mg/j de rosuvastatine, qui ont été considérées comme des doses de statine de haute intensité. La thérapie combinée maximale a été définie comme la dose maximale de statine plus l’ézétimibe 10mg/j. L’ATL maximal était défini comme tout ATL devant produire une réduction d’au moins 50% des niveaux de base de LDL-C : simvastatine 20, 40 ou 80mg/j plus ézétimibe 10mg/j ; pravastatine 40mg/j en association avec ézétimibe 10mg/j ; fluvastatine 80mg/j plus ézétimibe 10mg/j ; atorvastatine 40 ou 80mg/j avec ou sans ézétimibe 10mg/j ; atorvastatine 10 ou 20mg/j plus ézétimibe 10mg/j ; rosuvastatine 20 ou 40mg/j avec ou sans ézétimibe 10mg/j ; rosuvastatine 10mg/j plus ézétimibe 10mg/j ; et pitavastatine 4mg/j en association avec ézétimibe 10mg/j.12,13
Analyse génétique
Les mutations du récepteur du cholestérol des lipoprotéines de basse densité (LDLR) ont été classées, en fonction de leur effet connu sur la fonction de la protéine du récepteur des LDL, en mutations nulles (récepteur négatif) et défectueuses (récepteur défectueux), comme décrit précédemment.14 Les variants conduisant à l’absence complète ou à la troncature de la protéine (perte de fonction) démontrée par une analyse fonctionnelle in vitro ou une analyse par simulation informatique ont été classés comme récepteurs négatifs. Ces variantes comprenaient les suivantes : a) mutations ponctuelles entraînant un codon d’arrêt prématuré ; b) mutations faux-sens affectant la cinquième répétition riche en cystéine dans le domaine de liaison au ligand du gène du récepteur LDL-C (mutation de classe 2A) ; c) petites délétions ou insertions entraînant un décalage de cadre et un codon d’arrêt prématuré ; et d) grands réarrangements. Les mutations défectueuses au niveau des récepteurs étaient les autres mutations ponctuelles inframe et les petites délétions et insertions inframe. Toutes les mutations sans analyse de fonctionnalité connue au moyen d’études in vitro ou d’analyses de simulation par ordinateur ont été classées dans la catégorie « fonctionnalité inconnue » parce que nous ne pouvions pas être certains que l’effet sur le récepteur était négatif ou défectueux ; cependant, elles ont été considérées comme pathogènes parce que tous les individus porteurs d’une de ces mutations présentaient une hypercholestérolémie, alors que les parents sans la mutation avaient des taux de cholestérol normaux.14
Analyse statistique
Les analyses statistiques ont été effectuées à l’aide de SPSS version 18.0 (SPSS Inc, Chicago, Illinois, États-Unis). La normalité de la distribution des variables a été analysée avec le test de Kolmogorov-Smirnov. Les données quantitatives sont exprimées en médiane et en écart interquartile (IQR) et les données qualitatives en nombre absolu et en pourcentage. Deux populations ont été définies : la population à l’entrée (n = 241) et la population au suivi (autrement appelée cohorte), qui comprenait les patients qui avaient un profil lipidique plasmatique complet au suivi (n = 217). Toutes les comparaisons entre l’entrée et le suivi ont été effectuées dans l’étude de cohorte. Les comparaisons de fréquences entre les variables qualitatives ont été effectuées à l’aide du test du chi carré. Les changements dans les variables binaires ont été analysés par le test de McNemar. Les valeurs médianes des variables quantitatives ont été comparées à l’aide du test non paramétrique de Mann-Whitney ou du test de rang signé de Wilcoxon apparié, selon le cas. Une analyse de régression logistique binaire directe a été réalisée dans l’étude de cohorte pour déterminer les variables associées à l’utilisation de statines. Nous avons inclus les variables qui étaient statistiquement significatives dans les analyses univariées, ainsi que les prédicteurs et les facteurs de confusion a priori : âge, sexe et suivi dans un établissement primaire/spécialisé. Une autre analyse de régression logistique binaire avant a été réalisée dans l’étude de cohorte, en excluant les patients qui avaient atteint l’objectif à l’entrée, afin de déterminer les variables associées à l’atteinte d’un LDL-C
mg/dL. Nous avons inclus les variables qui étaient statistiquement significatives dans les analyses univariées, ainsi que les prédicteurs et les facteurs de confusion a priori : âge, sexe, type de mutation (nulle ou défectueuse), utilisation d’ézétimibe et suivi dans un établissement primaire/spécialisé. Les différences ont été considérées comme statistiquement significatives à P RÉSULTATS
À ce jour, 4141 participants ont été inscrits dans le registre SAFEHEART ; 392 ont moins de 18 ans. Parmi eux, 241 ont une confirmation moléculaire de FH, et 217 ont été suivis avec un profil lipidique complet (90,0%) (Figure 1). Vingt-quatre patients ont été omis de l’analyse en raison de l’absence d’un profil lipidique complet lors du suivi. Le suivi a eu lieu dans un établissement de soins primaires pour 40 patients (18,4 %). La durée médiane du suivi était de 4,69 ans (IQR, 2,48-6,38 ans).
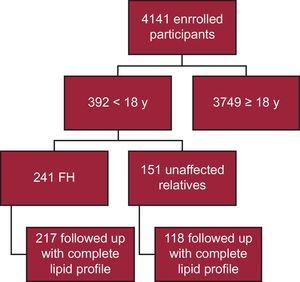
Caractéristique schématique de l’étude. FH, hypercholestérolémie familiale.
Au moment du recrutement (la population à l’entrée), 129 patients FH (53,5%) étaient des hommes. L’âge médian était de 15,0 ans (IQR, 14,0-16,0 ans). Les deux plus jeunes patients étaient âgés de 8 ans. Aucun patient ne présentait d’antécédents d’ASCVD et 40 (16,6 %) présentaient une ASCVD familiale précoce. Les caractéristiques de base sont présentées dans le tableau 1. Une comparaison des caractéristiques de base à l’inclusion entre les patients de la cohorte et ceux qui n’ont pas été suivis est présentée dans le tableau 1. Aucune différence significative n’a été constatée entre les 2 groupes. Aucun patient n’avait d’antécédents d’ASCVD, d’hypertension artérielle ou de diabète sucré. Une proportion plus élevée du groupe sans suivi était prise en charge dans le cadre des soins primaires, bien que la différence ne soit pas statistiquement significative. Dans la cohorte, on a observé des réductions significatives des concentrations plasmatiques de cholestérol total, de LDL-C, de triglycérides et de non-HDL-C ; une augmentation significative du HDL-C a également été observée lors du suivi (tableau 2).
Caractéristiques de base de la population à l’entrée
| Patients atteints d’HF avec suivi Médiane (IQR)/nb. (%) |
Patients HF sans suivi Médiane (IQR)/nb. (%) |
P | |
|---|---|---|---|
| Nombre de patients | 217 | 24 | |
| Sexe (homme) | 117 (53,9%) | 12 (50%) | .72 |
| Age, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Prémature familière ASCVD | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Fumeur de tabac actif | 13 (6,0%) | 2 (8,3%) | .65 |
| Xanthomes | 1 (0,5%) | 0 (0,0%) | .99 |
| Arche cornéenne | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Tour de taille, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Cholestérol total, mg/dL | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dL | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Géré dans le cadre des soins primaires | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, maladie cardiovasculaire athérosclérotique ; BMI, indice de masse corporelle ; FH, hypercholestérolémie familiale ; HDL-C, cholestérol à lipoprotéines de haute densité ; LDL-C, cholestérol à lipoprotéines de basse densité ; Lp (a), lipoprotéine (a) ; IQR, intervalle interquartile ; TG, triglycérides.
Concentrations de lipides et de lipoprotéines plasmatiques (Cohorte)
| Cohorte à l’entrée | Cohorte au suivi-.suivi | P | |
|---|---|---|---|
| Cholestérol total, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 |
| Non-HDL-C, mg/dL | 171.0 (145.8-209.2) | 154.0 (132,0-182,5) | .001 |
HDL-C, cholestérol à lipoprotéines de haute densité ; LDL-C, cholestérol à lipoprotéines de basse densité ; TG, triglycérides.
Les valeurs sont la médiane (intervalle interquartile).
Mutations fonctionnelles
Nous avons identifié 212 patients présentant une mutation dans les gènes des récepteurs du LDL-C (97,7%) et 5 patients présentant une mutation dans les gènes de l’apolipoprotéine B (2,3%). Parmi les mutations des gènes des récepteurs du LDL-C, 95 (43,8 %) ont été classées comme mutations nulles, 92 (42,4 %) comme mutations défectueuses et 25 (11,5 %) comme mutations de fonctionnalité inconnue.
Traitement hypolipidémiant et atteinte des objectifs
Le tableau 3 montre l’utilisation de différents régimes de LLT à l’entrée et au suivi. Les résultats montrent une augmentation significative de l’utilisation des statines (44,2 % à l’entrée et 68,2 % au suivi), de l’ézétimibe (8,7 % à l’entrée et 15,2 % au suivi), de la dose maximale de statine (3,3 % à l’entrée et 13,9 % au suivi) et de l’ATL maximale (7,9 % à l’entrée et 23,6 % au suivi). La statine la plus prescrite à l’entrée (25,3 %) et lors du suivi (30.5 %) était l’atorvastatine. La prescription de rosuvastatine a augmenté (de 6,0 % à l’inclusion à 20,3 % au suivi). La durée médiane du traitement par statine était de 7,0 ans (5,0 à 9,0 ans). L’âge des premières règles était de 12,0 ans (12,0 à 13,0 ans) pour les filles traitées par statines et de 12,0 ans (11,0 à 13,0 ans) pour les filles non traitées par statines (P = 0,77). Aucune augmentation des transaminases hépatiques ou de la créatine phosphokinase n’a été observée. Les fibrates et les séquestrants d’acide biliaire n’ont été utilisés que chez 15 patients à l’inclusion (7,0 %) et 3 patients au suivi (1,5 %). L’ézétimibe en monothérapie sans statine a été utilisé chez 18 patients à l’inclusion (8,3%) et 24 patients au suivi (11,1%). En ce qui concerne l’adhésion au traitement, 10 patients (4,6 %) ont déclaré ne pas prendre de médicaments au moins un jour par mois pendant le suivi. Lors de l’analyse multivariable, aucune variable n’était indépendamment associée à l’utilisation de statines.
Traitements hypolipidémiants et atteinte de l’objectif du LDL-C (cohorte)
| A l’entrée-/suivi-.up- | A l’entrée-/suivi+ | A l’entrée+/suivi- | A l’entrée+/suivi+ | P | |
|---|---|---|---|---|---|
| Patients sous statines | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Patients sous dose maximale de statine | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Patients sous ézétimibe | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Patients sous traitement combiné maximal | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Patients sous LLT maximum | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, cholestérol à lipoprotéines de basse densité ; LLT, traitement hypolipidémiant.
Les valeurs sont en n (%). – = non présent ; + = présent.
Voir texte pour classification LLT.
La concentration plasmatique de LDL-C a diminué en moyenne de 12,5 %, atteignant une valeur médiane de 138,0mg/dL lors du suivi. Les objectifs de cholestérol des lipoprotéines de basse densité, tels que définis par les récentes recommandations internationales sur le FH, ont été atteints chez 20,3% à l’entrée et 41,5% au suivi (tableau 3 et figure 2). Lorsqu’un objectif alternatif de LDL-C
mg/dL a été considéré pour les patients de moins de 14 ans, 8 patients sur 48 (16,7 %) et 1 patient sur 6 (16,7 %) ont atteint l’objectif à l’inclusion et lors du suivi, respectivement. La seule variable indépendamment associée à l’atteinte de l’objectif de LDL-C dans l’analyse multivariable était l’utilisation de statines (odds ratio, 13,83 ; intervalle de confiance à 95 %, 2,98-64,15). Le type de prestataire de soins (spécialiste ou médecin traitant), l’âge, le sexe, le taux de lipoprotéine (a) et le type de mutation n’étaient pas associés à l’atteinte de l’objectif de LDL-C.
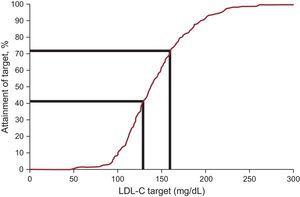
Objectifs des traitements chez les patients atteints d’hypercholestérolémie familiale âgés de moins de 18 ans : proportion de patients atteignant la cible de LDL-C. LDL-C, cholestérol à lipoprotéines de basse densité.
DISCUSSION
Dans cette étude, nous rapportons les caractéristiques, l’utilisation des LLT et l’atteinte de l’objectif de LDL-C dans une cohorte longitudinale de patients atteints d’HF à définition moléculaire âgés de moins de 18 ans inscrits dans le registre SAFEHEART. Ce registre unique de patients atteints de FH est basé sur des données obtenues dans la vie réelle en Espagne dans des établissements de soins spécialisés et primaires. Nos résultats montrent qu’un objectif de traitement du LDL-C
mg/dL n’a été atteint que par 20,3% des patients à l’inclusion et par 41,5% au suivi, avec 68,2% des patients sous LLT. L’utilisation de statines était le seul facteur indépendamment associé à l’atteinte de l’objectif de traitement du LDL-C. A notre connaissance, aucun autre travail n’a montré l’atteinte de l’objectif chez les patients FH de moins de 18 ans et cette étude est la première à le rapporter dans une large population.
Récemment, un registre du Royaume-Uni15 a analysé 207 enfants atteints de FH, identifiant des mutations chez 64% des enfants et trouvant que 48% étaient sous LLT ; une réduction de 35% du LDL-C a été atteinte. Cependant, les auteurs n’ont pas rapporté de résultats concernant l’atteinte des objectifs. Un autre rapport, qui a analysé un petit échantillon de sujets (n = 89), a montré une réduction de 43 % du LDL-C lors du suivi à long terme.16 Cette réduction plus importante est probablement due à une utilisation plus fréquente de la thérapie combinée (56 %). Aucun résultat d’atteinte d’objectif n’a été montré. Dans un autre article rétrospectif portant sur 207 patients aux Pays-Bas, seuls 26 % des patients étaient sous traitement LLT et, une fois de plus, aucun résultat concernant l’atteinte de l’objectif de LDL-C n’a été rapporté.17
Cette étude longitudinale a montré que les niveaux de LDL-C chez les patients atteints de FH âgés de moins de 18 ans peuvent changer au fil du temps en raison de la modification du traitement LLT et de l’éducation des médecins. La proportion de patients sous statines, la dose maximale de statines et l’ELT maximal ont augmenté de manière significative au cours du suivi. De manière intéressante, nos données indiquent que notre cohorte n’est pas biaisée car il n’y avait pas de différences statistiquement significatives entre les patients qui n’ont pas été suivis et la cohorte.
Un diagnostic et une prise en charge précoces de l’HF sont essentiels, en particulier chez les enfants et les adolescents, pour prévenir le développement des ASCVD à l’âge adulte. Le dépistage de l’HF chez les enfants est utile et doit être effectué avant l’âge de 8 ans car les enfants atteints d’hypercholestérolémie présentent un risque accru d’ASCVD prématurée. En outre, le dépistage peut permettre d’identifier les enfants les plus à risque et d’initier rapidement un traitement par LLT, qui s’est avéré efficace pour inverser le processus athérosclérotique et réduire le risque d’ASCVD. Les enfants atteints de FH ne présentent généralement pas d’ASCVD clinique. Néanmoins, l’existence d’un risque futur soutient l’utilisation de l’ATL, les statines étant la pierre angulaire de la gestion de l’HF.18
La sécurité et la tolérabilité de l’ATL dans l’HF pédiatrique sont toujours controversées, bien qu’elles soient rapportées comme étant similaires à celles des adultes.5,19,20 Récemment, Ramaswami et al.15 n’ont rapporté aucun problème de sécurité, similaire à nos résultats. Néanmoins, une surveillance stricte est recommandée, en particulier chez les patients recevant des doses plus élevées de statines. Il faut également conseiller aux adolescentes de suspendre le traitement aux statines lorsqu’elles envisagent une grossesse. Néanmoins, bien que davantage de données sur les questions de sécurité pour les enfants sous traitement à long terme par LLT soient nécessaires, des travaux récents de suivi à long terme ont montré un excellent profil de sécurité.21 Cette conclusion est indirectement soutenue par nos données, car une proportion élevée de patients a commencé le LLT pendant le suivi et il y a eu peu d’abandons. Nos résultats montrent clairement un pourcentage accru de patients utilisant des statines, une dose élevée de statines et un LLT maximal, avec une faible proportion de patients abandonnant le médicament. Ces données confirment l’innocuité, l’adhésion et la tolérabilité des statines, même lorsqu’elles sont utilisées à une dose élevée, chez les patients atteints de FH âgés de moins de 18 ans.22 De plus, nos résultats concordent avec des rapports antérieurs ne montrant aucun effet sur la maturation sexuelle.23 Tous ces résultats réaffirment le concept » plus c’est jeune, mieux c’est » concernant l’âge idéal pour initier les statines chez ces jeunes patients atteints de FH23.
Nos résultats montrent un nombre élevé de patients atteints de FH âgés de moins de 18 ans et, conformément aux études précédentes,15,16 suggèrent la volonté des patients adultes atteints de FH d’inclure les membres de leur famille immédiate dans les activités de dépistage et de registre. Ce fait reflète le sérieux avec lequel ces patients prennent leur problème et l’impact que les conseils de leurs médecins peuvent avoir sur le changement de leur mode de vie. Une telle attitude chez les patients adultes constitue la base d’un mode de vie sain chez leurs proches.24
Bien que l’objectif le plus courant chez les patients FH de moins de 18 ans soit un taux de LDL-C inférieur à 130mg/dL, une approche alternative consistant à mesurer le LDL-C mg/dL peut être utilisée chez les patients de moins de 14 ans, non-fumeurs, avec un HDL-C ≥ 40mg/dL, une lipoprotéine (a) mg/dL, un LDL-C mg/dL, et sans maladie cardiovasculaire prématurée chez les géniteurs ou les grands-parents.6 D’autres lignes directrices récentes recommandent une réduction de 50 % du LDL-C par rapport aux niveaux de prétraitement mais, pour les enfants âgés de ≥ 10 ans, surtout s’il existe des facteurs de risque cardiovasculaire supplémentaires, notamment une lipoprotéine (a) élevée, l’objectif de LDL-C devrait être de mg/dL.11 Nos résultats montrent également la difficulté rencontrée par ces patients pour atteindre les objectifs lipidiques.25 De plus, l’atteinte de l’objectif de LDL-C était similaire que les patients soient traités par des spécialistes ou des médecins de premier recours. Ainsi, il est possible d’atteindre un niveau de soins pour les patients pédiatriques atteints d’HF dans un contexte de soins primaires qui soit comparable à celui atteint par les soins spécialisés. Pour atteindre cet objectif, il est important de souligner le soutien que les cliniciens reçoivent via les registres et les programmes de formation dédiés. Les registres peuvent optimiser la prise en charge des patients atteints de FH âgés de moins de 18 ans en permettant l’intégration des soins primaires et spécialisés et peuvent également soutenir les autorités sanitaires dans la prise de décision.8,26
Limites et points forts
Dans cette vaste étude de suivi des patients atteints de FH âgés de moins de 18 ans, l’intervention était inchangée par rapport à celle fournie par le médecin du patient. Il manque un profil lipidique de base fiable dans ce registre car certains patients recevaient déjà un traitement au moment de leur inscription. En outre, plusieurs conditions, telles que des modes de vie différents et une association avec différents facteurs de risque cardiovasculaire, ont pu modifier les résultats.
CONCLUSIONS
Les données du registre SAFEHEART montrent qu’une proportion élevée de patients FH âgés de moins de 18 ans ont des niveaux élevés de LDL-C et ne parviennent pas à atteindre les objectifs recommandés de LDL-C. Nous avons constaté une augmentation de l’intensité de l’ELT et une diminution significative des taux de LDL-C au cours du suivi. L’utilisation de statines était le seul prédicteur indépendant de l’atteinte des objectifs de LDL-C. De plus, aucun problème de sécurité n’a été détecté pendant le suivi. Ces résultats indiquent que de nombreux patients FH ne sont pas contrôlés de manière adéquate et qu’il est encore possible d’améliorer le traitement. En outre, le suivi de cette population de FH peut contribuer aux connaissances sur la sécurité de l’ATL à vie et sur l’âge optimal d’initiation du traitement pour prévenir le développement des ASCVD à l’âge adulte.
FINANCEMENT
Ce travail a été soutenu par la subvention G03/181 de la Fundación Hipercolesterolemia Familiar, FIS PI12/01289 de l’Instituto de Salud Carlos III, et la subvention 08-2008 du Centro Nacional de Investigación Cardiovascular.
CONFLITS D’INTÉRÊTS
Aucun n’a été déclaré.
- –
Les enfants atteints d’hypercholestérolémie familiale hétérozygote non traitée présentent un risque accru d’ASCVD prématurée après 20 ans.
- –
Les statines et les autres traitements hypolipémiants abaissent efficacement le LDL-C et sont sans danger chez les enfants et les adolescents.
- –
On sait peu de choses sur les caractéristiques des patients atteints de FH âgés de moins de 18 ans, sur les traitements hypolipémiants utilisés chez ces patients et sur les objectifs lipidiques atteints dans la vie réelle.
- –
Ce déficit d’information est encore plus important pour les données de suivi.
QUEL EST L’APPORT DE CETTE ETUDE ?
- –
Une proportion élevée de patients atteints de FH âgés de moins de 18 ans ne parvient pas à atteindre les objectifs recommandés en matière de LDL-C.
- –
Nous avons constaté une augmentation de l’intensité des LLT et une diminution significative des niveaux de LDL-C au cours du suivi.
- –
L’utilisation de la statine était le seul prédicteur indépendant de l’atteinte des objectifs de LDL-C et aucun problème de sécurité n’a été détecté pendant le suivi.
- –
Ces résultats renforcent le concept de « plus c’est jeune, mieux c’est ».
.