- Le système immunitaire
- Réaction immunitaire innée et adaptative
- Composantes du système immunitaire
- Cellules lymphoïdes
- Les cellules T
- Cellules B
- Cellules NK
- Cellules myéloïdes
- Macrophages
- Cellules dendritiques
- Autres cellules immunitaires innées et signalisation
- Immunologie dans la santé et la maladie
- Immunologie du cancer
Le système immunitaire
Le système immunitaire est composé de tissus, de cellules et de molécules dont la fonction principale est de détecter, de répondre et d’éliminer les agents pathogènes et les cellules transformées.
Réaction immunitaire innée et adaptative
Il existe deux composantes principales du système immunitaire-1) le système immunitaire inné et 2) le système immunitaire adaptatif. Le système immunitaire inné agit comme la première ligne de défense et détecte les agents pathogènes par le biais de récepteurs de reconnaissance des formes codés par la lignée germinale, ne forme pas de mémoire et répond rapidement (en quelques minutes à quelques heures). Le système immunitaire adaptatif réagit lentement (sur plusieurs jours), utilise des récepteurs spécifiques aux antigènes qui subissent de multiples réarrangements génétiques au cours de leur développement, et forme une mémoire immunologique, c’est-à-dire qu’il « apprend » de l’agression initiale et prépare l’organisme à combattre une exposition future à des substances nocives similaires. Ces deux types de réponses immunitaires peuvent être déclenchées par des macromolécules présentes dans le liquide extracellulaire ou par l’activation de cellules immunitaires spécifiques. Ces réponses sont connues sous le nom d’immunité humorale et d’immunité à médiation cellulaire, respectivement.
Sous le parapluie de la réponse immunitaire à médiation cellulaire, les cellules immunitaires se stratifient principalement selon que la réponse est innée ou adaptative. Le système immunitaire inné se compose principalement de cellules phagocytaires, telles que les neutrophiles, les macrophages, les cellules tueuses naturelles, les basophiles et autres, qui ciblent les organismes envahisseurs dangereux. Les cellules du système immunitaire adaptatif sont les lymphocytes T et les lymphocytes B. Les cellules T tueuses naturelles (NK) présentent des caractéristiques des cellules immunitaires innées et adaptatives. En outre, la plupart des autres types de cellules, qui ne sont pas spécifiques du système immunitaire, peuvent héberger des fonctions immunitaires innées intrinsèques sous la forme de récepteurs cytoplasmiques et de molécules de signalisation et effectrices telles que les membres des familles RIG-I, STING et NLR. Comme nous le verrons plus loin, les cellules des deux systèmes proviennent de différentes lignées myéloïdes et lymphoïdes de cellules souches hématopoïétiques.
Composantes du système immunitaire
Les cellules immunitaires matures se différencient à partir de ce que l’on appelle les cellules souches hématopoïétiques. Ce sont des cellules progénitrices indifférenciées pluripotentes que l’on trouve dans la moelle osseuse, le sang périphérique et le placenta. Ces cellules souches hématopoïétiques peuvent se différencier en cellule progénitrice myéloïde commune ou en cellule progénitrice lymphoïde commune.
Cellules lymphoïdes
Les cellules progénitrices lymphoïdes communes peuvent se différencier en quatre populations majeures de lymphocytes qui peuvent être distinguées par l’expression des récepteurs de surface cellulaire : les cellules T, les cellules B, les cellules tueuses naturelles (NK) et les cellules NK-T.
Les cellules T
Les cellules T jouent un rôle essentiel dans l’immunité à médiation cellulaire. Ces cellules sont identifiées par l’expression des chaînes de signalisation des cellules T CD3.
Les cellules T naissent des cellules progénitrices lymphoïdes qui se développent à l’origine à partir des cellules souches hématopoïétiques de la moelle osseuse. Une fois que le progéniteur lymphoïde s’engage à devenir une cellule T, il migre de la moelle osseuse vers le thymus (d’où le nom de cellule T). Le thymus fournit le microenvironnement approprié où les cellules T peuvent se développer en leurs différents sous-types, définis par les récepteurs spécifiques exprimés à la surface de la cellule. Les cellules T en cours de maturation aux premiers stades, ou thymocytes, sont dépourvues de récepteurs CD4 et CD8 et sont donc appelées cellules doublement négatives (DN). Les cellules DN subissent ensuite des réarrangements génétiques et des mutations des gènes codant pour les récepteurs alpha et bêta des cellules T (TCR), ce qui les engage sur la voie de l’engagement de la lignée, le résultat final étant un récepteur de cellule T ayant une affinité spécifique pour un antigène unique.
Les thymocytes sont ensuite sélectionnés, à la fois positivement et négativement, pour s’assurer qu’ils reconnaissent les antigènes « étrangers » mais pas les antigènes de l’hôte, qui sont présentés sous forme de peptides via le CMH à la surface des cellules. Seules les cellules qui réussissent les deux tests seront ensuite déclenchées pour exprimer le CD4 et le CD8, devenant ainsi des cellules doublement positives. À la fin de la maturation, les cellules T exprimeront soit le CD4, soit le CD8 (et perdront l’expression de l’autre) et deviendront ainsi des cellules unipotentes. Ces cellules T matures CD4 ou CD8-positives sont ensuite libérées dans la circulation sanguine et sont initialement à l’état naïf, ce qui signifie qu’elles ne se sont pas encore engagées dans un sous-type particulier de cellules T.
Si le thymocyte en cours de maturation montre une quantité intermédiaire d’affinité pour les peptides du CMH du soi pendant la maturation, alors il peut être sélectionné pour devenir une cellule T régulatrice (Treg) pour sa capacité à reconnaître les antigènes « du soi » nuisibles. Les cellules T présentes dans le sang ou dans les tissus périphériques peuvent également être localement induites à devenir des Tregs. Le travail principal des Tregs est de maintenir la tolérance aux antigènes du soi, ainsi que de limiter la fonction et la prolifération des cellules T-effecteurs.
Une fois arrivées dans le sang ou les tissus périphériques, les cellules T naïves peuvent être induites à devenir une cellule T auxiliaire. Les cellules présentatrices d’antigènes (CPA), telles que les macrophages, les cellules dendritiques et les cellules B, présenteront l’antigène à la cellule T, et si son récepteur a une affinité, la cellule T reconnaîtra l’antigène. En général, les cellules T CD4+ sont aptes à reconnaître les antigènes peptidiques liés aux protéines du CMH de classe II. Une fois le complexe peptide-CMH reconnu, le lymphocyte T va activer une série de voies internes qui permettent de vérifier la reconnaissance de l’antigène. Ce n’est qu’à ce moment-là que la cellule T auxiliaire va proliférer, élargissant le pool de cellules disponibles spécifiques de l’antigène nocif, comme différentes bactéries et parasites.
Une fois que les cellules T auxiliaires ont reconnu leur antigène et sont activées, elles vont libérer une variété de cytokines, qui sont des molécules qui signalent aux autres cellules immunitaires comment répondre de manière appropriée à la molécule nocive. Il existe plusieurs sous-ensembles de cellules T auxiliaires, notamment Th1, Th2 et Th17. Ces sous-ensembles produisent et sécrètent des cytokines distinctes qui aident à adapter la réponse immunitaire en fonction du type d’agent pathogène. Par exemple, les cellules Th1 s’appuient sur la cytokine effectrice IFN-γ pour signaler aux macrophages qu’ils doivent digérer et détruire la matière nocive, tandis que les cellules Th2 sécrètent une combinaison d’IL-4, IL-5, IL-9, IL-10 et IL-13 pour inciter les basophiles, les éosinophiles et d’autres cellules à attaquer l’infection. La quantité et les variétés spécifiques de cytokines détermineront la réponse appropriée à l’infection ou à la cellule nuisible. Les cellules T peuvent également répondre aux cellules du soi en devenant des cellules T cytotoxiques (ou cellules T tueuses naturelles). Il s’agit généralement de cellules CD8+ qui reconnaissent les cellules infectées par un virus ou les cellules tumorales. Les cellules T tueuses naturelles (NKT) seront abordées plus en détail dans une section ultérieure. Ces types de cellules T et d’autres types de cellules T exécutent leurs diverses tâches ou fonctions effectrices de manière disparate pour reconnaître le matériel nuisible et recruter d’autres cellules immunitaires pour le détruire, ainsi que pour construire une réponse immunitaire durable au même type d’insulte.
La voie interactive de signalisation des récepteurs des cellules T est examinée en détail ici.
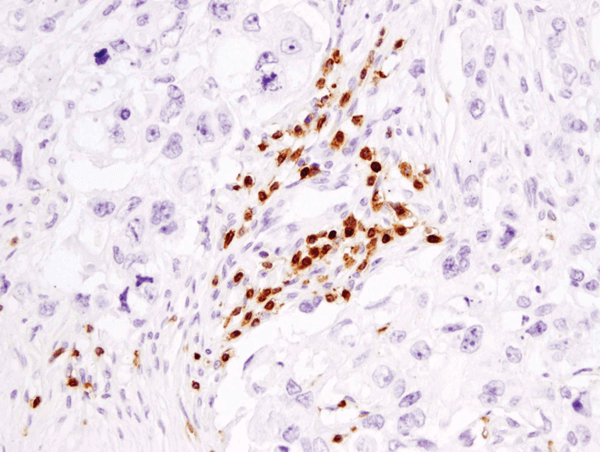
CD3ε (D7A6E™) XP® Rabbit mAb #85061 : analyse IHC de carcinome mammaire humain inclus en paraffine utilisant #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061 : analyse IHC de carcinome mammaire humain inclus en paraffine utilisant #85061.
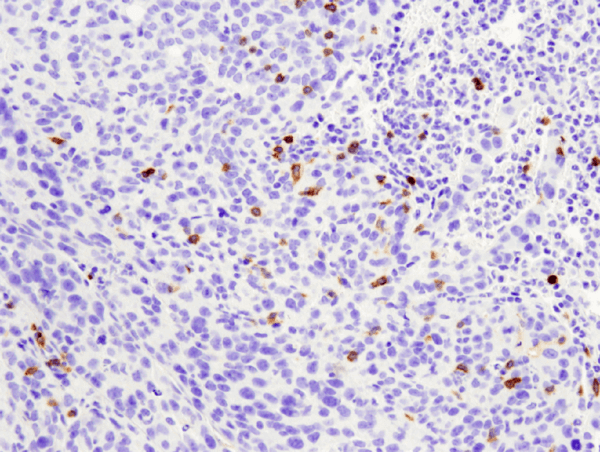
CD4 (D7D2Z) mAb de lapin #25229 : analyse IHC de la tumeur métastatique 4T1 en paraffine extraite du poumon de souris en utilisant #25229.
CD4 (D7D2Z) Rabbit mAb #25229 : Analyse IHC de la tumeur métastatique 4T1 en paraffine dans le poumon de souris en utilisant #25229.
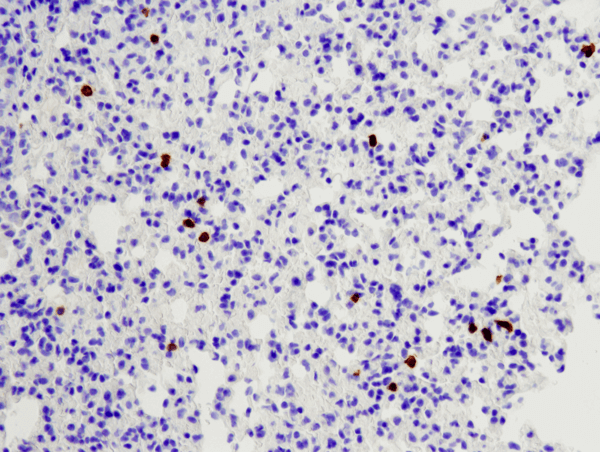
CD8α (D4W2Z) XP® mAb de lapin (spécifique à la souris) #98941 : Analyse IHC d’un poumon de souris inclus en paraffine utilisant #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941 : Analyse IHC de poumon de souris inclus en paraffine utilisant #98941.
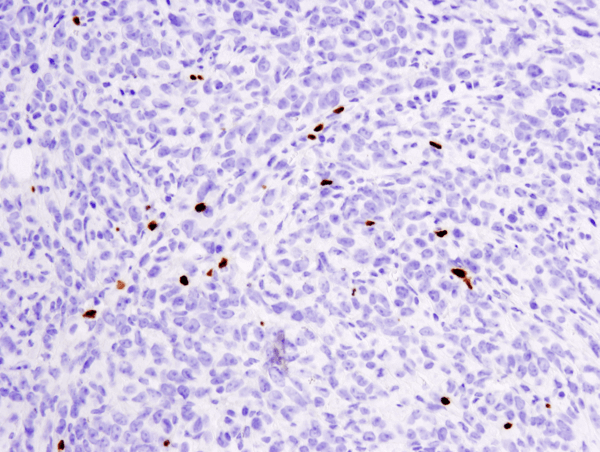
FoxP3 (D6O8R) mAb de lapin #12653 : analyse IHC d’une tumeur métastatique 4T1 extraite en paraffine dans un poumon de souris utilisant #12653.
FoxP3 (D6O8R) Rabbit mAb #12653 : analyse IHC d’une tumeur métastatique 4T1 prélevée en paraffine dans un poumon de souris utilisant #12653.
Cellules B
Les cellules B sont les cellules critiques du sang qui médient la production d’anticorps. Lorsqu’une matière nocive est présente dans le sang, elle est reconnue comme un antigène par des récepteurs spécifiques sur les cellules B. Ensuite, après avoir traité l’antigène, et avec l’aide des lymphocytes T, la cellule B se transforme en plasmocytes qui sécrètent les anticorps. Les cellules B peuvent également jouer un rôle dans la présentation des antigènes et la sécrétion de cytokines. Tant le développement que les diverses fonctions du lymphocyte B seront abordés.
15% des leucocytes présents dans le sang périphérique sont des cellules B. Les cellules B produisent des immunoglobulines (Ig), qui sont des protéines de liaison aux antigènes (également appelées anticorps) composées de deux chaînes lourdes identiques et de deux chaînes légères identiques. Ces immunoglobulines contiennent des sites spécifiques de liaison à l’antigène dont la séquence d’acides aminés varie d’une molécule d’anticorps à l’autre. Ces sites confèrent la spécificité de chaque anticorps pour la reconnaissance d’un antigène distinct.
Comme mentionné ci-dessus, les cellules B se différencient des cellules hématopoïétiques présentes dans la moelle osseuse. C’est dans la moelle osseuse que les récepteurs Ig de surface (anticorps) sont assemblés par un processus de réarrangement génétique. Les cellules B utilisent la jonction somatique de différents gènes sur une multitude de chromosomes qui codent les différentes parties des chaînes lourdes et légères qui constituent les Ig. Les cellules B sont poussées vers la différenciation par la production d’IL-7 par les cellules stromales de la moelle osseuse. Ces cellules B en développement suivent un programme de réarrangements séquentiels des chaînes lourdes et légères médiés par l’expression différentielle des récepteurs de la surface cellulaire. Par exemple, l’expression d’un récepteur spécifique des cellules pré-B empêche certains réarrangements génétiques sur des chromosomes non apparentés afin de garantir que la cellule B mature puisse exprimer un certain récepteur de surface Ig capable de reconnaître spécifiquement un seul antigène. Ce processus est appelé exclusion allélique. Un assemblage incorrect des chaînes lourdes et des chaînes légères d’Ig peut induire un réarrangement secondaire pour l’édition du récepteur.
En dehors de l’expression à la surface des cellules d’un récepteur d’Ig, les cellules B contiennent également des protéines transmembranaires qui peuvent induire des signaux intracellulaires après qu’un antigène se lie à la partie extracellulaire du récepteur d’Ig. Les cellules B utilisent des cascades de signalisation intracellulaire similaires à celles des cellules T qui induisent des changements transcriptionnels conduisant à la prolifération et à la maturation. Plus précisément, les domaines intracellulaires du récepteur d’Ig peuvent être phosphorylés par la famille des kinases src, initiant une cascade qui est transmise par la tyrosine kinase Syk et une protéine de liaison connue sous le nom de BLINK à la phospholipase C et aux facteurs d’échange de guanine, activant finalement la protéine kinase C, mobilisant le calcium et activant la MAP kinase d’une manière dépendante de Ras/Rac.
Une caractéristique unique des cellules B est leur capacité à subir une commutation isotype. Cela fait spécifiquement référence à un processus de réarrangement de l’ADN qui peut générer des chaînes lourdes légèrement différentes. De plus, l’épissage alternatif des exons de la chaîne lourde peut permettre à l’Ig de rester liée à la surface cellulaire ou de devenir sécrétée si l’exon transmembranaire est épissé. L’épissage alternatif et le changement d’isotype sont induits par les cytokines dérivées des lymphocytes T. De plus, les lymphocytes T peuvent induire un changement d’isotype. En outre, les lymphocytes T peuvent induire des mutations somatiques qui entraînent des changements dans les sites de liaison à l’antigène des Ig des lymphocytes B. Une fonction auto-correctrice des cellules B peut détecter si ces mutations apparemment aléatoires entraînent une perte d’affinité pour l’antigène et déclencher un programme de mort cellulaire. Ainsi, les antigènes qui activent à la fois les cellules T et les cellules B déclenchent la maturation des cellules B médiée par les cellules T par le biais de la commutation isotypique et des mutations somatiques, qui sont toutes deux fortement associées à la mémoire des cellules B.
Les réponses mémoires sont caractérisées par une production rapide et étendue d’Ig de haute affinité à de tels antigènes. Le développement de ces réponses mémoire est essentiel au succès de la vaccination. Cependant, elles peuvent également augmenter l’auto-immunité et les réactions allergiques.
L’activation des cellules B indépendantes des cellules T par un antigène peut également avoir lieu ; cependant, ce type d’activation est lié à une faible mémoire immunitaire. De plus, ces antigènes doivent être polymères afin d’activer les cellules B.
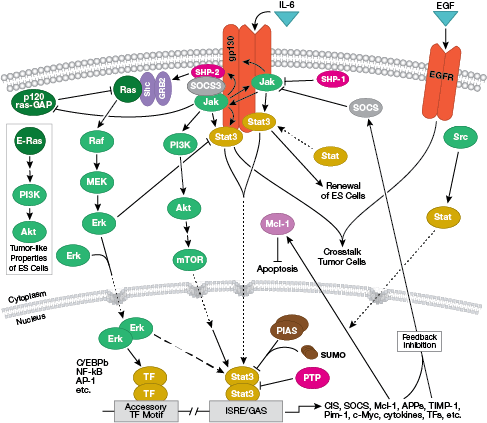
NB : Les cytokines, ou interleukines (IL), sont des molécules sécrétées qui agissent sur des récepteurs transmembranaires de surface cellulaire. Lors de leur liaison, ces cytokines activent des voies de transduction du signal intracellulaire typiquement dépendantes de la signalisation Jak-STAT.
La voie interactive de signalisation des récepteurs des cellules B est revue en détail ici.
CD19 (D4V4B) XP® Rabbit mAb #90176 : analyse IHC de carcinome pulmonaire humain inclus en paraffine utilisant #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176 : Analyse IHC d’un carcinome pulmonaire humain inclus en paraffine utilisant #90176.
Cellules NK
Les cellules tueuses naturelles, ou NK, sont un autre type cellulaire dérivé de la lignée lymphoïde. Comme les cellules B, elles se développent dans la moelle osseuse de manière dépendante des cytokines et des cellules stromales de la moelle osseuse. Elles représentent une faible proportion du sang périphérique et ne possèdent pas de récepteurs spécifiques aux antigènes. Au contraire, les cellules NK s’appuient sur un ensemble complexe de récepteurs transmembranaires. Elles contiennent notamment des récepteurs inhibiteurs à la surface des cellules qui reconnaissent les molécules HLA de classe I et sont donc inhibées par les molécules de CMH propres, ne tuant que les cellules dont l’expression HLA de classe I est régulée à la baisse. Elles ont donc pour objectif important de cibler les cellules infectées par un virus et les cellules tumorales dont l’expression HLA de classe I est régulée à la baisse pour échapper à la mort par les cellules T tueuses naturelles CD8+ (NK-T). Les cellules NK peuvent également être activées de manière dépendante des anticorps, de l’interféron ou des cytokines et peuvent donc jouer un rôle important dans la lutte contre les tumeurs. Le mécanisme d’action des cellules NK repose sur la libération de petits granules contenant des granzymes et des perforines à partir de leur cytoplasme. Dès leur libération, ces protéines peuvent former des pores et décomposer les protéines intracellulaires afin d’induire l’apoptose. A ce titre, les cellules NK sont dites cytotoxiques.
Les cellules NK-T sont un sous-type particulier de cellules T qui expriment certains récepteurs et marqueurs typiquement exprimés par les cellules NK en combinaison avec un répertoire limité de récepteurs de cellules T. Par conséquent, ce sous-type unique partage les propriétés des cellules T et des cellules NK. Contrairement aux cellules NK, qui se développent dans la moelle, les cellules NK-T se développent dans le thymus.
Cellules myéloïdes
Les cellules progénitrices myéloïdes communes, qui sont les descendantes des cellules souches hématopoïétiques, donnent naissance à plusieurs types différents de cellules myéloïdes, notamment les macrophages, les cellules dendritiques et plusieurs autres cellules immunitaires innées et cellules sanguines.
Macrophages
Les macrophages peuvent être déclenchés pour reconnaître des antigènes, tels que des cellules endommagées ou du matériel étranger, pour une destruction à la demande. Les macrophages sont présents dans la plupart des tissus et réagissent en cas de besoin aux infections et aux cellules mourantes. Le matériel reconnu est détruit par phagocytose dans le macrophage, d’où le nom de ces cellules (« gros mangeur » en grec). Les macrophages prennent diverses formes lorsqu’ils sont présents à différents endroits et peuvent remplir d’autres fonctions que la phagocytose.
Lors d’une blessure tissulaire ou d’une infection par un agent pathogène, les monocytes présents dans le sang seront recrutés dans le tissu affecté et se différencieront pour devenir des macrophages. Selon la localisation tissulaire, différents types de macrophages existent, comme les cellules de Kupffer dans le foie, les macrophages alvéolaires dans le poumon, la microglie dans le cerveau, etc. Ces différents types de macrophages sont tous issus des monocytes mais spécialisent leur fonction en fonction du tissu résident. La plupart des fonctions générales de phagocytose sont assurées par les macrophages des tissus résidents. Outre la phagocytose des cellules mortes et des matières étrangères, les macrophages peuvent également envoyer des signaux à d’autres cellules immunitaires par le biais de cytokines. Dans une certaine mesure, les macrophages remplissent la fonction critique de présentation de l’antigène, travaillant ainsi avec les cellules T pour soutenir l’immunité adaptative. En outre, les macrophages peuvent sécréter des cytokines telles que l’IL-12 et jouer un rôle dans les réponses immunitaires locales, tandis que d’autres sécrètent de grandes quantités d’IL-10, ce qui leur permet de jouer un rôle dans la réparation des tissus. Ainsi, les « gros mangeurs » jouent une variété de rôles dans le système immunitaire en plus du travail principal de phagocytose.
CD68 (D4B9C) XP® Rabbit mAb #76437 : analyse IHC de carcinome papillaire séreux humain de l’ovaire inclus en paraffine utilisant #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437 : analyse IHC de carcinome papillaire séreux humain de l’ovaire inclus en paraffine utilisant #76437.
CD163 (D6U1J) mAb de lapin #93498 : analyse IHC de carcinome pulmonaire non à petites cellules humain inclus en paraffine utilisant #93498 réalisée sur le Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498 : analyse IHC d’un carcinome pulmonaire humain non à petites cellules inclus en paraffine utilisant #93498 réalisée sur le Leica® Bond™ Rx.
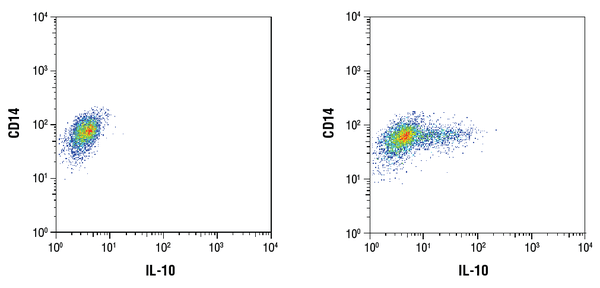
IL-10 (D13A11) XP® Rabbit mAb #12163 : Analyse cytométrique en flux de cellules mononucléaires CD14+ humaines purifiées du sang périphérique non traitées (à gauche) ou traitées par LPS (100ng/mL, 16 h ; à droite) en utilisant un anticorps CD14 et #12163. Brefeldin A #9972 (300ng/mL) a été ajouté aux cellules non traitées et traitées après 1 h de stimulation par LPS. L’IgG anti-lapin (H+L), fragment F(ab’)2 (conjugué Alexa Fluor® 647) #4414 a été utilisé comme anticorps secondaire.
IL-10 (D13A11) XP® Rabbit mAb #12163 : Analyse cytométrique en flux des cellules mononucléaires CD14+ humaines purifiées du sang périphérique non traitées (à gauche) ou traitées par LPS (100ng/mL, 16 h ; à droite) en utilisant un anticorps CD14 et #12163. Brefeldin A #9972 (300ng/mL) a été ajouté aux cellules non traitées et traitées après 1 h de stimulation par LPS. L’IgG anti-lapin (H+L), fragment F(ab’)2 (conjugué Alexa Fluor® 647) #4414 a été utilisé comme anticorps secondaire.
Cellules dendritiques
Similaires aux macrophages, les cellules dendritiques ont la capacité d’engloutir du matériel cellulaire et étranger, mais au lieu de le digérer pour l’éliminer, les cellules dendritiques traitent le matériel et le présentent comme des antigènes aux cellules T. En tant que telles, les cellules dendritiques servent de cellules présentatrices d’antigènes, ou cellules accessoires, et relaient ainsi les informations sur les agents pathogènes entre les systèmes immunitaires inné et adaptatif. Les cellules dendritiques tirent leur nom de leurs projections cellulaires distinctes qui s’étendent et saisissent les matières nocives pour les digérer.
Issues des progéniteurs hématopoïétiques de la moelle osseuse, les cellules dendritiques initialement immatures passent par une phase « d’apprentissage » au cours de laquelle elles échantillonnent leur zone locale à la recherche de matériel étranger et initient une réponse de reconnaissance via des récepteurs de reconnaissance de motifs (un ensemble commun de ces récepteurs sont les récepteurs de type toll). Ces cellules dendritiques immatures peuvent résider dans différents endroits ayant accès à l’environnement extérieur, comme la paroi du nez, de l’estomac, des poumons et même de la peau. Après avoir reconnu l’antigène, les cellules dendritiques migrent vers le ganglion lymphatique où elles entraînent les lymphocytes T à reconnaître l’antigène et à réagir en conséquence. Les cellules dendritiques sont les seules cellules présentatrices d’antigènes à activer à la fois les lymphocytes T mémoires et naïfs. Les récepteurs de type Toll sont une classe bien étudiée de récepteurs présents sur les macrophages et les cellules dendritiques, qui servent de médiateurs pour la reconnaissance et la réponse aux agents pathogènes étrangers. Outre l’interaction directe avec les lymphocytes T, les cellules dendritiques peuvent également émettre des signaux par le biais de cytokines telles que l’IL-12, qui préparent le système immunitaire à l’attaque ultérieure du matériel nuisible. D’autres types de cellules dendritiques peuvent sécréter des cytokines qui signalent le recrutement de macrophages supplémentaires pour nettoyer une surcharge de déchets. En tant que principaux médiateurs cellulaires de la présentation des antigènes, les cellules dendritiques jouent donc un rôle indispensable dans la diaphonie entre les systèmes immunitaires inné et adaptatif.
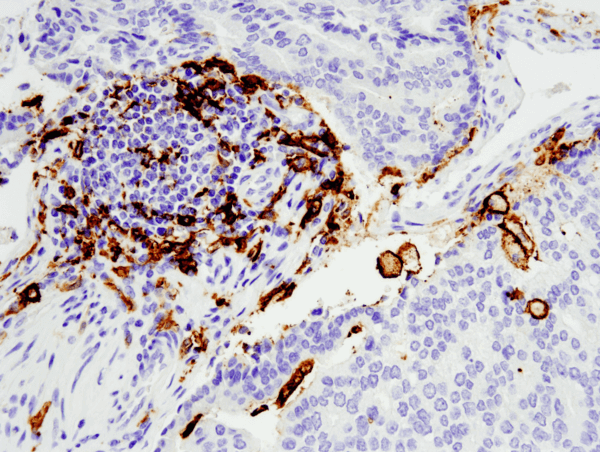
CD11c (D3V1E) XP® Rabbit mAb #45581 : Analyse IHC d’un adénocarcinome de prostate humain inclus en paraffine utilisant #455812 réalisée sur le Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581 : Analyse IHC d’un adénocarcinome de prostate humain inclus en paraffine utilisant #455812 réalisée sur le Leica® Bond™ Rx.
Autres cellules immunitaires innées et signalisation
Les autres cellules du système immunitaire inné comprennent les mastocytes, qui fonctionnent dans la cicatrisation des plaies et aident à fournir une protection contre les agents pathogènes. Lorsqu’ils sont déclenchés par un agent pathogène, les mastocytes peuvent sécréter des cytokines ainsi que des granules contenant de l’histamine et de l’héparine, qui servent de médiateur à d’autres réponses immunitaires telles que le recrutement des macrophages et la dilatation des vaisseaux sanguins. Les neutrophiles, les éosinophiles et les basophiles sont collectivement appelés granulocytes en raison de la présence de granules caractéristiques dans leur cytoplasme. Chez les neutrophiles, les granules agissent pour libérer des composés toxiques qui ciblent les agents pathogènes tels que les champignons et les bactéries.
Immunologie dans la santé et la maladie
Immunologie du cancer
L’exploitation des cellules immunitaires pour lutter contre le cancer est devenue un sujet de recherche très chaud en raison du succès en clinique. L’un des axes récents de l’immunothérapie actuelle consiste à cibler les protéines de contrôle de la signalisation, telles que PD-1, qui empêchent normalement l’activation et la réponse des cellules T. La thérapie cellulaire adoptive est une autre approche intéressante qui implique l’immuno-édition de cellules T prélevées sur le patient. Les cellules T sont modifiées pour exprimer un récepteur antigénique chimérique spécifique des cellules cancéreuses du patient. Les lymphocytes T sont ensuite réinjectés au patient et sont désormais programmés pour rechercher les cellules cancéreuses et les tuer, conformément à la fonction normale des lymphocytes T. Ces approches et d’autres visant à manipuler le système immunitaire pour qu’il attaque les cellules cancéreuses nocives du patient représentent une classe de thérapies révolutionnaires pour traiter le cancer.