Qu’EST-CE QU’UNE ANOMALIE CONGÉNITALE DES ARTERES CORONAIRES ?
Il existe un débat permanent sur ce qui doit être considéré comme normal et ce qui doit être considéré comme une anomalie des artères coronaires (CAA). Selon Angelini1, les AAC sont diagnostiquées par exclusion, ce qui signifie que, dans les cas où la morphologie des artères coronaires n’est pas normale, on définit la normalité selon un critère statistique (intervalle compris entre plus ou moins 2 déviations standard de la valeur moyenne). Ainsi, un CAA serait cette morphologie d’artère coronaire observée chez moins d’un pour cent de la population générale.1,2 Les CAA peuvent être produits au cours de la cardiogenèse normale ou pathologique : dans le premier cas, il en résulterait des CAA isolés, sur lesquels nous nous concentrons dans cet article, alors que, dans le second cas, ils seraient associés à d’autres malformations cardiaques.
CLASSIFICATION
Il existe plusieurs classifications1-3. Une nouvelle qui tente de standardiser les critères diagnostiques et regroupe les CAA selon 7 catégories a été récemment proposée4 (tableau 1).


Des groupes internationaux demandent la création de registres incluant au moins les anomalies à l’origine de la majorité des événements cliniques (mort subite et ischémie myocardique) attribués au CAA,5-7 constituées par celles qui prennent naissance dans le sinus de Valsalva controlatéral ou « mauvais ». Ce groupe comprend les artères coronaires à vaisseau unique (« hyperdominance » dans la classification de Rigatelli et al4), car elles doivent alimenter le myocarde en sang à partir d’un seul ostium coronaire et établir des trajets qui sont parfois similaires à ceux des AAC ayant pour origine le mauvais sinus de Valsalva (figure 1).

Figure 1. Artériographie coronaire en projection oblique antérieure gauche montrant une artère coronaire droite à vaisseau unique.
INCIDENCE
Les différentes définitions ou classifications et l’analyse des séries angiographiques8,9 et autopsiques10 et, ces dernières années, des séries échocardiographiques11 aboutissent à une incidence déclarée de l’AAC qui varie entre 0,1 % et 8,4 %,1,8,11 ce qui rend difficile l’établissement de l’ampleur exacte du problème qu’elles représentent. Dans l’ensemble, l’incidence peut être assez similaire à celle d’autres maladies que nous avons pu définir plus précisément, comme
la cardiomyopathie hypertrophique (0,2%)12 ou le syndrome de Wolff-Parkinson-White (0,1% à 0,3%).13
L’incidence des artères coronaires anormales avec origine dans le mauvais sinus et des artères coronaires à vaisseau unique dans les études coronarographiques varie entre 0.28% et 1,74%.2,3,8,9,14-16 Compte tenu de leur importance clinique, nous allons concentrer notre examen sur ces anomalies.
PRESENTATIONS CLINIQUES
A l’origine, ces anomalies étaient diagnostiquées lors de coronarographies réalisées chez des patients atteints de valvulopathie ou de cardiopathie ischémique, et étaient considérées comme n’ayant aucune signification clinique. Plus tard, on a commencé à rapporter des cas de mort subite chez de jeunes athlètes chez qui le seul signe de maladie était une anomalie ayant son origine dans les artères coronaires.8,17
Le spectre clinique à la présentation est variable : alors que certains patients sont asymptomatiques, d’autres présentent une angine, une dyspnée, une syncope, un infarctus aigu du myocarde, une insuffisance cardiaque et une mort subite.1,2,5,8,17-20 Actuellement, les CAA sont considérés comme la deuxième cause la plus fréquente de mort subite chez les athlètes aux États-Unis.21
Cela signifie-t-il que tous les CAA doivent être considérés comme indiquant un risque élevé ? Absolument pas, mais d’un point de vue stratégique, ils doivent être considérés comme « potentiellement malins » jusqu’à ce que des tests supplémentaires soient effectués pour exclure une ischémie myocardique provoquée par l’anomalie.
La principale préoccupation consiste à déterminer quels sont les CAA qui peuvent présenter une mort subite. Aujourd’hui, nous savons que ceux qui suivent un parcours interartériel (ou intramural), ceux dans lesquels l’artère coronaire anomale est la dominante et ceux qui produisent des signes cliniques chez des patients de moins de 30 ou 35 ans sont ceux dans lesquels l’incidence de la mort subite est la plus élevée.22-26
Pour cette raison, notre approche d’un AAC doit différer selon l’âge du patient. Chez les personnes jeunes, de moins de 35 ans, nous nous » concentrerons » sur la prévention de la mort subite, alors que chez les personnes de plus de 35 ans, l’objectif majeur sera de traiter l’ischémie myocardique (figure 2).
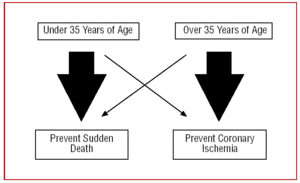
Figure 2. Approche différente selon l’âge du patient.
Occasionnellement, en raison de leur origine et de leur parcours anomal, les CAA peuvent être endommagés lors d’une chirurgie de remplacement valvulaire, mais cela peut également se produire lors de la fermeture percutanée du foramen ovale. Pour cette raison, la présence d’un CAA doit être exclue avant les interventions de ce type.27-30
PATHOPHYSIOLOGIE DE L’ISCHEMIE DANS LES ANOMALIES CORONAIRES
Il existe un certain nombre de théories31 pour expliquer les mécanismes qui produisent l’ischémie dans les CAA, mais aucune n’a été clairement démontrée. Dans l’une d’elles, la cause est considérée comme étant l’angulation marquée de l’artère anormale à l’endroit où elle émerge de l’aorte. Contrairement à une artère coronaire normale, qui est perpendiculaire à l’aorte à son origine, l’artère coronaire anormale doit se plier sur elle-même pour atteindre, à partir du sinus de Valsalva opposé, son territoire d’alimentation normal. De ce fait, l’ostium de l’artère coronaire anomale serait plus petit, avec des crêtes en forme de valve, par rapport à l’ostium circulaire normal, et pourrait être comprimé en cas d’expansion marquée de l’aorte, comme celle observée lors d’un exercice intense.32
Une autre théorie fait référence au parcours initial de l’AAC. Lorsqu’il est interartériel, entre l’aorte et l’artère pulmonaire, l’augmentation de la pression dans les 2 vaisseaux, survenant lors d’un effort, produirait une compression de l’artère coronaire anomale.33 De plus, si le trajet initial est intramural, l’obstruction peut être renforcée puisque l’artère coronaire peut se déformer à l’intérieur de la paroi aortique lors des périodes d’hypertension artérielle34.
Certains auteurs considèrent que le mécanisme conduisant à l’ischémie implique la production d’un spasme dans l’artère coronaire anomale suite aux dommages endothéliaux produits par le trajet anomal,35 et d’autres, qu’une intussusception de la partie proximale de l’AAC dans la paroi aortique serait produite31.
Enfin, tous les mécanismes discutés peuvent produire une ischémie aiguë ou chronique (événements ischémiques mineurs) qui provoque une fibrose myocardique qui, à son tour, pourrait être la cause de la génération d’arythmies létales.36
COMMENT DIAGNOSTIQUER UNE ANOMALIE CORONAIRE ?
Le diagnostic nécessite un indice de suspicion élevé et l’évaluation de sa présence dans certaines circonstances. Comme nous l’avons mentionné plus haut, la plupart des AAC sont découverts de manière fortuite lors de coronarographies réalisées chez des patients présentant une cardiopathie ischémique ou une valvulopathie subissant cette étude avant une chirurgie de remplacement valvulaire.
Les jeunes qui ne présentent aucun facteur de risque coronaire ou valvulopathie associée représentent le plus grand défi diagnostique. Nous devons suspecter un AAC en présence d’une syncope à l’effort, d’une dyspnée ou d’une douleur thoracique indiquant une angine.24,26,35 Évidemment, le premier test diagnostique que nous effectuons tous est l’ergométrie standard. Cependant, il ne s’est pas avéré très utile chez ce type de patients car il est généralement négatif, ce qui indique que l’ischémie due au CAA ne se présente qu’occasionnellement.35,36
Donc, étant donné que les tests « fonctionnels » ne sont pas d’une grande aide, nous devons opter pour une étude d’imagerie qui nous permet d’examiner l’anatomie coronaire. L’examen non invasif initialement recommandé est l’échocardiographie transthoracique (ETT).7,26,37-40 Chez la majorité de ces patients, la réalisation d’une ETT simple en projection parasternale d’axe court dans le plan de la racine aortique permet de distinguer les deux ostia coronaires et même de déterminer le trajet initial du CAA. Pellicia et al ont étudié 1360 sportifs de haut niveau par échocardiographie, visualisant l’ostium et la portion proximale de l’artère coronaire principale gauche dans 97% des cas et de l’artère coronaire principale droite dans 80% des cas.41
Récemment, Frommelt et al34 ont réalisé une échocardiographie chez tous les enfants et adolescents (tranche d’âge de 3 mois à 20 ans) envoyés dans leur hôpital (1997-2002) avec des symptômes d’ischémie myocardique, une suspicion de cardiopathie congénitale ou des douleurs musculo-squelettiques. Ils ont tous subi un ETT conventionnel avec l’aide d’une cartographie Doppler en couleur pour déterminer la direction du flux sanguin. Ils ont identifié 10 patients présentant une origine anormale d’une artère coronaire dans le mauvais sinus (6 patients avec une artère coronaire gauche provenant du sinus de Valsalva droit et 4 avec une artère coronaire droite provenant du sinus de Valsalva gauche). En utilisant l’ETT avec des techniques de Doppler couleur, ils ont observé un parcours intramural dans la paroi aortique chez neuf des patients et un parcours intramyocardique chez le patient restant. Lorsque le parcours d’un AAC provenant du mauvais sinus est intramural, il peut sembler émerger de son ostium normal. Ainsi, les auteurs recommandent l’utilisation du Doppler couleur pour déterminer la direction du flux lorsqu’il est nécessaire d’exclure la présence d’une anomalie.
Les améliorations des techniques d’imagerie échocardiographique nous permettent de déterminer l’origine et de suivre l’évolution initiale d’un AAC dans certains groupes de patients. Des études ont été réalisées chez les enfants, les adolescents et les athlètes d’élite, mais de grandes séries impliquant la population adulte normale doivent encore être étudiées. Ainsi, l’identification des ostia coronaires chez les jeunes patients présentant cette symptomatologie devrait être effectuée systématiquement lors de l’examen TTE.7,26
Chez les patients ayant une mauvaise fenêtre échocardiographique, ou lorsque le doute diagnostique persiste malgré les indications cliniques, pour permettre la visualisation de l’origine et du trajet initial de l’AAC, une échocardiographie transoesophagienne (ETO),7,26,42,43 une tomodensitométrie (TDM)26,44-46–avec faisceau d’électrons ou multislice–(figure 3) ou une imagerie par résonance magnétique cardiaque (IRMC)26,47,48 peuvent être réalisées (figure 4).

Figure 3. Image de tomographie multidétecteur montrant l’artère coronaire circonflexe (Cx) prenant naissance dans l’artère coronaire droite (CD), suivant un parcours rétroaortique pour arriver à son territoire de distribution normal. Ao indique l’aorte ; AP, l’artère pulmonaire. Courtoisie du Dr Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Espagne.
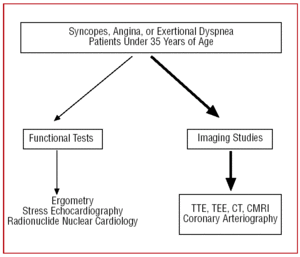
Figure 4. Protocole diagnostique proposé chez les patients de moins de 35 ans présentant une suspicion d’anomalie des artères coronaires. CMRI indique l’imagerie par résonance magnétique cardiaque ; CT, tomographie assistée par ordinateur ; TEE, échocardiographie transoesophagienne ; TTE, échocardiographie transthoracique.
Quelle technique utiliser et dans quel ordre ? Chaque équipe médicale doit répondre à cette question en fonction des techniques disponibles et de son expérience. Ce que nous devons faire, c’est identifier le CAA et son évolution initiale au moyen de la technique la moins invasive dont nous disposons. Bien que l’ETO ait été utilisée pour le diagnostic et l’identification de l’évolution initiale de certains AAC, nous considérons que, compte tenu de sa nature semi-invasive, elle ne devrait être utilisée qu’après l’échec des autres techniques. Aujourd’hui, en raison de la disponibilité croissante et des excellentes images tridimensionnelles qui peuvent être obtenues, il semblerait prudent d’opter pour le CT multidétecteur (Figure 5) ou pour l’IRMC.49,50 La coronarographie standard serait indiquée si les autres examens ne permettent pas d’obtenir un diagnostic définitif. À cet égard, la 36e conférence de Bethesda51 pour la sélection des athlètes de compétition présentant des anomalies cardiovasculaires, publiée en avril 2005, a recommandé ce qui suit : « Les anomalies coronaires doivent être envisagées chez les athlètes présentant une syncope d’effort ou une arythmie ventriculaire symptomatique et doivent être recherchées à l’aide d’études appropriées telles que l’échocardiographie, la CMR ou l’imagerie par tomodensitométrie ultrarapide. La coronarographie est indiquée si les autres études ne sont pas diagnostiques. » En bref, ils n’optent pas pour 1 étude diagnostique ou une autre.
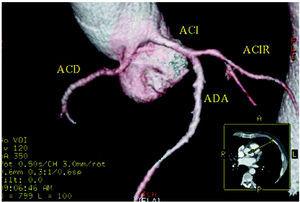
Figure 5. Tomographie informatisée multicoupe (16 tranches) ; reconstruction rendue tridimensionnelle montrant l’artère coronaire droite (ACI) prenant naissance dans le sinus de Valsalva gauche. ACI : artère coronaire gauche ; ACIR : artère coronaire circonflexe ; ADA : artère coronaire descendante antérieure. Avec l’aimable autorisation du Dr Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Espagne.
Chez les patients de plus de 35 ans qui présentent des signes cliniques d’angine de poitrine ou des syncopes répétées, après l’épreuve fonctionnelle (ergométrie, échocardiographie d’exercice, etc.), un cathétérisme est généralement réalisé car l’incidence plus élevée de l’athérosclérose fait suspecter une maladie coronarienne. Dans certains centres équipés de cette technologie, les patients présentant un tableau clinique atypique peuvent faire l’objet d’un dépistage initial par tomodensitométrie multidétecteur ou par CRMI. Dans l’une ou l’autre circonstance, le CAA serait une découverte (figure 6).
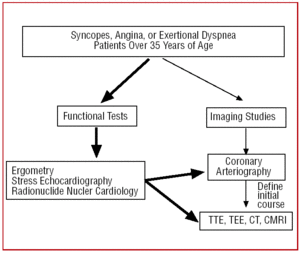
Figure 6. Protocole diagnostique proposé chez les patients de plus de 35 ans présentant une suspicion d’anomalie des artères coronaires. CRM indique l’imagerie par résonance magnétique cardiaque ; CT, tomographie assistée par ordinateur ; TEE, échocardiographie transoesophagienne ; TTE, échocardiographie transthoracique.
COMMENT EST IDENTIFIÉ LE COURANT INITIAL D’UNE ANOMALIE CORONAIRE ?
C’est l’un des points les plus complexes de l’étude de l’AAC et il constitue un aspect fondamental dans l’identification du risque.
Pour commencer, nous devons tenir compte du fait que le nom et la nature d’une artère coronaire sont définis par le territoire qu’elles alimentent, et non par leur origine. Ainsi, une coronaire qui naît du sinus de Valsalva droit et se ramifie pour alimenter les territoires des artères descendantes antérieures et circonflexes (Cx), ce n’est pas une coronaire droite mais une coronaire principale gauche dont l’origine est dans le mauvais sinus. Lorsqu’une artère coronaire naît du mauvais sinus, son nom, sa nature et même sa fonction restent les mêmes ; seuls son origine et son parcours initial sont anormaux.2
Après avoir émergé du mauvais sinus de Valsalva, une artère coronaire anormale peut atteindre son territoire d’alimentation normal par au moins cinq voies différentes2,52:
1. Rétrocardiaque, derrière les valves mitrale et tricuspide.
2. Rétroaortique, généralement suivie par la Cx dont l’origine se situe dans le sinus de Valsalva droit ou dans l’artère coronaire droite, adjacente à la paroi aortique postérieure, dans le sillon entre l’oreillette et l’aorte (sinus transverse) (figure 3).
3. préaortique ou interartérielle (entre l’aorte et l’artère pulmonaire), dans laquelle l’anomalie de la coronaire droite, de l’artère descendante antérieure gauche ou de l’artère coronaire principale gauche traverse le septum ou l’espace aorto-pulmonaire. C’est le parcours qui a été le plus fréquemment associé à des signes d’ischémie et/ou de mort subite (figures 7 et 8).
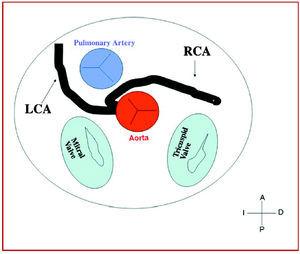
Figure 7. Diagramme montrant le trajet interartériel d’une artère coronaire droite (ACR) issue du sinus controlatéral.
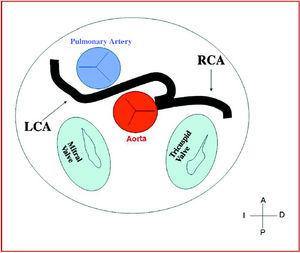
Figure 8. Schéma montrant le trajet interartériel d’une artère coronaire gauche (ACG) prenant naissance dans le sinus controlatéral.
4. Intraseptale, à travers la partie supérieure du septum intraventriculaire. Elle est intramyocardique dans la majorité des cas et est reconnue à l’angiographie en raison du rétrécissement systolique, semblable à un pont myocardique, et parce qu’il y a habituellement 1 ou 2 branches perforantes septales dans cette zone (figure 9).

Figure 9. Schéma montrant le parcours intraseptal d’une artère coronaire (IC) gauche prenant naissance dans le sinus de Valsalva droit.
5. Précardiaque ou prépulmonaire, caractérisée par sa localisation sous-épicardique, dans la paroi antérieure de la voie de sortie du ventricule droit ou infundibulum. Ce passage est généralement suivi d’une anomalie de la coronaire droite, du tronc principal gauche ou de l’artère coronaire descendante antérieure gauche.
D’autres parcours possibles, voire plusieurs parcours chez un même patient, ont été rapportés.2
Comment identifier ces parcours initiaux par la coronarographie ? Initialement, il était considéré que l’introduction d’un fil guide dans l’artère pulmonaire suivie d’une coronarographie en projection latérale serait suffisante pour déterminer les rapports entre l’anomalie et les gros vaisseaux. Cependant, cette technique est d’une valeur limitée car, par exemple, dans une vue latérale, les parcours septal et interartériel sembleraient être situés en arrière de l’artère pulmonaire et en avant de l’aorte alors qu’en réalité, le parcours septal est situé caudalement par rapport aux deux vaisseaux.53
Des caractéristiques coronarographiques différentes pour la reconnaissance de l’anomalie et de son parcours initial, même avant la visualisation, ont également été rapportées. A cet égard, Page et al54 proposent deux signes permettant de reconnaître une origine anormale de la Cx et son parcours initial :
1. Le signe du « myocarde non perfusé ». Lors de l’opacification sélective de l’artère coronaire gauche, nous pouvons observer une zone avasculaire dans la zone postéro-latérale du ventricule gauche qui indique l’origine anomale de la Cx. Il est d’abord nécessaire d’injecter un produit de contraste dans le sinus coronaire gauche pour exclure l’implication d’ostia indépendants des artères descendantes antérieures et de la Cx. Cependant, si l’identification de la Cx n’est pas claire, il faut se rappeler qu’il est plus fréquent d’observer la Cx prenant naissance dans le sinus coronaire droit ou dans l’artère coronaire droite que la présence d’ostia séparés dans le sinus coronaire gauche.55
2. le signe de la « racine aortique ». En ventriculographie, la projection oblique antérieure droite montre le contour du Cx anormal et suit son parcours en passant derrière le sinus coronaire droit (figure 10).
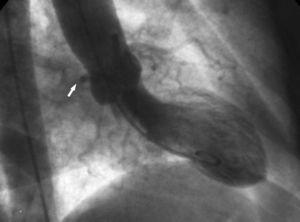
Figure 10. Ventriculographie en projection oblique antérieure droite montrant le contour de l’artère circonflexe anormale (flèche) passant derrière le sinus coronaire droit ; ceci est connu sous le nom de signe de la racine aortique ou signe de Page.
En 1985, Ishikawa et al,56 puis Serota et al en 1990,57 ont proposé une série de critères coronarographiques destinés à définir la relation, le long du parcours initial, entre le vaisseau anormal et l’aorte et l’artère pulmonaire (figure 11). Ces auteurs ont tenté d’identifier les différents parcours sur la base de l’orientation de la « boucle » formée par l’artère coronaire anomale avec le reste de l’arbre coronaire56 ou en appliquant le concept du « point » (visualisation de la colonne de contraste de l’AAC qui, en raison du virage qu’elle effectue, adopte la morphologie d’un point57).
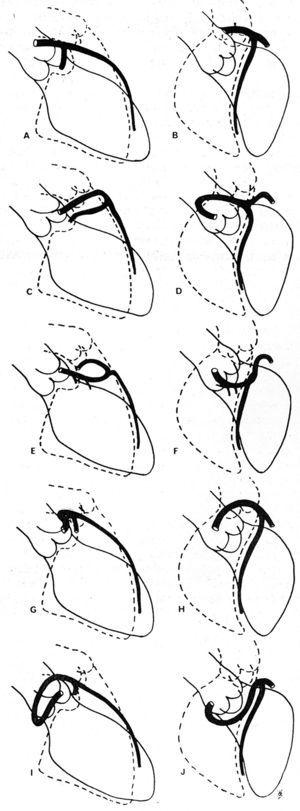
Figure 11. Illustrations d’images de coronarographieyc des artères coronaires descendantes antérieures gauches et circonflexes proximales en projection oblique antérieure droite (A, C, E, G, I) et en projection oblique antérieure gauche (B, D, F, H, J), montrant les différents parcours initiaux possibles d’une artère coronaire gauche issue du sinus de Valsalva droit. A et B représentent une artère coronaire normale ; C et D montrent une « boucle » antéro-crânienne, décrite dans le parcours antérieur ; E et F : « boucle » antéro-caudale, parcours septal ; G et H : « boucle » postéro-crânienne, parcours interartériel ; I et J : « boucle » postéro-caudale, parcours rétro-aortique. Tiré de Ishikawa et al.56
Dans de nombreux cas, l’identification du parcours initial de l’AAC au moyen de la coronarographie est difficile car cette technique fournit une vue bidimensionnelle de l’arbre coronaire, qui est une structure tridimensionnelle complexe. Pour un cardiologue interventionnel expérimenté dans le diagnostic du CAA, la coronarographie peut être suffisante pour identifier correctement le parcours. Cependant, étant donné leur faible incidence, la plupart des cardiologues interventionnels ont une expérience limitée dans l’étude des CAA. Ainsi, dans la grande majorité des cas, ils ne sont pas correctement décrits. Dans un registre récent impliquant 13 hôpitaux espagnols, le parcours initial du CAA signalé n’était pas identifié dans la majorité des cas.16
Donc, à de nombreuses occasions, l’identification du parcours initial d’un CAA ayant pour origine le mauvais sinus nécessite une technique d’imagerie supplémentaire. Comme nous l’avons mentionné plus haut, l’ETT et l’ETO peuvent tous deux être employés à cette fin mais, étant donné la disponibilité croissante dans nos hôpitaux de techniques non invasives qui fournissent une définition plus correcte et plus exacte de l’anatomie coronaire et de sa relation avec les structures adjacentes chez les patients qui peuvent être candidats à la chirurgie, nous optons pour l’IRMC ou le CT multidétecteur35,37,47,49.
Quelle est la meilleure approche thérapeutique ?
C’est l’un des aspects les plus controversés de cette affection car aucune directive officielle n’a été établie à cet égard.
Une fois que le CAA a été diagnostiqué et caractérisé, il semblerait logique de tenter de déterminer s’il provoque ou non une ischémie myocardique. Si le patient a eu un infarctus du myocarde (sans relation démontrable avec l’athérosclérose) ou a subi une réanimation pour une mort subite attribuable à l’anomalie et est âgé de moins de 35 ans, la plupart des auteurs recommandent une revascularisation24,26,35.
Une épreuve d’effort au thallium ou une échocardiographie sous stress médicamenteux ou à l’effort démontrant une ischémie réversible dans le territoire de l’anomalie aidera à la prise de décision.36
Que faire dans le cas de personnes jeunes et asymptomatiques chez qui l’AAC est découvert fortuitement si les critères de risque sont remplis, mais que l’épreuve d’effort ne produit aucune preuve d’ischémie ? Tout d’abord, le patient doit adopter un mode de vie sédentaire.26,35
Corrado et al ont comparé la mort subite chez de jeunes athlètes et non athlètes et seules celles attribuées au CAA ou à la dysplasie ventriculaire droite arythmogène étaient associées à l’effort.58 En ce qui concerne le traitement, la revascularisation est controversée, mais certains auteurs optent pour cette approche car, chez ces patients, la mort subite est imprévisible et peut être le premier signe du CAA.24,26,34,35 Certains auteurs soutiennent des visites de suivi annuelles dans ces cas, avec des échocardiogrammes ou des tests d’effort au thallium, et fondent leurs décisions sur les résultats.7,36 Après le traitement chirurgical, les patients jouissent d’un style de vie normal, y compris la participation à des sports.25,34,49
Chez les patients de plus de 35 ans, les décisions doivent être prises sur une base individuelle. Le risque de mort subite est plus faible mais, comme l’AAC peut provoquer une ischémie myocardique symptomatique, dans certains cas, une revascularisation est effectuée (figure 12).24,26
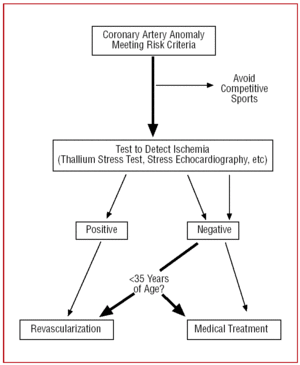
Figure 12. Protocole thérapeutique proposé pour les anomalies coronaires ayant pour origine le sinus de Valsalva controlatéral en présence de facteurs de risque.
Certains groupes étudient l’utilisation de certains protocoles diagnostiques (échocardiographie intracoronaire pour évaluer l’ostium coronaire anormal au repos et après perfusion de dobutamine ou surcharge liquidienne)59 ou l’utilisation de fils de pression intracoronaires pour détecter l’ischémie60.
Comme on peut l’observer, jusqu’à ce que des directives officielles soient établies en la matière, l’approche la plus raisonnable semble être, premièrement, de confirmer si l’âge du patient et l’anatomie de l’AAC sont associés à un risque et, deuxièmement, de vérifier que l’ischémie coronaire (présentée par le patient ou démontrée) est clairement provoquée par l’anomalie.
COMMENT LA REVASCULARISATION DOIT-ELLE ÊTRE EFFECTUÉE ?
Logiquement, il est nécessaire de traiter chaque cas de manière individuelle en fonction de l’anatomie coronaire ; ainsi, la revascularisation peut être chirurgicale ou percutanée.
La revascularisation chirurgicale implique un pontage aorto-coronaire, une réimplantation ostiale ou la technique de démaillage, qui libère le segment intramural du CAA au moyen d’une incision dans la paroi partagée par le CAA et l’aorte, créant ainsi un nouvel orifice plus large dans le sinus approprié61,62. La revascularisation chirurgicale chez ces patients, en particulier chez les jeunes, fait l’objet d’une grande controverse. Le pontage aorto-coronarien a été fortement critiqué7,63 en raison de sa perméabilité « limitée » et de l’inévitable concurrence de flux entre le pontage et l’AAC. Ainsi, la technique d’unroofing, qui semblerait plus physiologique,62 est de plus en plus adoptée.
Une intervention percutanée, avec implantation de stents dans la région de la compression entre les gros vaisseaux et dans l’ostium anomal, a été réalisée dans plusieurs cas, chez l’adulte, avec un succès à court terme64. A ce jour, la revascularisation chirurgicale est préférée chez les jeunes patients et l’intervention percutanée n’est réalisée que chez les adultes.26,62-64 De toute évidence, dans les deux cas, un suivi à long terme est nécessaire.
LE TRAITEMENT MÉDICAL EST-IL UNE OPTION ?
Le manque de séries et d’études contrôlées rend difficile la réponse à cette question. Il existe des rapports portant sur le suivi à 2 ans et à 5 ans de patients qui ou qui ont refusé la chirurgie, chez qui l’approche était soit la gestion de l’attente, soit le traitement avec des bêta-bloquants, et parmi lesquels il n’y a pas eu de cas de mort subite.65-68 Cependant, certains auteurs s’opposent à la décision d’initier un traitement « à vie » chez les enfants et les adolescents.7
PROBLÈMES MAJEURS NON RÉSOLUS
Le véritable risque de mort subite associé à chaque anomalie est inconnu.5 La raison en est que le risque est calculé sur la base d’études d’autopsie, qui n’indiquent pas le risque réel de décès d’une personne à la suite d’une AAC, mais suggèrent la possibilité qu’une personne ayant connu une mort subite soit atteinte d’une AAC7. De plus, les risques calculés peuvent être surestimés par rapport à la population générale puisqu’ils sont obtenus à partir de séries d’athlètes de compétition qui, comme cela a été rapporté, ont un risque de mort subite deux fois plus élevé qu’une personne sédentaire.69 Nous savons que le risque de mort subite due à un AAC est plus élevé chez les jeunes ; en fait, une approche thérapeutique ou une autre est recommandée selon que le patient a moins de 30 ou 35 ans. Ces seuils sont basés sur les quelques études traitant de cette question23,25 et doivent donc être considérés comme purement indicatifs. Pour cette raison, l’approche thérapeutique doit toujours être décidée sur une base individuelle.
Si la solution chirurgicale décrite ci-dessus est adoptée, il faut tenir compte du fait qu’il n’existe aucune série dans laquelle l’évolution des patients a été étudiée pendant plus de deux ans. A l’incertitude concernant la perméabilité de la dérivation s’ajoute l’endommagement possible de la valve aortique que peut produire la procédure d’ouverture du toit. A cet égard, il existe des rapports d’insuffisance aortique ou même de remplacement valvulaire suite à cette intervention.7,70 Il faut rappeler que la chirurgie cardiaque comporte toujours un risque de complications neurologiques, dont l’incidence chez les jeunes a été estimée à environ 2,3%.71
Enfin, les directives pour la sélection des athlètes de compétition présentant des anomalies cardiovasculaires recommandent l’exclusion des patients atteints d’AAC de tous les sports de compétition.51 Une fois de plus, les données d’une population d’athlètes ont été extrapolées à la population générale. Chez un adolescent, le terme « compétition » peut être difficile à définir. De plus, interdire à un adolescent ou à un jeune adulte de participer à des cours de gym ou au sport qu’il apprécie peut causer plus de dommages que de bénéfices. Peut-être faut-il éviter les sports épuisants, mais pas un sport moins exigeant.7
CONCLUSION
Les artères coronaires provenant du mauvais sinus de Valsalva constituent le groupe d’AAC le plus fréquemment associé à l’ischémie myocardique et, en particulier, à la mort subite.
L’indice de suspicion de cette anomalie doit être élevé chez les jeunes patients présentant des signes cliniques d’angine, de dyspnée ou de syncope d’effort. Dans ces cas, un ETT doit être réalisé pour tenter d’identifier les ostia et le trajet initial des deux artères coronaires.
Nous devons clairement définir le trajet initial de chaque artère coronaire anormale, en utilisant des techniques d’imagerie telles que l’ETT, l’ETO ou, de préférence, le CT multidétecteur ou l’IRMC, selon les caractéristiques de notre hôpital.
Nous devons donner la priorité à l’établissement de registres nationaux et internationaux qui nous permettent de déterminer l’incidence de ces anomalies, ainsi que les taux de morbidité et de mortalité associés, le pronostic, le traitement, les éventuelles influences génétiques ou environnementales et, en bref, d’en apprendre le plus possible.
Il est nécessaire d’effectuer un suivi à long terme des patients qui ont subi une intervention chirurgicale pour un AAC, en particulier les jeunes. Dans tous les cas, la revascularisation (chirurgicale ou percutanée) peut être valable pour les patients atteints de ce type de maladie.
ACCUEILS
Nous remercions le Dr Joaquín Alonso et le Dr Gabriel C. Fernández pour leur aide dans l’obtention des images de tomodensitométrie multidétecteur.