Un « minéral » est une substance inorganique qui est composée d’un ou plusieurs éléments chimiques. Par définition, un minéral doit être :
La composition chimique d’un minéral est connue comme sa composition élémentaire. La plupart des minéraux se présentent sous forme de composés (une combinaison de plusieurs éléments différents). Cependant, certains minéraux se présentent comme des éléments chimiques à part entière. Ils sont connus sous le nom de minéraux natifs.
Que sont les cristaux?
Les cristaux sont une substance solide qui possède une structure cristalline organisée formée d’atomes. L’arrangement interne des atomes résulte souvent en des faces planes externes comme celles que l’on voit sur un cristal de quartz, cependant ce n’est pas une exigence pour être classé comme un cristal. Les cristaux peuvent être classés différemment des minéraux, car certains matériaux peuvent être considérés comme des cristaux organiques. Les minéraux étant purement inorganiques, un cristal organique ne peut être un minéral. Par exemple, les protéines et les sucres sont des solides qui peuvent former des cristaux, cependant, comme ce sont des substances organiques, ils ne peuvent pas être classés comme des minéraux.

Les impuretés au sein des solutions qui forment des cristaux peuvent entraîner des changements de couleur ainsi que des modifications importantes de la structure cristalline. Un trop grand nombre d’impuretés dans un réseau cristallin pendant la cristallisation peut produire des cristaux avec des inclusions de petite à grande taille. Ces inclusions peuvent également altérer la forme du cristal.
Minéraux, cristaux ou roches?
La plupart des minéraux se présenteront naturellement sous forme de cristaux, cependant tous les cristaux ne sont pas des minéraux puisque les cristaux organiques ne sont pas du tout des minéraux. Un minéral ayant la même formule chimique peut former plus d’un type de cristal. Par exemple, il existe trois polymorphes (même formule chimique, structures cristallines différentes) du carbonate de calcium, connus sous le nom de calcite, aragonite et vaterite. Les cristaux de calcite se présentent dans le système trigonal, les cristaux d’aragonite appartiennent au système orthorhombique et les cristaux de vatérite se forment dans le système hexagonal. Ces structures cristallines peuvent varier pendant la formation en raison de plusieurs facteurs qui incluent les impuretés inhibant les modèles de croissance, la température de l’environnement pendant la formation, la saturation des minéraux dans la solution, la géométrie des liaisons covalentes et les changements de mouvement de la solution.
Les minéraux ont une structure atomique organisée, formée naturellement, avec une composition chimique spécifique. Les cristaux pour la plupart partageront ces caractéristiques, cependant les atomes sont disposés dans un modèle répétitif qui résulte en un réseau cristallin, se présentant souvent avec des faces cristallines.
Plusieurs fois vous entendrez des gens appeler les minéraux ou les cristaux, des roches, cependant une « roche » est définie comme un agrégat lié de minéraux, de minéraloïdes ou de fragments d’autres roches. Le mot « lié » signifie que l’agrégat de minéraux doit être en quelque sorte cimenté. Par exemple, le sable n’est pas considéré comme une roche même si, dans la plupart des cas, les grains de sable sont agrégés ensemble. Le grès par exemple est devenu une roche parce que les grains de sable ont été cimentés ensemble par des minéraux à grains plus fins et/ou des matières organiques, formant une masse relativement solide.
Les trois grandes classifications de roches sont les roches ignées, métamorphiques et sédimentaires.
Roche ignée – Roche qui s’est formée par le refroidissement et la cristallisation d’un magma à l’intérieur ou au-dessus de la lithosphère (croûte terrestre). Des cristaux se forment au sein du magma lorsqu’il commence à se solidifier, dont la vitesse de refroidissement peut dicter la taille des cristaux qui se forment.

Vue rapprochée d’un granite porphyrique, un type de roche ignée. Le granite porphyrique se produit lorsque la température du refroidissement du magma change rapidement. Dans ce cas, on a laissé de grands cristaux se former avec un refroidissement lent, pour ensuite être interrompu par un changement de température décroissant soudain qui a accéléré le processus de cristallisation, ce qui a donné lieu à des cristaux plus petits.
Roche sédimentaire – Roche qui s’est formée à la suite de l’érosion de matériaux provenant de roches formées antérieurement et déposés le long des fonds océaniques, des lits de rivières, des lits de lacs, etc. ainsi que du dépôt de minéraux provenant de l’eau. Au fil des années, ces dépôts sont compactés par des forces naturelles, pour se solidifier plus tard en une masse solide (roche).

C’est une formation rocheuse sédimentaire qui fait partie de Zabriskie Point, situé dans la Vallée de la Mort, en Californie. Elle est composée de sédiments provenant du lac Furnace Creek qui s’est asséché il y a environ 5 millions d’années. Des millions d’années d’érosion ont laissé les couches de sédiments exposées.
Roche métamorphique – Roche qui s’est produite lorsque la roche sédimentaire ou ignée existante a été exposée à des pressions et, dans certains cas, à des changements de température qui ont modifié leur minéralogie d’origine.

Roche métamorphique dite « gneiss granitique ». Formée à partir de granite métamorphosé.
Comment se forment les cristaux inorganiques ?
Les cristaux peuvent se former à partir d’une variété de processus différents, notamment :
Dépôts d’évaporites – Ce sont des formations minérales qui se produisent à la suite de processus à la surface de la terre. Les cristaux se forment à partir de solutions contenant des minéraux qui se concentrent par déshydratation/évaporation d’une solution aqueuse. À mesure que le liquide est lentement éliminé par évaporation, les minéraux concentrés se rassemblent et précipitent de l’eau en un motif structuré qui se développe en un cristal. Un exemple de dépôt par précipitation est constitué par les cristaux de halite rose du lac Seamless à Trona, en Californie.
Gisements de minéraux secondaires – Ils se forment par le processus d’exposition de l’eau aux minerais primaires, par dépôt de solutions hydrothermales ou sont formés par la cristallisation du magma.
- Exposition aux minerais primaires – L’eau qui est introduite dans les minerais exposés (généralement à l’intérieur d’une cavité) par percolation descendante à travers les roches. Cela peut amorcer des processus chimiques qui décomposent le minerai et redistribuent les minéraux le long des parois ouvertes de la cavité. L’azurite et la malachite en sont de bons exemples, où des solutions aqueuses ont traversé des zones de minerai de cuivre primaire et les ont redistribuées sous forme de cristaux d’azurite et de malachite dont les conditions de formation comprennent de l’eau, des carbonates et du cuivre.
- Dépôt de fluide hydrothermal – dans la plupart des cas, se produit lorsque les fluides hydrothermaux se frayent un chemin vers le haut à travers la roche, ramassant les minéraux au sein de la roche environnante dans le processus. Lorsqu’une cavité ouverte est présentée à ces fluides, la précipitation des minéraux peut se produire sous la forme de cristaux et/ou d’une masse solide. Parfois, les minéraux au sein de la roche environnante peuvent être remplacés, cette occurrence est connue comme un dépôt de remplacement.
- Cristallisation du magma – se produit lorsque le magma refroidit et que les minéraux au sein du magma commencent à se séparer en groupes de minéraux semblables et compatibles. Selon la vitesse de refroidissement, la composition et l’atmosphère, les tailles des cristaux peuvent varier de manière significative. Parfois, le refroidissement est trop rapide, ce qui entraîne l’absence de structure élémentaire. L’obsidienne (verre volcanique) en est un exemple. Principalement composée de SiO₂ (quartz dans la plupart des cas), l’obsidienne a une formule chimique avec le potentiel d’être un cristal/minéral, cependant le manque de structure cristalline et la variabilité de la composition entraîne sa classification comme un minéraloïde à la place.

Le minéraloïde, l’obsidienne.
Classes minérales
La composition chimique du minéral dicte comment il se produira dans la nature. Certaines des classes minérales communes par leurs compositions chimiques sont:
Minéraux natifs – Éléments qui se produisent naturellement avec une structure minérale distincte et sans combinaison avec un autre élément. Quelques exemples d’éléments connus pour se former en tant que minéraux natifs sont l’or (Au), l’argent (Ag), le soufre (S), le cuivre (Cu), le graphite ((C) – carbone lâchement emballé) et les diamants ((C) – carbone densément emballé – contient généralement quelques impuretés).

Diamant naturel brut

Argent natif

Cuivre natif
Oxydes – Classe de composés chimiques dans lesquels un ion oxygène (O2-) se couple avec un élément, dans de nombreux cas un métal chargé positivement. Quelques exemples de ceci sont SiO₂ – Quartz, Fe₂O₃ – Hématite, Cu₂O – Cuprite, etc.
Carbonates – Minéraux caractérisés par la présence d’un ion carbonate (CO₃2-). Il se lie généralement à des cations métalliques qui, dans la plupart des cas, forment des composés insolubles (ne peuvent être dissous dans l’eau). Quelques exemples sont CaCO₃ – Calcite/Aragonite, FeCO₃ – Sidérite, ZnCO₃ – Smithsonite, etc.
Silicates – Minéraux d’une famille d’anions qui contiennent à la fois du silicium (Si) et de l’oxygène (O). Ces sels constituent un composant majeur des roches de toute la lithosphère (croûte terrestre). Quelques exemples de silicates sont SiO₂ – Quartz, AlKO₆Si₂ – Silicate d’aluminium de potassium, (Fe,Mg)₂SiO₄ – Olivine, etc.
Sulfure (Sulphide) – Anion inorganique du soufre qui présente la formule chimique S^2- et peut impliquer des réactions considérées comme assez complexes. La précipitation des sulfures peut inclure des réactions avec des métaux lourds dans lesquelles des précipités de métaux insolubles sont formés. Quelques exemples de ces métaux lourds qui se forment à partir des ions sulfures sont FeS₂ – Pyrite, CuFeS₂ – Chalcopyrite, PbS – Galène, etc.
Sulfates (Sulphates) – Sels qui se forment lorsque l’acide sulfurique (H₂SO₄) réagit avec un autre produit chimique. Quelques exemples de sulfates sont (Ba,Sr)SO₄ – Barite (Baryte), CaSO₄- 2H₂O – Gypse, SrSO₄ – Célestine (Celestite), etc.
Phosphates – Minéraux caractérisés par leur présence de l’anion complexe (PO₄)^3-., dont la plupart sont considérés comme assez rares dans la nature. Quelques exemples de phosphates sont Ca5(PO₄)(OH,F,CL) – Apatite, CuAl₆(PO₄)₄(OH)₈ – 4H₂O – Turquoise, Fe(II)3(PO4)₂- 8H2O – Vivianite, etc.
Économie des cristaux et des minéraux
À l’époque moderne, pour qu’un minéral soit considéré comme valant économiquement la peine d’être exploité, il doit exister comme une concentration de minéraux utiles qui peuvent être travaillés (exploités) tout en obtenant un profit. La concentration doit également être suffisamment élevée pour que l’extraction soit un processus valable. Parfois, l’épuisement du minerai dans la mine peut entraîner la fermeture immédiate de celle-ci. Pour cette raison, l’exploitation minière peut être une activité très risquée sur le plan économique.
Les métaux sont actuellement les minéraux économiques les plus importants, car ils sont utilisés pour une grande variété d’applications modernes. Ces métaux sont extraits de gisements métallifères qui se composent du minerai (minéraux recherchés) et, dans la plupart des cas, des minéraux environnants indésirables, moins économiques, appelés « gangue ».
Terminologie et illustrations
Elément chimique – Un élément chimique est une substance de la matière dont les atomes contiennent tous le même nombre de protons, appelé numéro atomique. Le tableau périodique est en quelque sorte une clé mise au point par Dimitri Mendeleïev, un chimiste russe, pour classer ces atomes en catégories d’éléments en fonction de leur nombre de protons. Par exemple, un atome d’hydrogène (H) contient un proton, un atome d’hélium (He) contient deux protons, un atome de lithium (Li) contient trois protons et ainsi de suite.
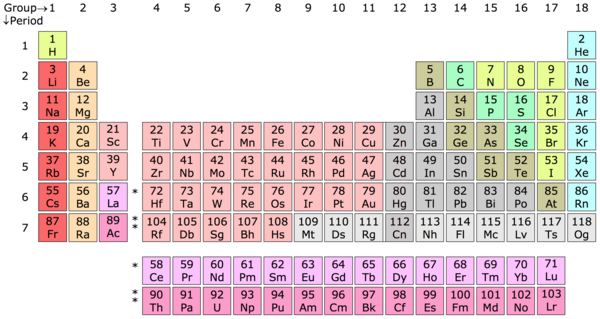
Tableau périodique
Composé chimique – Constitué de molécules. Pour être considérée comme un composé chimique, la molécule doit être composée d’un maximum de deux éléments chimiques plus différents qui sont liés entre eux.
Atome – La plus petite unité d’un élément chimique. Un atome est composé de proton(s), d’électron(s) et de neutron(s) qui déterminent ensemble la charge de l’atome. Les atomes peuvent perdre ou gagner des électrons, ce qui donne lieu à des charges positives et négatives appelées ions.
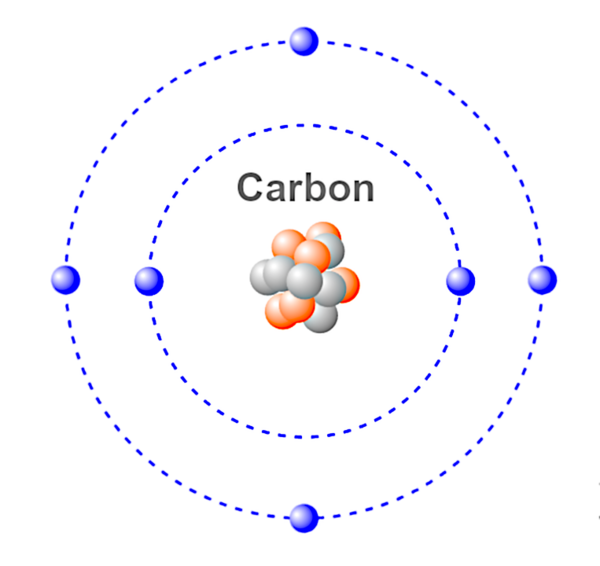
Ceci est une illustration d’un atome de carbone.
Bleu – Electrons.
Rouge &Gris – Neutrons &Protons.
Ion – Atome ou molécule ayant une charge électrique résultant de la perte ou du gain d’un ou plusieurs électrons.
Cation – Un ion chargé positivement qui est attiré par des ions chargés négativement. Exemple – L’ion hydrogène H+.
Anion – Un ion chargé négativement qui est attiré par des ions chargés positivement. Exemple – L’ion carbonate est CO₃2-.

Formule chimique de l’ion carbonate.
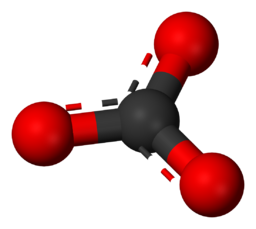
Cette image illustre la structure moléculaire de l’ion carbonate (CO₃2-) au niveau atomique.