Objectifs d’apprentissage
- Etendre les concepts d’équilibre précédemment introduits aux acides et aux bases qui peuvent donner ou accepter plus d’un proton
Nous pouvons également utiliser les forces relatives des paires acide-base conjuguées pour comprendre les propriétés acide-base des solutions de sels. Une réaction de neutralisation peut être définie comme la réaction d’un acide et d’une base pour produire un sel et de l’eau. C’est-à-dire qu’un autre cation, tel que \(Na^+\), remplace le proton de l’acide. Un exemple est la réaction de \(\ce{CH3CO2H}\), un acide faible, avec \(\ce{NaOH}\), une base forte:
\
Selon les propriétés acide-base des ions qui le composent, un sel peut toutefois se dissoudre dans l’eau pour produire une solution neutre, une solution basique ou une solution acide.
Lorsqu’un sel tel que le \(NaCl\) se dissout dans l’eau, il produit des ions \(Na^+_{(aq)}\) et \(Cl^-_{(aq)}\). En utilisant une approche de Lewis, l’ion \(Na^+\) peut être considéré comme un acide car il est un accepteur de paires d’électrons, bien que sa faible charge et son rayon relativement important en fassent un acide très faible. L’ion \(Cl^-\) est la base conjuguée de l’acide fort \(HCl\), il n’a donc essentiellement aucun caractère basique. Par conséquent, la dissolution du \(NaCl\) dans l’eau n’a aucun effet sur le \(pH\) d’une solution, et la solution reste neutre.
Comparons maintenant ce comportement à celui des solutions aqueuses de cyanure de potassium et d’acétate de sodium. Encore une fois, les cations (\(K^+\) et \(Na^+\)) n’ont essentiellement aucun caractère acide, mais les anions (\(CN^-\) et \(CH_3CO_2^-\)) sont des bases faibles qui peuvent réagir avec l’eau parce qu’ils sont les bases conjuguées des acides faibles \(HCN\) et de l’acide acétique, respectivement.
\
\
Aucune des deux réactions ne se déroule très loin vers la droite comme écrit parce que la formation de la paire acide-base la plus faible est favorisée. Le \(HCN\) et l’acide acétique sont des acides plus forts que l’eau, et l’hydroxyde est une base plus forte que l’acétate ou le cyanure, donc dans les deux cas, l’équilibre se trouve à gauche. Néanmoins, chacune de ces réactions génère suffisamment d’ions hydroxyde pour produire une solution basique. Par exemple, le \(pH\) d’une solution 0,1 M d’acétate de sodium ou de cyanure de potassium à 25°C est de 8,8 ou 11,1, respectivement. D’après les tableaux E1 et E2, nous pouvons voir que le \(CN^-\) est une base plus forte (\(pK_b = 4,79\)) que l’acétate (\(pK_b = 9,24\)), ce qui est cohérent avec le fait que le \(KCN\) produit une solution plus basique que l’acétate de sodium à la même concentration.
A l’inverse, l’acide conjugué d’une base faible devrait être un acide faible. Par exemple, le chlorure d’ammonium et le chlorure de pyridinium sont des sels produits par la réaction de l’ammoniac et de la pyridine, respectivement, avec le \(HCl\). Comme vous le savez déjà, l’ion chlorure est une base tellement faible qu’il ne réagit pas avec l’eau. En revanche, les cations des deux sels sont des acides faibles qui réagissent avec l’eau de la manière suivante :
\
\
La figure \(\PageIndex{2}\) montre que \(H_3O^+\) est un acide plus fort que \(NH_4^+\) ou \(C_5H_5NH^+\), et inversement, l’ammoniac et la pyridine sont tous deux des bases plus fortes que l’eau. L’équilibre se situe donc loin vers la gauche dans les deux cas, favorisant le couple acide-base le plus faible. La concentration en \(H_3O^+\) produite par les réactions est cependant suffisamment importante pour diminuer de façon significative le \(pH\) de la solution : le \(pH\) d’une solution 0,10 M de chlorure d’ammonium ou de chlorure de pyridinium à 25°C est respectivement de 5,13 ou 3,12.
Que se passe-t-il avec les solutions aqueuses d’un sel tel que l’acétate d’ammonium, dont le cation et l’anion peuvent réagir séparément avec l’eau pour produire respectivement un acide et une base ? D’après la figure 16.10, l’ion ammonium abaisse le \(pH\), tandis que d’après la figure 16.9, l’ion acétate élève le \(pH\). Ce cas particulier est inhabituel, car le cation est un acide aussi fort que l’anion est une base (pKa ≈ pKb). Par conséquent, les deux effets s’annulent, et la solution reste neutre. Avec les sels dans lesquels le cation est un acide plus fort que l’anion est une base, la solution finale a un \(pH\) < 7,00. Inversement, si le cation est un acide plus faible que l’anion est une base, la solution finale a un \(pH\) > 7,00.
Ions métalliques acides
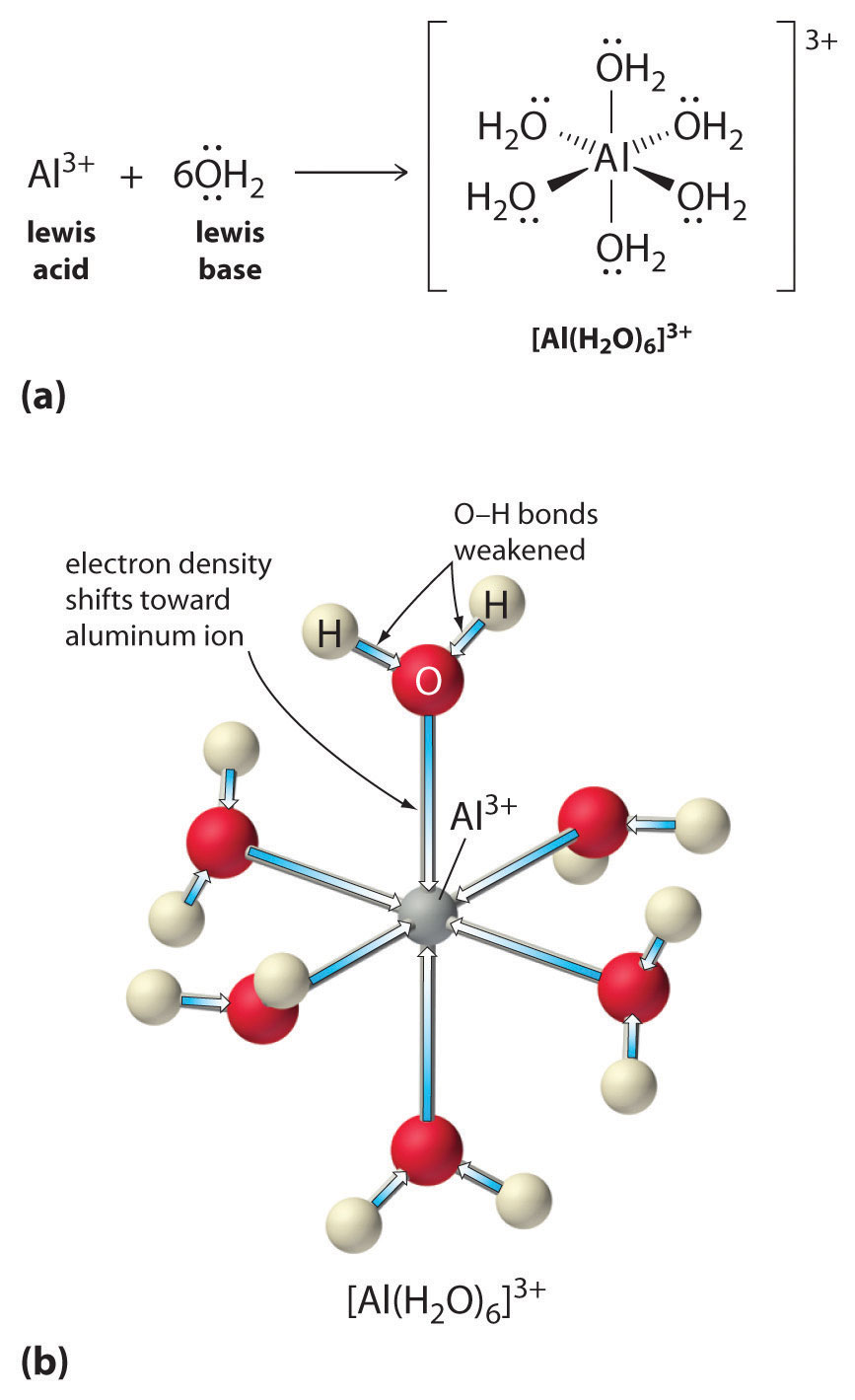
Les solutions de sels simples d’ions métalliques peuvent également être acides, même si un ion métallique ne peut pas donner un proton directement à l’eau pour produire \(H_3O^+\). En revanche, un ion métallique peut agir comme un acide de Lewis et interagir avec l’eau, une base de Lewis, en se coordonnant à une paire d’électrons solitaires sur l’atome d’oxygène pour former un ion métallique hydraté (figure \(\PageIndex{1a}\)). Une molécule d’eau coordonnée à un ion métallique est plus acide qu’une molécule d’eau libre pour deux raisons. Premièrement, les interactions électrostatiques répulsives entre l’ion métallique chargé positivement et les atomes d’hydrogène partiellement chargés positivement de la molécule d’eau coordonnée permettent à cette dernière de perdre plus facilement un proton.
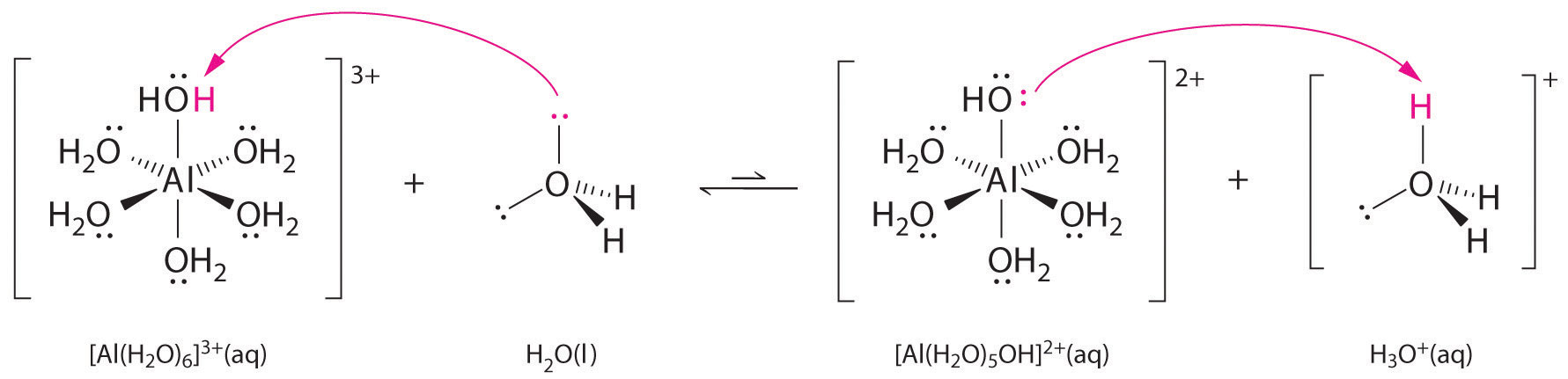
Deuxièmement, la charge positive de l’ion \(Al^{3+}\) attire la densité électronique des atomes d’oxygène des molécules d’eau, ce qui diminue la densité électronique dans les liaisons \(\ce{O-H}\), comme le montre la figure \(\PageIndex{1b}\). Avec une densité électronique moindre entre les atomes \(O\) et les atomes H, les liaisons \(\ce{O-H}\) sont plus faibles que dans une molécule \(H_2O\) libre, ce qui facilite la perte d’un ion \(H^+\).
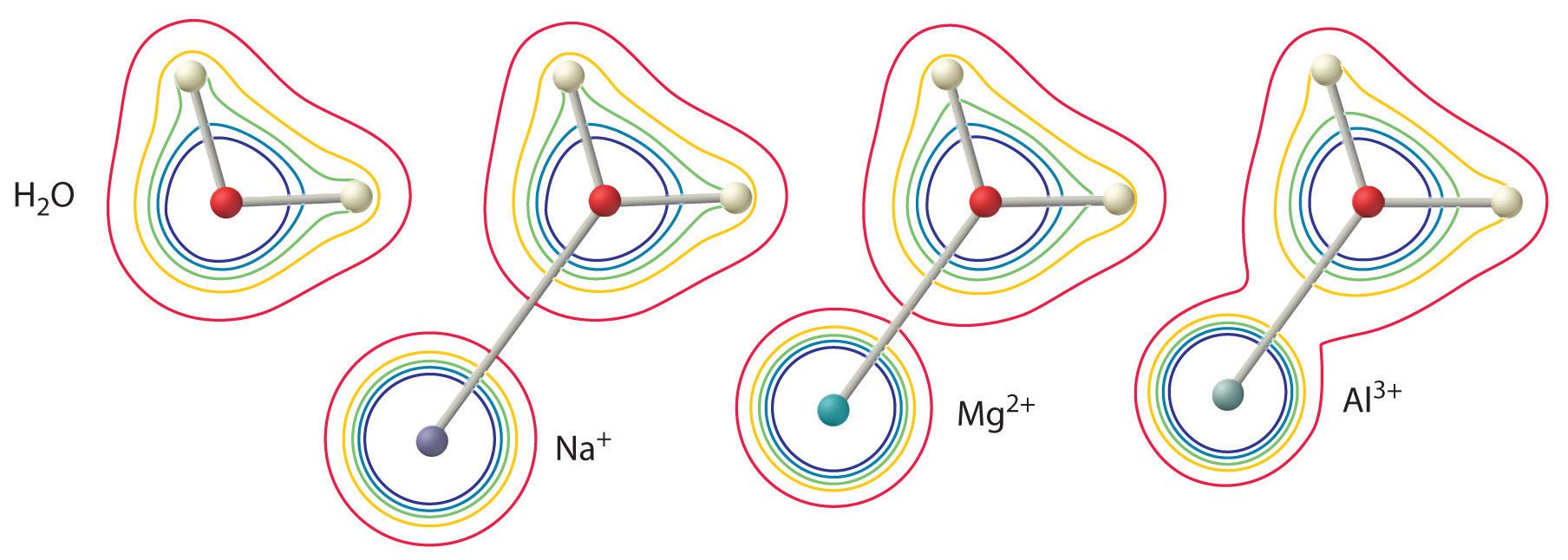
L’ampleur de cet effet dépend des deux facteurs suivants (Figure \(\PageIndex{3}\)):
- La charge de l’ion métallique. Un ion divalent (\(M^{2+}\)) a un effet environ deux fois plus fort sur la densité électronique dans une molécule d’eau coordonnée qu’un ion monovalent (\(M^+\)) de même rayon.
- Le rayon de l’ion métallique. Pour les ions métalliques de même charge, plus l’ion est petit, plus la distance internucléaire avec l’atome d’oxygène de la molécule d’eau est courte et plus l’effet du métal sur la distribution de la densité électronique dans la molécule d’eau est important.
Ainsi, les solutions aqueuses de petits ions métalliques hautement chargés, tels que \(Al^{3+}\) et \(Fe^{3+}\), sont acides:
\^^{3+}_{(aq)}. \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}]
L’ion \(^{3+}\) a un \(pK_a\) de 5,0, ce qui en fait un acide presque aussi fort que l’acide acétique. En raison des deux facteurs décrits précédemment, le paramètre le plus important pour prédire l’effet d’un ion métallique sur l’acidité des molécules d’eau coordonnées est le rapport charge/rayon de l’ion métallique. Un certain nombre de paires d’ions métalliques situées sur une ligne diagonale du tableau périodique, telles que \(Li^+\) et \(Mg^{2+}\) ou \(Ca^{2+}\) et \(Y^{3+}\), ont des tailles et des charges différentes, mais des rapports charge/rayon similaires. Par conséquent, ces paires d’ions métalliques ont des effets similaires sur l’acidité des molécules d’eau coordonnées, et ils présentent souvent d’autres similitudes significatives en chimie également.
Ions métalliques acides
Les solutions de petits ions métalliques très chargés dans l’eau sont acides.
Les réactions telles que celles discutées dans cette section, dans lesquelles un sel réagit avec l’eau pour donner une solution acide ou basique, sont souvent appelées réactions d’hydrolyse. L’utilisation d’un nom distinct pour ce type de réaction est malheureuse car elle suggère qu’elles sont en quelque sorte différentes. En fait, les réactions d’hydrolyse ne sont que des réactions acide-base dans lesquelles l’acide est un cation ou la base un anion ; elles obéissent aux mêmes principes et règles que toutes les autres réactions acide-base.
Hydrolyse
Une réaction d’hydrolyse est une réaction acide-base.
Exemple \(\PageIndex{1}\)
Prédisez si les solutions aqueuses de ces composés sont acides, basiques ou neutres.
- \(KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Donné : composé
Demandé : Acidité ou basicité de la solution aqueuse
Stratégie:
- Évaluer les propriétés acido-basiques du cation et de l’anion. Si le cation est un acide de Lewis faible, il n’affectera pas le \(pH\) de la solution. Si le cation est l’acide conjugué d’une base faible ou d’un cation métallique relativement chargé, cependant, il réagira avec l’eau pour produire une solution acide.
- Si l’anion est la base conjuguée d’un acide fort, il n’affectera pas le \(pH\) de la solution. Si, par contre, l’anion est la base conjuguée d’un acide faible, la solution sera basique.
Solution:
a
- Le cation \(K^+\) a une petite charge positive (+1) et un rayon relativement grand (parce qu’il est dans la quatrième rangée du tableau périodique), c’est donc un acide de Lewis très faible.
- L’anion \(NO_3-\) est la base conjuguée d’un acide fort, il n’a donc essentiellement aucun caractère basique (tableau 16.1). Par conséquent, ni le cation ni l’anion ne réagiront avec l’eau pour produire du \(H^+\) ou du \(OH^-\), et la solution sera neutre.
b.
- L’ion \(Cr^{3+}\) est un cation métallique relativement chargé qui devrait se comporter de la même manière que l’ion \(Al^{3+}\) et former le complexe 3+, qui se comportera comme un acide faible : \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}\]
- L’anion \(Br^-\) est une base très faible (c’est la base conjuguée de l’acide fort \(HBr\)), il n’affecte donc pas le \(pH\) de la solution. Par conséquent, la solution sera acide.
c.
- L’ion \(Na^+\), comme le \(K^+\), est un acide très faible, donc il ne devrait pas affecter l’acidité de la solution.
- A l’inverse, le \(SO_4^{2-}\) est la base conjuguée du \(HSO_4^-\), qui est un acide faible. Par conséquent, l’ion \(SO_4^{2-}\) réagira avec l’eau comme le montre la figure 16.6 pour donner une solution légèrement basique.
Exercice \(\PageIndex{1}\)
Prédire si les solutions aqueuses des éléments suivants sont acides, basiques ou neutres.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Réponse a
neutre
Réponse b
acide
Réponse c
basique (en raison de la la réaction de \(HS^-\) avec l’eau pour former \(H_2S\) et \(OH^-\))
Sommaire
Un sel peut se dissoudre dans l’eau pour produire une solution neutre, une solution basique ou acide, selon qu’il contient la base conjuguée d’un acide faible comme anion (\(A^-\)), l’acide conjugué d’une base faible comme cation (\(BH^+\)), ou les deux. Les sels qui contiennent de petits ions métalliques très chargés produisent des solutions acides dans l’eau. La réaction d’un sel avec l’eau pour produire une solution acide ou basique est appelée réaction d’hydrolyse.