Geneerinen nimi: asikloviiri
Annostelumuoto: kerma
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 1. joulukuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Dositus
- Profiili
- Vuorovaikutukset
- Lisätietoja
- Zovirax-voiteen käyttöaiheet ja -aiheet
- Zovirax-voide Annostus ja antotapa
- ANNOSTUSMUODOT JA VAHVUUDET
- 4VALMISTELUOHJEET
- Varoitukset ja varotoimet
- Yleistä
- Kosketusyliherkistyminen
- Haittavaikutukset
- Kliinisistä tutkimuksista saadut kokemukset
- Kokemukset markkinoille tulon jälkeen
- Lääkeinteraktiot
- KÄYTTÖ ERITYISRYHMISSÄ
- Riskien yhteenveto
- Raskaus
- Laktointi
- Pediatrinen käyttö
- Geriatrinen käyttö
- Yliannostus
- Zovirax Cream Kuvaus
- Zovirax Cream – Kliininen farmakologia
- Vaikutusmekanismi
- Farmakokinetiikka
- Mikrobiologia
- Nonkliininen toksikologia
- Karsinogeneesi, mutageneesi, hedelmällisyyden heikentyminen
- Kliiniset tutkimukset
- aikuiset koehenkilöt
- Pediatriset koehenkilöt
- Miten valmistetaan/varastointi ja käsittely
- Potilaan neuvontaan liittyvät tiedot
- POTILASTIEDOTZOVIRAX (zho-vahy-rex)(asikloviiri)voide
- PÄÄLLYSTIEDOTE – 5 g:n tuubipakkaus
- Lisätietoa Zovirax-voiteesta (asikloviiri paikallisesti)
- Kuluttajan resurssit
- Ammattilaisen resurssit
- Muut valmisteet
- Hoito-oppaat
Zovirax-voiteen käyttöaiheet ja -aiheet
Zovirax-voide
. Voide on herpes simplex -viruksen (HSV) deoksinukleosidianaloginen DNA-polymeraasin estäjä, joka on tarkoitettu toistuvan herpes labialiksen (huuliherpeksen) hoitoon 12-vuotiailla ja sitä vanhemmilla immunokompetenteilla aikuisilla ja nuorilla.
Zovirax-voide Annostus ja antotapa
Zovirax-voidetta tulee käyttää 5 kertaa päivässä 4 päivän ajan. Hoito on aloitettava mahdollisimman varhain herpes labialiksen merkkien tai oireiden ilmaantumisen jälkeen, ts. prodroman aikana tai vaurioiden ilmaantuessa.
12-vuotiaille ja sitä vanhemmille nuorille annostus on sama kuin aikuisille.
ANNOSTUSMUODOT JA VAHVUUDET
Jokainen gramma Zovirax-voidetta sisältää 50 mg asikloviiria (vastaa 5 %:ia w/w).
4VALMISTELUOHJEET
Zovirax-voide on vasta-aiheinen potilaille, joilla on tunnettu yliherkkyys asikloviirille, valasikloviirille tai valmisteen jollekin aineosalle.
Varoitukset ja varotoimet
Yleistä
Zovirax-voidetta saa levittää vain huulten ja kasvojen infektoituneille ulkoisille puolille potilailla, joilla on huuliherpes. Koska tietoja ei ole saatavilla, levittämistä ihmisen limakalvoille ei suositella. Zovirax-voide on tarkoitettu vain ihokäyttöön, eikä sitä saa käyttää silmään tai suun tai nenän sisäpuolelle.
Kosketusyliherkistyminen
Zovirax-voide saattaa aiheuttaa ärsytystä ja kosketusyliherkistymistä.
Zovirax-voiteen vaikutusta immuunipuutteisilla potilailla ei ole osoitettu.
Haittavaikutukset
Kliinisistä tutkimuksista saadut kokemukset
Koska kliiniset tutkimukset tehdään hyvin erilaisissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määriä ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin määriin, eivätkä ne välttämättä vastaa kliinisessä käytännössä havaittuja määriä.
Viidessä kaksoissokkoutetussa, plasebokontrolloidussa tutkimuksessa 1124:ää potilasta hoidettiin Zovirax-voiteella ja 1161:tä plasebolla (kantaja-aineena käytetylle voiteelle). Paikallisia levityskohdan reaktioita raportoi 5 % Zovirax-voidetta saaneista potilaista ja 4 % lumelääkettä saaneista potilaista. Yleisimmät haittavaikutukset paikallisella levityskohdalla olivat huulten kuivuminen, hilseily, ihon kuivuminen, huulten halkeilu, ihon kirvely, kutina, ihon hilseily ja ihon kirvely; kutakin haittavaikutusta esiintyi alle 1 %:lla Zovirax-voidetta ja lumelääkettä saaneista potilaista. Kolme Zovirax-voidetta saanutta potilasta ja yksi lumelääkettä saanut potilas keskeytti hoidon haittavaikutuksen vuoksi.
Lisätutkimuksessa, johon osallistui 22 tervettä aikuista, arvioitiin Zovirax-voiteen ihotoleranssia verrattuna kantaja-aineeseen käyttäen yksittäistä okkludoitua ja puoliksi okkludoitua laastaritestausmenetelmää. Sekä Zovirax Cream että lumelääke osoittivat suurta ja kumulatiivista ärsytyspotentiaalia. Toisessa tutkimuksessa, johon osallistui 251 tervettä aikuista, arvioitiin Zovirax Cream -voiteen kosketusherkistymispotentiaalia käyttäen toistuvan loukkauksen laastaritestausmenetelmää. Arvioitavista 202 koehenkilöstä samoilla neljällä (2 %) koehenkilöllä havaittiin mahdollisia ihon herkistymisreaktioita sekä Zovirax Cream -voiteella että lumelääkkeellä, ja nämä reaktiot sekä Zovirax Cream -voiteelle että lumelääkkeelle varmistuivat kolmella koehenkilöllä uusintakokeilun yhteydessä. Herkistävää aineosaa (aineosia) ei ole tunnistettu.
Turvallisuusprofiili 12-17-vuotiailla potilailla oli samanlainen kuin aikuisilla havaittu.
Kokemukset markkinoille tulon jälkeen
Kliinisissä tutkimuksissa raportoitujen haittatapahtumien lisäksi asikloviirivoiteen myyntiluvan myöntämisen jälkeisen käytön aikana on havaittu seuraavia tapahtumia. Koska ne on raportoitu vapaaehtoisesti tuntemattoman kokoisesta populaatiosta, arvioita esiintymistiheydestä ei voida tehdä. Nämä tapahtumat on valittu mukaan niiden vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden asikloviirivoiteeseen perusteella.
Yleistä: Angioedeema, anafylaksia.
Iho: Kosketusihottuma, ekseema.
Lääkeinteraktiot
Kliinisen kokemuksen perusteella ei ole havaittu yhteisvaikutuksia, jotka johtuisivat muiden lääkkeiden paikallisesta tai systeemisestä antamisesta samanaikaisesti Zovirax-voiteen kanssa. Zovirax-voiteen minimaalisen systeemisen imeytymisen vuoksi systeemiset lääkeaineinteraktiot ovat epätodennäköisiä.
KÄYTTÖ ERITYISRYHMISSÄ
Riskien yhteenveto
Asikloviiri imeytyy minimaalisesti systeemisesti paikallisen annostelureitin jälkeen, eikä äidin käyttämän valmisteen odoteta johtavan sikiön altistumiseen Zovirax-voiteelle . Useiden vuosikymmenten kokemus asikloviirin paikallisesta käytöstä raskaana olevilla naisilla ei ole julkaistun kirjallisuuden, mukaan lukien havainnointitutkimukset, perusteella osoittanut lääkkeeseen liittyvää suurten synnynnäisten epämuodostumien, keskenmenon tai äidin tai sikiön haitallisten tulosten riskiä. Eläimillä on tehty lisääntymistutkimuksia, joissa asikloviirille on altistuttu systeemisesti. Katso lisätietoja asikloviirin valmisteyhteenvedosta.
Suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetussa väestössä ei ole tiedossa. Kaikissa raskauksissa on synnynnäisen epämuodostuman, keskenmenon tai muun haitallisen lopputuloksen taustariski. Yhdysvaltain yleisväestössä suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti todetuissa raskauksissa on 2-4 % ja 15-20 %.
Raskaus
Yhteenveto riskeistä
Asikloviiri imeytyy systeemisesti minimaalisesti paikallisen antoreitin jälkeen, eikä äidin käytön odoteta johtavan sikiön altistumiseen Zovirax-voiteelle . Useiden vuosikymmenten kokemus asikloviirin paikallisesta käytöstä raskaana olevilla naisilla ei ole julkaistun kirjallisuuden, mukaan lukien havainnointitutkimukset, perusteella osoittanut lääkkeeseen liittyvää suurten synnynnäisten epämuodostumien, keskenmenon tai haitallisten äitiys- tai sikiötulosten riskiä. Eläimillä on tehty lisääntymistutkimuksia, joissa asikloviirille on altistuttu systeemisesti. Katso lisätietoja asikloviirin valmisteyhteenvedosta.
Suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetussa väestössä ei ole tiedossa. Kaikissa raskauksissa on synnynnäisen epämuodostuman, keskenmenon tai muun haitallisen lopputuloksen taustariski. Yhdysvaltain yleisväestössä suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti todetuissa raskauksissa on 2-4 % ja 15-20 %.
Laktointi
Riskin yhteenveto
Asikloviiri imeytyy systeemisesti minimaalisesti paikallisen antoreitin jälkeen, eikä imetyksen odoteta johtavan lapsen altistumiseen Zovirax-voiteelle . ZOVIRAXin vaikutuksista imetettävään lapseen tai maidontuotantoon ei ole tietoja. Imetyksen kehitys- ja terveyshyödyt on otettava huomioon yhdessä äidin Zovirax Cream -valmisteen kliinisen tarpeen ja Zovirax Cream -valmisteen tai äidin perussairauden mahdollisten haittavaikutusten kanssa, joita Zovirax Cream -valmisteesta tai äidin perussairaudesta voi aiheutua imetettävälle lapselle.
Pediatrinen käyttö
Zovirax Cream -valmisteella suoritettiin avoin, kontrolloimaton tutkimus 113:lla 12-17-vuotiaalla potilaalla, joilla oli uusiutuva herpes labialis. Tässä tutkimuksessa hoitoa sovellettiin käyttäen samaa annosteluohjelmaa kuin aikuisilla, ja tutkittavia seurattiin haittavaikutusten varalta. Turvallisuusprofiili oli samanlainen kuin aikuisilla havaittu. Turvallisuutta ja tehoa alle 12-vuotiailla lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Sykloviirivoiteen kliinisiin tutkimuksiin ei sisältynyt riittävästi yli 65-vuotiaita tutkittavia, jotta olisi voitu määrittää, reagoivatko he eri tavalla kuin nuoremmat. Muissa raportoiduissa kliinisissä kokemuksissa ei ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä. Asikloviirin systeeminen imeytyminen paikallisen annostelun jälkeen on vähäistä .
Yliannostus
Zovirax-voiteen paikallisen annostelun aiheuttama yliannostus on epätodennäköistä, koska systeeminen altistuminen on vähäistä . Yliannostusta koskevia tietoja ei ole saatavilla.
Zovirax Cream Kuvaus
ZOVIRAX on herpesviruksia vastaan vaikuttavan synteettisen deoksinukleosidianalogin asikloviirin tuotenimi. Zovirax Cream 5 % on paikallisesti annosteltava valmiste.
Atsikloviirin kemiallinen nimi on 2-amino-1,9-dihydro-9–6H-purin-6-oni; sillä on seuraava rakennekaava:
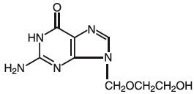
Atsikloviiri on valkoista, kiteistä jauhetta, jonka molekyylikaava on C8H11N5O3 ja molekyylipaino on 225. Suurin liukoisuus veteen 37 °C:ssa on 2,5 mg/ml. Asikloviirin pKa:t ovat 2,27 ja 9,25.
Jokainen gramma Zovirax-voidetta sisältää 50 mg (vastaa 5 % w/w) asikloviiria ja seuraavat inaktiiviset aineet: setostearyylialkoholi, mineraaliöljy, poloksameeri 407, propyleeniglykoli, natriumlauryylisulfaatti, vesi ja valkoinen vaseliini.
Zovirax Cream – Kliininen farmakologia
Vaikutusmekanismi
Sykloviiri on viruslääke, joka tehoaa α-herpesviruksiin .
Farmakokinetiikka
Zovirax Cream -voiteella tehtiin kliininen farmakologinen tutkimus aikuisilla vapaaehtoisilla henkilöillä asikloviirin perkutaanisen imeytymisen arvioimiseksi. Tässä tutkimuksessa, johon osallistui 6 miesvapaaehtoista, voidetta levitettiin 710 cm2 :n alueelle vapaaehtoisten selkään 5 kertaa päivässä 2 tunnin välein yhteensä 4 päivän ajan. Levitetyn voiteen paino ja asikloviirin erittyminen virtsaan mitattiin päivittäin. Asikloviirin pitoisuus plasmassa määritettiin 1 tunti viimeisen levityksen jälkeen. Asikloviirin keskimääräinen päivittäinen erittyminen virtsaan oli noin 0,04 % päivittäisestä annoksesta. Plasman asikloviiripitoisuudet olivat alle havaitsemisrajan (0,01 μM) viidellä koehenkilöllä ja tuskin havaittavissa (0,014 μM) yhdellä koehenkilöllä. Asikloviirin systeeminen imeytyminen Zovirax-voiteesta on minimaalista aikuisilla.
Asikloviirin systeemistä imeytymistä voiteen paikallisen annostelun jälkeen ei ole arvioitu <18-vuotiailla potilailla.
Mikrobiologia
Vaikutusmekanismi: Asikloviiri on synteettinen puriinideksinukleosidianalogi, jolla on soluviljelyssä ja in vivo inhiboiva vaikutus HSV-tyyppien 1 (HSV-1) ja 2 (HSV-2) DNA-polymeraaseja vastaan. Se estää HSV-1:n ja HSV-2:n replikaatiota soluviljelmissä ja in vivo.
Asikloviirin inhiboiva vaikutus on selektiivinen, koska se on affiniteetti HSV:n koodaamaan tymidiinikinaasientsyymiin (TK). Tämä viruksen entsyymi muuntaa asikloviirin asikloviirimonofosfaatiksi, deoksinukleotidianalogiksi. Solun guanylaattikinaasi muuttaa monofosfaatin edelleen difosfaatiksi ja useat solun entsyymit trifosfaatiksi. Biokemiallisissa määrityksissä asikloviiritrifosfaatti estää α-herpesviruksen DNA:n replikaatiota. Tämä esto tapahtuu kolmella tavalla: 1) virus-DNA-polymeraasin kilpailullinen esto, 2) kasvavaan virus-DNA-ketjuun liittyminen ja sen lopettaminen ja 3) virus-DNA-polymeraasin inaktivaatio.
Antiviraalinen aktiivisuus
Herpesvirusten soluviljelyssä havaitun viruslääkkeiden aiheuttaman herkkyyden ja kliinisen hoitovasteen kvantitatiivista suhdetta ihmisillä ei ole selvitetty eikä virusten herkkyystestejä ole standardoitu. Herkkyystestien tulokset, jotka ilmaistaan lääkkeen pitoisuutena, joka tarvitaan estämään 50 %:lla viruksen kasvua soluviljelmässä (EC50-arvo), vaihtelevat suuresti useista tekijöistä riippuen. Käyttämällä Vero-soluilla tehtäviä plakkien pelkistämismäärityksiä asykloviirin EC50-arvot herpes simplex -virusisolaatteja vastaan vaihtelevat 0,09-59,9 μM (0,02-13,5 μg/ml) HSV-1:n osalta ja 0.04-44,0 μM (0,01-9,9 μg/ml) HSV-2:lle.
Resistenssi
Soluviljelyssä
Sykloviirille resistenttejä HSV-1- ja HSV-2-kantoja eristettiin soluviljelmissä. Asikloviirille vastustuskykyinen HSV johtui mutaatioista viruksen tymidiinikinaasi (TK; pUL23) ja DNA-polymeraasi (POL; pUL30) -geeneissä. Yleisesti eristettiin kehyssiirtymiä, jotka johtavat HSV:n TK-tuotteen ennenaikaiseen typistymiseen, mikä vähentää herkkyyttä asikloviirille. Viruksen TK-geenin mutaatiot voivat johtaa TK-aktiivisuuden täydelliseen häviämiseen (TK-negatiivinen), vähentyneeseen TK-aktiivisuuteen (osittainen TK) tai viruksen TK:n kyvyn muuttumiseen fosforyloida lääkettä ilman, että kyky fosforyloida tymidiiniä heikkenee vastaavalla tavalla (muuttunut TK). Soluviljelmissä HSV-1:n ja HSV-2:n TK:ssa havaittiin seuraavat resistenssiin liittyvät substituutiot (taulukko 1).
|
HSV-1 |
TK |
P5A, H7Q, L50V, G56V, G59A, G61A, K62N, T63A, E83K, P84S, D116N, P131S, R163H, A167V, P173L, Q185R, R216S, R220H, T245M, R281stop, T287M, M322K |
|
HSV-2 |
TK |
L69P, C172R, T288M |
|
HSV-1 |
POL |
D368A, Y557S, E597D, V621S, L702H, N815S, V817M, G841C |
|
HSV-2 |
POL |
HSV-infektoituneilla potilailla
Kliiniset HSV-1- ja HSV-2 -isolaatteja, jotka saatiin potilailta, joiden α-herpesvirusinfektioiden hoito oli epäonnistunut, arvioitiin TK- ja POL-geenien genotyyppisten muutosten ja asikloviiriresistenssin fenotyyppisen resistenssin osalta (taulukko 2). Tunnistettiin HSV-isolaatteja, joilla oli frameshift-mutaatioita ja resistenssiin liittyviä substituutioita TK:ssa ja POL:ssa. Luettelo HSV:n TK- ja POL-geenien substituutioista, jotka johtavat alhaisempaan herkkyyteen asikloviirille, ei ole kattava, ja lisämuutoksia tunnistetaan todennäköisesti HSV-varianteissa, jotka on eristetty potilailta, jotka eivät saa asikloviiria sisältäviä hoitoja. Viruksen asikloviiriresistenssin mahdollisuus on otettava huomioon potilailla, jotka eivät reagoi hoitoon tai joilla esiintyy toistuvaa viruksen irtoamista hoidon aikana.
|
HSV-1 |
TK |
G6C, R32H, R41H, R51W, Y53C/D/H, Y53stop, D55N, G56D/S, P57H, H58/N/R/Y, G59R, G61A, K62N, T63I, Q67stop, S74stop, Y80N, E83K, P84L, Y87H, W88R, R89Q/W, E95stop, T103P, Q104H, Q104stop, H105P, D116N, M121L/R, S123R, Q125H, M128L, G129D, I143V, A156V, D162A/H/N, R163G/H, L170P, Y172C, P173L, A174P, A175V, R176Q/W, R176stop, L178R, S181N, V187M, A189V, V192A, G200C/D/S, T201P, V204G, A207P, L208F/H, R216C/H, R220C/H, R221H, R222C/H, L227F, T245M/P, L249P, Q250Stop, C251G, R256W, E257K, Q261R, T287M, L288Stop, L291P/R, L297S, L315S, L327R, C336Y, Q342Stop, T354P, L364P, A365T |
|
HSV-2 |
TK |
R34C, G39E, R51W, Y53N, G59P, G61W, S66P, A72S, D78N, P85S, A94V, N100H, I101S, Q105P, T131P, D137stop, F140L, L158P, S169P, R177W, S182N, M183I, V192M, G201D, R217H, R221C/H, Q222stop, R223H, Y239stop, R271V, P272S, D273R, T287M, C337Y |
|
HSV-1 |
POL |
K532T, Q570R, L583V, A605V, A657T, D672N, V715G, A719T/V, S724N, F733C, E771Q, S775N, L778M, E798K, V813M, N815S, G841S, I890M, G901V, V958L H1228D |
|
HSV-2 |
POL |
E250Q, D307N, K533E, A606V, C625R, R628C, E678G, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, N820S, Y823C, Q829R, T843A, M910T, D912N/V, A915V, F923L, T934A, R964H |
Huom: Muita asikloviiriresistenssiä aiheuttavia substituutioita voi olla olemassa.
Ristiresistenssi
Ristiresistenssiä on havaittu HSV-isolaateissa, jotka kantavat frameshift-mutaatioita ja resistenssiin liittyviä substituutioita, jotka aiheuttavat heikentyneen herkkyyden pensikloviirille (PCV), famsikloviirille (FCV) ja foskarnetille (FOS) .
|
Ristiresistenssi PCV:lle/FCV:lle |
HSV-1 TK |
G6C, R32H, R51W, Y53C/H, H58N, G61A, S74Stop, E83K, P84L, T103P, Q104Stop, D116N, M121R, I143V, R163H, L170P, Y172C, A174P, R176Q/W, Q185R, A189V, G200D, L208H, R216C, R220H, R222C/H, T245M, Q250Stop, R256W, R281Stop, T287M, L315S, M322K, C336Y |
|
Ristiintaudinkestävä PCV:lle/FCV:lle |
HSV-1 POL |
A657T:lle, C336Y |
|
Ristiresistentti PCV/FCV:lle |
HSV-2 TK |
G39E, R51W, Y53N, R177W, R221H, T288M |
|
Ristiresistentti PCV/FCV:lle |
HSV-2 POL |
K533E, A606V, C625R, R628C, S729N, Q732R, M789K/T, V818A, N820S, F923L, T934A |
|
Ristiresistentti FOS |
HSV-1 POL |
D368A, A605V, D672N, L702H, V715G, A719T/V, S724N, L778M, E798K, V813M, N815S, V817M, G841C/S, I890M, |
|
Ristikestävä FOS |
HSV-2 POL |
K533E, A606V, C625R, R628C, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, Y823C, D912V, F923L, T934A, R964H |
Nonkliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikentyminen
Systeeminen altistuminen asikloviirin paikallisen annostelun jälkeen on vähäistä. Ihon kautta tehtäviä karsinogeenisuustutkimuksia ei ole tehty. Syöpää, mutageenisuutta ja hedelmällisyyttä koskevien tutkimusten tuloksia ei ole sisällytetty Zovirax Cream -voiteen täydellisiin lääkemääräyksiin, koska iholle annostelusta johtuva asikloviirin altistuminen on vähäistä. Tietoa näistä tutkimuksista on saatavilla ZOVIRAX-kapseleiden, -tablettien ja -suspension sekä ZOVIRAX-injektionesteen täydellisessä reseptitiedotteessa.
Kliiniset tutkimukset
aikuiset koehenkilöt
Zovirax-voidetta arvioitiin kahdessa kaksoissokkoutetussa, satunnaistetussa, lumelääkkeellä (plasebo, kantaja-aineella) kontrolloidussa tutkimuksessa uusiutuvan herpes labialiksen hoidossa. Keskimääräisellä potilaalla oli ollut viisi herpes labialis -episodia edellisen 12 kuukauden aikana. Ensimmäisessä tutkimuksessa tutkittavien keski-ikä oli 37 vuotta (vaihteluväli 18-81 vuotta), 74 % oli naisia ja 94 % valkoihoisia. Toisessa tutkimuksessa tutkittavien mediaani-ikä oli 38 vuotta (vaihteluväli 18-87 vuotta), 73 % oli naisia ja 94 % valkoihoisia. Koehenkilöitä ohjeistettiin aloittamaan hoito 1 tunnin kuluessa oireiden havaitsemisesta ja jatkamaan hoitoa 4 päivän ajan siten, että tutkimuslääkettä annettiin 5 kertaa päivässä. Kummassakin tutkimuksessa Zovirax-voiteella hoidetuilla henkilöillä (n = 682) toistuvan herpes labialis -episodin keskimääräinen kesto oli noin puoli vuorokautta lyhyempi kuin lumelääkkeellä hoidetuilla henkilöillä (n = 703), noin 4,5 vuorokautta verrattuna 5 vuorokauteen. Zovirax-voidetta tai lumelääkettä saaneiden koehenkilöiden välillä ei havaittu merkittävää eroa huuliherpesvaurioiden etenemisen estämisessä.
Pediatriset koehenkilöt
Zovirax-voiteella tehtiin avoin, kontrolloimaton tutkimus 113:lla 12-17-vuotiaalla potilaalla, joilla oli toistuva herpes labialis. Tässä tutkimuksessa hoitoa sovellettiin käyttäen samaa annosteluohjelmaa kuin aikuisilla, ja tutkittavia seurattiin haittatapahtumien varalta. Turvallisuusprofiili oli samanlainen kuin aikuisilla havaittu.
Miten valmistetaan/varastointi ja käsittely
Jokainen gramma Zovirax-voidetta sisältää 50 mg (vastaa 5 % w/w) asikloviiria vesipohjaisessa voidepohjassa. Zovirax Cream toimitetaan seuraavasti:
NDC 0187-0994-45: 5 g:n tuubit
Säilytä enintään 25 °C:ssa (77°F); poikkeamat sallittu 15°-30 °C:ssa (59°-86°F).
Potilaan neuvontaan liittyvät tiedot
Vinkkaa potilasta lukemaan FDA:n hyväksymät potilaskohtaiset merkinnät (potilasinformaatio).
Yleistä
Potilaille on kerrottava, että Zovirax Cream on reseptillä myytävä paikallinen voide kasvojen ja huulten huuliherpeksen (herpes labialis) hoitoon. Zovirax Cream ei ole lääke huuliherpekseen. Potilaille on kerrottava, että Zovirax Cream on tarkoitettu vain ihokäyttöön huulten ja suun ympärillä esiintyvään herpes labialikseen. Potilaita on neuvottava, että Zovirax Cream -voidetta ei saa käyttää silmään, suun tai nenän sisäpuolelle eikä sukupuolielimiin. Potilaita on ohjeistettava välttämään muiden paikallisesti käytettävien tuotteiden levittämistä sairastuneelle alueelle Zovirax-voiteen käytön aikana.
Ei saa käyttää, jos olet allerginen Zovirax-voiteelle tai Zovirax-voiteen jollekin aineelle. Ennen kuin käytät Zovirax Cream -voidetta, kerro lääkärille, jos olet raskaana, suunnittelet raskautta tai imetät.
Käyttöohjeet
Hoito on aloitettava heti, kun ensimmäiset merkit tai oireet viittaavat uusiutumiseen. Ohjeista potilaita pesemään kädet ennen levitystä ja varmistamaan, että kasvot ja/tai huulet ovat puhtaat ja kuivat. Neuvo potilaita levittämään Zovirax-voidetta paikallisesti 5 kertaa päivässä 4 päivän ajan. Ohjeista potilaita levittämään paikallisesti Zovirax Cream -voidetta niin paljon, että se peittää vaurioituneen alueen, myös ulkosyrjän. Neuvo potilaita välttämään tartunta-alueen tarpeetonta hankaamista, jotta infektio ei pahenisi tai siirtyisi. Ohjeista potilaita pesemään kätensä vedellä ja saippualla Zovirax-voiteen käytön jälkeen. Säilytä lasten ulottumattomissa.
Mahdolliset haittavaikutukset
Yleisiä ihoon liittyviä haittavaikutuksia, joita esiintyi Zovirax-voidetta käytettäessä, ovat levityskohdan reaktiot. Zovirax-voide saattaa aiheuttaa ärsytystä ja kosketusyliherkistymistä.
Jakaja: Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Valmistanut: Bausch Health Companies Inc.
Laval, Quebec H7L 4A8, Canada
Zovirax on GlaxoSmithKline-yritysryhmän rekisteröity tavaramerkki, jota Bausch Health käyttää lisenssillä.
© 2020 Bausch Health Companies Inc. tai sen tytäryhtiöt
9462203
POTILASTIEDOTZOVIRAX (zho-vahy-rex)(asikloviiri)voide
Tärkeitä tietoja: Zovirax-voide on tarkoitettu käytettäväksi vain huulten ja suun ympärillä oleviin huuliherpekseihin. Zovirax-voidetta ei saa käyttää silmissä, suussa, nenässä tai sukupuolielimissä.
Mitä Zovirax-voide on?
– Zovirax-voide on reseptilääke, jota käytetään aikuisilla ja 12-vuotiailla ja sitä vanhemmilla aikuisilla ja lapsilla, joilla on normaali immuunijärjestelmä, toistuvien huuliherpeksen aiheuttamien huuliherpeksen (herpes labialis) hoitoon. – Zovirax Cream ei paranna huuliherpestä.
Ei tiedetä, onko Zovirax Cream turvallinen ja tehokas alle 12-vuotiaille lapsille.
Älä käytä Zovirax Cream -voidetta, jos olet allerginen asikloviirille, valasikloviirille tai Zovirax Cream -voiteen jollekin aineelle. Katso tämän pakkausselosteen lopusta täydellinen luettelo Zovirax-voiteen sisältämistä aineista.
Mitä minun on kerrottava hoitohenkilökunnalle ennen kuin käytän Zovirax-voidetta?
Kerro hoitohenkilökunnalle ennen Zovirax-voiteen käyttöä kaikista sairauksistasi, mukaan lukien jos:
– sairastut hyvin helposti (sinulla on heikko immuunijärjestelmä). – olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako Zovirax Cream -voide syntymätöntä lastasi. – imetät tai aiot imettää. Ei tiedetä, kulkeutuuko Zovirax Cream rintamaitoon. Keskustele terveydenhuollon ammattilaisen kanssa parhaasta tavasta ruokkia vauvaa, jos käytät Zovirax Cream -voidetta.
Kerro terveydenhuollon ammattilaiselle kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja reseptivapaat lääkkeet, vitamiinit ja kasviperäiset lisäravinteet.
Miten minun pitäisi käyttää Zovirax Cream -voidetta?
– Käytä Zovirax Cream -voidetta juuri siten kuin terveydenhuollon ammattilainen neuvoo. – Käytä Zovirax Cream -voidetta heti, kun sinulla on ensimmäiset huuliherpeksen oireet, kuten kutina, punoitus, kirvely tai pistely, tai kun huuliherpes ilmestyy. – Pese kädet saippualla ja vedellä ennen Zovirax-voiteen levittämistä ja sen jälkeen. – Vaurioituneen alueen tulee olla puhdas ja kuiva ennen Zovirax Cream -voiteen levittämistä. – Levitä Zovirax Cream -voidetta sairastuneelle alueelle 5 kertaa päivässä 4 päivän ajan, mukaan lukien ulkoreuna. – Vaikutusalueelle ei saa levittää muita ihotuotteita Zovirax Cream -hoidon aikana. – Vältä huuliherpeksen tarpeetonta hankaamista, koska se voi aiheuttaa huuliherpeksen leviämisen muille suun ympärillä oleville alueille tai pahentaa huuliherpestäsi.
Mitkä ovat Zovirax-voiteen mahdolliset haittavaikutukset?
Zovirax-voiteen yleisimmät haittavaikutukset ovat ihoreaktioita hoitokohdassa, ja niitä voivat olla: kuivat tai halkeilevat huulet, ihon kuoriutuminen, hilseily tai kuivuus, polttava tai kirvelevä tunne ja kutina.
Nämä eivät ole kaikki Zovirax-voiteen mahdollisia haittavaikutuksia. Soita lääkärillesi saadaksesi lääkärin neuvoja haittavaikutuksista. Voit ilmoittaa haittavaikutuksista FDA:lle numeroon 1-800-FDA-1088.
Miten Zovirax-voidetta säilytetään?
– Säilytä Zovirax-voidetta huoneenlämmössä välillä 68°-77°F (20°-25°C).
Säilytä Zovirax Cream ja kaikki lääkkeet lasten ulottumattomissa.
Yleistä tietoa Zovirax Cream -voiteen turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muuhun kuin pakkausselosteessa mainittuun tarkoitukseen. Älä käytä Zovirax Cream -voidetta tilaan, johon sitä ei ole määrätty. Älä anna Zovirax Cream -voidetta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä apteekkihenkilökunnalta tai terveydenhoitajalta Zovirax-voidetta koskevia tietoja, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä Zovirax-voiteen sisältämät aineet ovat?
Valmis aine: asikloviiri
Vaikuttamattomat aineet: setostearyylialkoholi, kivennäisöljy, poloksaameeri 407, propyleeniglykoli, natriumlauryylisulfaatti, vesi ja valkoinen vaseliini
Jakaja:: Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Valmistanut: Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Valmistanut: Bausch Health US, LLC
Bridgewater, NJ 08807 USA Bausch Health Companies Inc.
Laval, Quebec H7L 4A8, Kanada
Zovirax on GlaxoSmithKline-konsernin rekisteröity tavaramerkki, jota Bausch Health käyttää lisenssillä.
© 2020 Bausch Health Companies Inc. tai sen tytäryhtiöt
Lisätietoja saat soittamalla numeroon 1-800-321-4576.
Tämä potilasinformaatio on Yhdysvaltain elintarvike- ja lääkeviraston (Food and Drug Administration) hyväksymä.
Tarkistettu: 12/2020
9462203
PÄÄLLYSTIEDOTE – 5 g:n tuubipakkaus
ZOVIRAX®
(ACYCLOVIR) CREAM 5%
NDC 0187-0994-45
Nettopaino. 5 g
Jokainen gramma sisältää:
50 mg asikloviiria, setostearyylialkoholia, mineraaliöljyä, poloksameeri 407, propyleeniglykolia, natriumlauryylisulfaattia, vettä ja valkoista vaseliinia.
KÄYTTÖOHJEET AINOASTAAN KYLMÄHAVAINNOITSIJOIHIN.
KÄYTTÖOHJEET.
Ortho Dermatologics
Vain reseptilääke
| ZOVIRAX asykloviirivoide |
||||||||||||
|
||||||||||||
| Toimiva ainesosa/toimiva osa | ||
| Toimivan ainesosan nimi | Toimivan ainesosan perusta. Vahvuus | Vahvuus |
| asikloviiri (asikloviiri) | asikloviiri | 50 mg 1 g:ssa |
| Vaikuttavat aineet | ||
| Ainesosan nimi | Vahvuus | |
| Cetostearyylialkoholi | ||
| Mineraaliöljy | ||
| Poloksameeri. 407 | ||
| Natriumlauryylisulfaatti | ||
| Vesi | ||
| Petrolatum | ||
| Pakkaus | |||
| # | Item Code | Package Description | |
| 1 | NDC:0187-0994-45 | 1 PUTKI 1 KARTONKI | |
| 1 | 5 g 1 PUTKI | ||
| 2 | NDC:0187-0994-20 | 1 PUTKI 1 KARTONGISSA | |
| 2 | 0.9 g 1 TUBE | ||
| Markkinointitiedot | |||
| Markkinointikategoria | Hakemusnumero tai monografian viittaus | Markkinoinnin alkamispäivä | Markkinoinnin päättymispäivä |
| NDA | NDA021478 | 30.12.2002 | |
Etiketti – Bausch Health US, LLC (831922468)
| Toimipaikka | |||
| Nimi | Asoite | ID/FEI | Operations |
| Bausch Health Companies Inc. | 245141858 | MANUFACTURE(0187-0994) | |
Lisätietoa Zovirax-voiteesta (asikloviiri paikallisesti)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Ainetietoa annostelusta
- Lääkeinteraktiot
- Hinnoittelu & Kuponkeja
- 39 Arvostelua
- Lääkeryhmä:
Kuluttajan resurssit
- Potilastiedot
Ammattilaisen resurssit
- Valmisteyhteenvedot
- Acyclovir-voide (FDA)
Muut valmisteet
- Zovirax
- Zovirax-voide
Hoito-oppaat
- Herpes simplex
- Kylmät haavaumat
Lääketieteellinen vastuuvapauslauseke