Immuunijärjestelmä
Immuunijärjestelmä koostuu kudoksista, soluista ja molekyyleistä, joiden ensisijaisena tehtävänä on havaita patogeenit ja muuntuneet solut, reagoida niihin ja eliminoida ne.
Synnynnäinen ja adaptiivinen immuunivaste
Immuunijärjestelmässä on kaksi pääkomponenttia: 1) synnynnäinen immuunijärjestelmä ja 2) adaptiivinen immuunijärjestelmä. Synnynnäinen immuunijärjestelmä toimii ensimmäisenä puolustuslinjana ja havaitsee patogeenit ituradan koodattujen hahmontunnistusreseptorien avulla, ei muodosta muistia ja reagoi nopeasti (minuuteista tunteihin). Adaptiivinen immuunijärjestelmä reagoi hitaasti (päivien kuluessa), käyttää antigeenispesifisiä reseptoreita, jotka käyvät läpi useita geenimuutoksia kehityksen aikana, ja muodostaa immunologisen muistin – se ”oppii” ensimmäisestä loukkauksesta ja valmentaa elimistöä torjumaan myöhempää altistumista samankaltaiselle haitalliselle materiaalille. Molemmat immuunivasteet voivat johtua joko solunulkoisessa nesteessä olevista makromolekyyleistä tai tiettyjen immuunisolujen aktivoitumisesta. Näitä vasteita kutsutaan humoraaliseksi immuniteetiksi ja soluvälitteiseksi immuniteetiksi.
Soluvälitteisen immuunivasteen sateenvarjon alla immuunisolut jakautuvat useimmiten sen mukaan, onko vaste synnynnäinen vai adaptiivinen. Synnynnäinen immuunijärjestelmä koostuu pääasiassa fagosytoivista soluista, kuten neutrofiileistä, makrofageista, luonnollisista tappajasoluista, basofiileistä ja muista, jotka kohdistuvat vaarallisiin tunkeutuviin organismeihin. Adaptiivisen immuunijärjestelmän soluja ovat T- ja B-solut. Luonnollisilla tappajasoluilla (NK) T-soluilla on sekä synnynnäisten että adaptiivisten immuunisolujen ominaisuuksia. Lisäksi useimmat muut solutyypit, jotka eivät ole spesifisiä immuunijärjestelmälle, voivat sisältää luontaisia synnynnäisiä immuunitoimintoja sytoplasman reseptoreiden sekä signalointi- ja efektorimolekyylien, kuten RIG-I-, STING- ja NLR-perheiden jäsenten, muodossa. Kuten jäljempänä tarkastellaan, molempien järjestelmien solut syntyvät hematopoieettisten kantasolujen eri myelooisista ja lymfaattisista linjoista.
Immuunijärjestelmän osat
Kypsät immuunisolut erilaistuvat niin sanotuista hematopoieettisista kantasoluista. Nämä ovat pluripotentteja erilaistumattomia esisoluja, joita esiintyy luuytimessä, perifeerisessä veressä ja istukassa. Nämä hematopoieettiset kantasolut voivat erilaistua yleiseksi myelooiseksi esisoluksi tai yleiseksi lymfaattiseksi esisoluksi.
Lymfaattiset solut
Tavalliset lymfaattiset esisolut voivat erilaistua neljäksi suureksi lymfosyyttipopulaatioksi, jotka voidaan erottaa toisistaan solupinnan reseptorien ilmentymisen perusteella: T-solut, B-solut, luonnolliset tappajasolut (NK-solut) ja NK-T-solut.
T-solut
T-soluilla on kriittinen rooli soluvälitteisessä immuniteetissa. Nämä solut tunnistetaan CD3-T-solujen signaaliketjujen ilmentymisen perusteella.
T-solut syntyvät lymfaattisista esisoluista, jotka alun perin kehittyvät luuytimen hematopoieettisista kantasoluista. Kun lymfaattinen esiaste sitoutuu muuttumaan T-soluksi, se siirtyy luuytimestä kateenkorvaan (tästä nimi T-solu). Kateenkorva tarjoaa sopivan mikroympäristön, jossa T-solut voivat kehittyä eri alatyypeiksi, jotka määritellään solujen pinnalla ilmentyvien erityisten reseptorien perusteella. Varhaisessa vaiheessa kypsyviltä T-soluilta eli tymosyyteiltä puuttuvat sekä CD4- että CD8-reseptorit, minkä vuoksi niitä kutsutaan kaksoisnegatiivisiksi (DN) soluiksi. DN-soluissa tapahtuu sitten geneettisiä uudelleenjärjestelyjä ja mutaatioita geeneissä, jotka koodaavat alfa- ja beetatyypin T-solureseptoreita (TCR), mikä käynnistää niiden linjasitoutumisen, jolloin lopputuloksena on T-solureseptori, jolla on spesifinen affiniteetti ainutlaatuista antigeenia kohtaan.
Tämän jälkeen tymosyytit valikoituvat sekä positiivisesti että negatiivisesti sen varmistamiseksi, että ne tunnistavat ”vieraat” antigeenit mutta eivät isännän antigeenejä, jotka esitetään peptideinä solun pinnalla olevan MHC:n kautta. Vain ne solut, jotka läpäisevät molemmat testit, käynnistetään sitten ilmentämään CD4- ja CD8-soluja, jolloin niistä tulee kaksoispositiivisia soluja. Kypsymisen lopussa T-solut ilmentävät joko CD4:ää tai CD8:aa (ja menettävät toisen ilmentymisen), jolloin niistä tulee yksipositiivisia soluja. Nämä kypsät CD4- tai CD8-positiiviset T-solut vapautuvat sitten verenkiertoon ja ovat aluksi naiivissa tilassa, mikä tarkoittaa, että ne eivät ole vielä sitoutuneet tiettyyn T-solujen alatyyppiin.
Jos kypsyvä tymosyytti osoittaa kypsymisen aikana keskinkertaista affiniteettia itsestään peräisin oleviin MHC-peptideihin, se voidaan valita regulatoriseksi T-soluksi (Treg), koska se kykenee tunnistamaan haitallisia ”itseensä” liittyviä antigeenejä. Veressä tai perifeerisissä kudoksissa olevia T-soluja voidaan myös paikallisesti indusoida muuttumaan Treg-soluiksi. Treg-solujen päätehtävänä on ylläpitää toleranssia itse antigeenejä kohtaan sekä rajoittaa T-vaikuttajasolujen toimintaa ja lisääntymistä.
Saavuttuaan vereen tai perifeeriseen kudokseen naiivit T-solut voidaan indusoida muuttumaan T-auttajasoluiksi. Antigeenia esittelevät solut (APC), kuten makrofagit, dendriittisolut ja B-solut, näyttävät antigeenin T-solulle, ja jos sen reseptorilla on affiniteetti, T-solu tunnistaa antigeenin. Tyypillisesti CD4+ T-solut soveltuvat tunnistamaan luokan II MHC-proteiineihin sitoutuneita peptidiantigeeneja. Kun peptidi-MHC-kompleksi on tunnistettu, T-solu aktivoi joukon sisäisiä reittejä, joiden avulla antigeenin tunnistaminen voidaan todentaa. Vasta tämän jälkeen T-auttajasolu lisääntyy ja laajentaa niiden käytettävissä olevien solujen joukkoa, jotka ovat spesifisiä haitalliselle antigeenille, kuten erilaisille bakteereille ja loisille.
Kun T-helper-solut ovat tunnistaneet antigeenin ja aktivoituneet, ne vapauttavat erilaisia sytokiineja, jotka ovat molekyylejä, jotka viestittävät muille immuunisoluille, miten haitalliseen molekyyliin on vastattava asianmukaisesti. T-apusoluilla on useita alaryhmiä, kuten Th1, Th2 ja Th17. Nämä alaryhmät tuottavat ja erittävät erilaisia sytokiineja, jotka auttavat räätälöimään immuunivasteen patogeenityypin mukaan. Esimerkiksi Th1-solut tukeutuvat efektorisytokiiniin IFN-γ:hen antaakseen signaalin makrofageille, jotta ne sulattaisivat ja tuhoaisivat haitallisen materiaalin, kun taas Th2-solut erittävät IL-4:n, IL-5:n, IL-9:n, IL-10:n ja IL-13:n yhdistelmää laukaistakseen basofiilit, eosinofiilit ja muut solut hyökkäämään infektiota vastaan. Sytokiinien tietty määrä ja lajikkeet määräävät sopivan vasteen infektioon tai haitalliseen soluun. T-solut voivat myös reagoida itsensä soluihin muuttumalla sytotoksisiksi T-soluiksi (tai luonnollisiksi tappaja-T-soluiksi). Tyypillisesti nämä ovat CD8+-soluja, jotka tunnistavat virustartunnan saaneita soluja tai kasvainsoluja. Luonnollisia tappaja-T-soluja (NKT-solut) käsitellään tarkemmin myöhemmässä jaksossa. Nämä ja muuntyyppiset T-solut suorittavat erilaisia tehtäviään tai efektoritoimintojaan eri tavoin tunnistaakseen haitallista materiaalia ja rekrytoidakseen muita immuunisoluja tuhoamaan sitä sekä rakentaakseen pysyvän immuunivasteen samantyyppiselle loukkaukselle.
T-solureseptorien vuorovaikutteista signalointireittiä tarkastellaan yksityiskohtaisesti tässä.
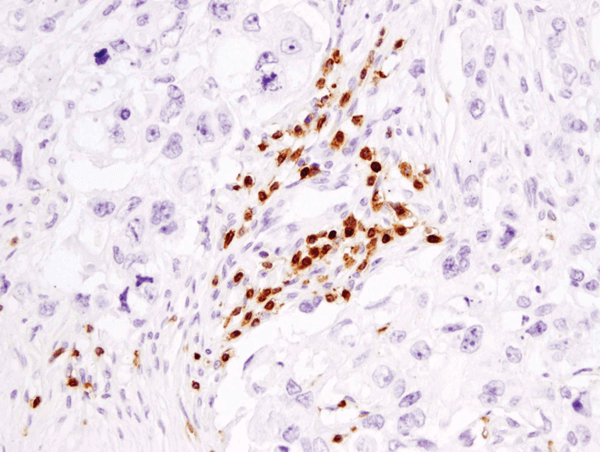
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-analyysi parafiiniin upotetusta ihmisen rintasyövästä käyttäen #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-analyysi parafiiniin sulautetusta ihmisen rintasyövästä käyttäen #85061.
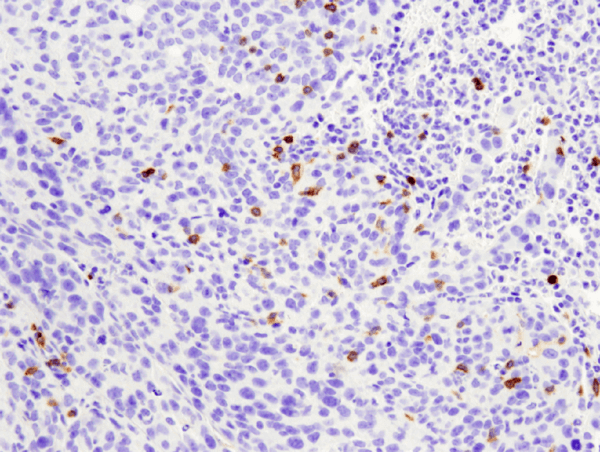
CD4 (D7D2Z) Rabbit mAb #25229: IHC-analyysi parafiiniin sulautetusta 4T1-metastaattisesta kasvaimesta hiiren keuhkoissa käyttäen #25229.
CD4 (D7D2Z) Rabbit mAb #25229: IHC-analyysi parafiiniin sulautetusta 4T1-metastaattisesta kasvaimesta hiiren keuhkoissa käyttäen #25229.
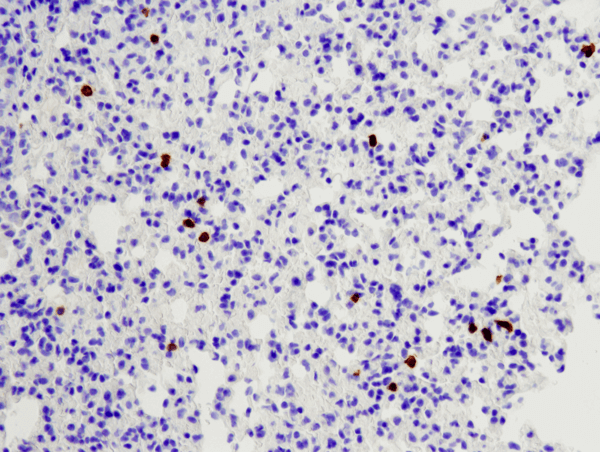
CD8α (D4W2Z) XP® Rabbit mAb (hiirispesifinen) #98941: IHC-analyysi parafiiniin sulautetusta hiiren keuhkosta käyttäen #98941.
CD8α (D4W2Z) XP® Rabbit mAb (hiirispesifinen) #98941: IHC-analyysi parafiiniin sulautetusta hiiren keuhkosta käyttäen #98941.
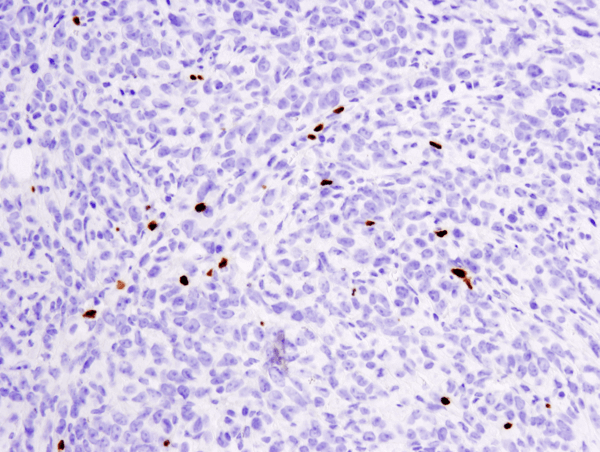
FoxP3 (D6O8R) Rabbit mAb #12653: IHC-analyysi parafiiniin sulautetusta 4T1-metastaattisesta kasvaimesta hiiren keuhkossa käyttäen #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: IHC-analyysi parafiiniin sulautetusta 4T1-metastaattisesta kasvaimesta hiiren keuhkoissa käyttäen #12653.
B-solut
B-solut ovat veren kriittisiä soluja, jotka välittävät vasta-ainetuotantoa. Kun verenkierrossa on haitallista materiaalia, B-solujen spesifiset reseptorit tunnistavat sen antigeeniksi. Antigeenin käsittelyn jälkeen B-solu kypsyy T-solujen avulla plasmasoluiksi, jotka erittävät vasta-aineita. B-soluilla voi olla myös rooli antigeenien esittämisessä ja sytokiinien erityksessä. Keskustellaan sekä B-solun kehityksestä että sen eri toiminnoista.
Perifeerisessä veressä olevista leukosyyteistä 15 % on B-soluja. B-solut tuottavat immunoglobuliineja (Ig), jotka ovat antigeeniä sitovia proteiineja (tunnetaan myös vasta-aineina), jotka koostuvat kahdesta identtisestä raskaasta ketjusta ja kahdesta identtisestä kevyestä ketjusta. Nämä immunoglobuliinit sisältävät spesifisiä antigeenin sidontapaikkoja, joiden aminohapposekvenssi vaihtelee vasta-ainemolekyyleistä toiseen. Nämä kohdat antavat kullekin vasta-aineelle spesifisyyden tunnistaa tietty antigeeni.
Kuten edellä mainittiin, B-solut erilaistuvat luuytimessä olevista hematopoieettisista soluista. Pinta-Ig-reseptorit (vasta-aineet) muodostuvat luuytimessä geenien uudelleenjärjestäytymisprosessin kautta. B-solut käyttävät somaattista yhdistymistä useiden kromosomien eri geeneihin, jotka koodaavat Ig:n muodostavien raskaiden ja kevyiden ketjujen eri osia. B-soluja ohjataan erilaistumaan luuytimen stroomasolujen tuottaman IL-7:n avulla. Nämä kehittyvät B-solut noudattavat peräkkäisten raskaiden ja kevyiden ketjujen uudelleenjärjestelyjen ohjelmaa, jota välittävät erilaiset solupinnan reseptorien ilmentymät. Esimerkiksi tietyn B-solua edeltävän reseptorin ilmentyminen estää tiettyjä geenien uudelleenjärjestelyjä toisistaan riippumattomilla kromosomeilla sen varmistamiseksi, että kypsä B-solu voi ilmentää tiettyä Ig-pintareseptoria, joka kykenee tunnistamaan spesifisesti yhden antigeenin. Tätä prosessia kutsutaan alleeliseksi poissulkemiseksi. Ig:n raskaiden ketjujen ja kevyiden ketjujen virheellinen kokoaminen voi aiheuttaa toissijaisen uudelleenjärjestäytymisen reseptorin muokkaamiseksi.
Ig-reseptorin solupinnan ilmentymisen lisäksi B-solut sisältävät myös transmembraaniproteiineja, jotka voivat indusoida solunsisäisiä signaaleja sen jälkeen, kun antigeeni sitoutuu Ig-reseptorin solunulkoiseen osaan. B-solut käyttävät samankaltaisia solunsisäisiä signaalikaskadeja kuin T-solut, jotka aiheuttavat transkriptiomuutoksia, jotka johtavat proliferaatioon ja kypsymiseen. Erityisesti Ig-reseptorin solunsisäiset domeenit voivat fosforyloitua src-kinaasiperheen toimesta, mikä käynnistää kaskadin, joka välittyy tyrosiinikinaasi Sykin ja BLINK-nimisen linkkiproteiinin kautta fosfolipaasi C:hen ja guaniininvaihtotekijöihin, mikä lopulta aktivoi proteiinikinaasi C:n, mobilisoi kalsiumin ja aktivoi MAP-kinaasin Ras/Rac-riippuvaisella tavalla.
B-solujen ainutlaatuinen piirre on niiden kyky vaihtaa isotyyppiä. Tämä viittaa erityisesti DNA:n uudelleenjärjestäytymisprosessiin, joka voi tuottaa hieman erilaisia raskaita ketjuja. Lisäksi raskaan ketjun eksonien vaihtoehtoinen splikointi voi mahdollistaa Ig:n pysymisen solupinnalla tai sen erittymisen, jos transmembraaninen eksoni splikoidaan pois. Vaihtoehtoinen splikointi ja isotyypin vaihto indusoituvat T-soluista peräisin olevien sytokiinien avulla. Lisäksi T-solut voivat indusoida somaattisia mutaatioita, jotka johtavat muutoksiin B-solujen Ig:n antigeeniä sitovissa kohdissa. Itsekorjautuva B-solujen toiminta voi havaita, johtavatko nämä näennäisesti satunnaiset mutaatiot affiniteetin menetykseen antigeeniä kohtaan ja käynnistävät solukuolemaohjelman. Näin ollen antigeenit, jotka aktivoivat sekä T- että B-soluja, käynnistävät T-soluvälitteisen B-solujen kypsymisen isotyypin vaihdon ja somaattisten mutaatioiden kautta, jotka molemmat liittyvät voimakkaasti B-solujen muistiin.
Muistivasteille on ominaista nopea ja laaja-alainen korkean affiniteetin Ig-tuotanto tällaisille antigeeneille. Näiden muistivasteiden kehittyminen on ratkaisevan tärkeää rokotuksen onnistumisen kannalta. Ne voivat kuitenkin myös lisätä autoimmuniteettia ja allergisia reaktioita.
Antigeenin aiheuttama T-soluista riippumaton B-solujen aktivaatio voi myös tapahtua; tämäntyyppinen aktivaatio on kuitenkin yhteydessä heikkoon immuunimuistiin. Lisäksi näiden antigeenien on oltava polymeerisiä, jotta ne voivat aktivoida B-soluja.
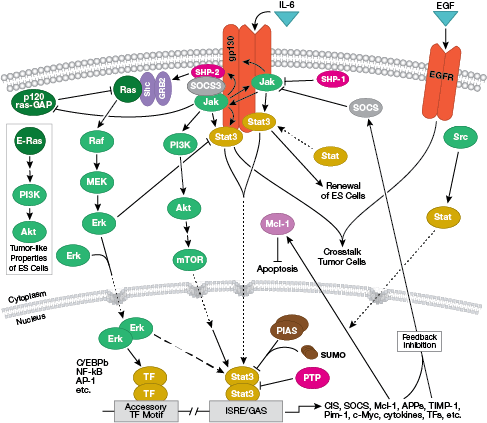
Huom: Sytokiinit eli interleukiinit (IL) ovat erittyviä molekyylejä, jotka vaikuttavat transmembraanisiin solupinnan reseptoreihin. Sitoutuessaan nämä sytokiinit aktivoivat solunsisäisiä signaalinvälitysreittejä, jotka tyypillisesti ovat riippuvaisia Jak-STAT-signaloinnista.
B-solureseptorin vuorovaikutteista signaalireittiä tarkastellaan yksityiskohtaisesti tässä.
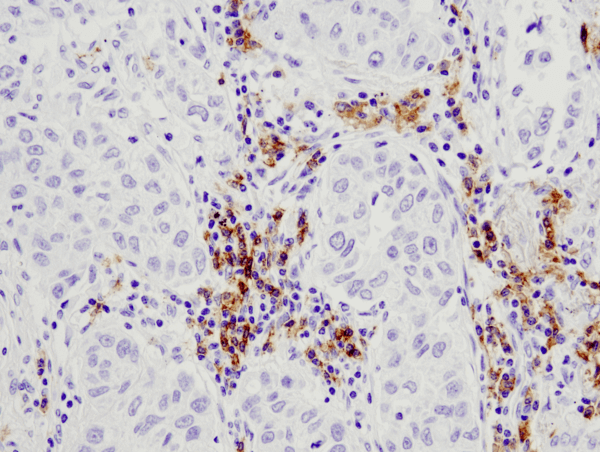
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-analyysi parafiiniin upotetusta ihmisen keuhkokarsinoomasta käyttäen #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-analyysi parafiiniin sulautetusta ihmisen keuhkokarsinoomasta käyttäen #90176.
NK-solut
Luonnolliset tappajasolut eli NK-solut ovat toinen lymfaattisesta linjasta peräisin oleva solutyyppi. B-solujen tavoin ne kehittyvät luuytimessä sytokiini- ja luuytimen stroomasoluista riippuvaisella tavalla. Ne muodostavat pienen osan perifeerisestä verestä, eikä niillä ole antigeenispesifisiä reseptoreita. Sen sijaan NK-solut tukeutuvat monimutkaiseen joukkoon transmembraanireseptoreita. Niillä on erityisesti inhiboivia solupintareseptoreita, jotka tunnistavat luokan I HLA-molekyylejä ja joita omat MHC-molekyylit siten estävät, jolloin ne tappavat vain soluja, joiden luokan I HLA:n ilmentyminen on vähentynyt. Näin ollen niillä on tärkeä tehtävä kohdistua virustartunnan saaneisiin soluihin ja kasvainsoluihin, joiden luokan I HLA:n ilmentymistä on säädelty alaspäin, jotta ne välttyisivät CD8+ luonnollisten tappaja-T-solujen (NK-T) aiheuttamalta kuolemalta. NK-solut voivat myös aktivoitua vasta-aine-, interferoni- tai sytokiiniriippuvaisesti, ja siksi niillä voi olla suuri merkitys kasvainten torjunnassa. NK-solujen toimintamekanismi perustuu siihen, että niiden sytoplasmasta vapautuu pieniä granyymejä ja perforiinia sisältäviä rakeita. Vapautuessaan nämä proteiinit voivat tehdä huokosia ja hajottaa solunsisäisiä proteiineja apoptoosin aikaansaamiseksi. Näin ollen NK-solujen sanotaan olevan sytotoksisia.
NK-T-solut ovat erityinen T-solujen alatyyppi, joka ilmentää tiettyjä NK-soluille tyypillisiä reseptoreita ja merkkiaineita yhdessä rajoitetun T-solureseptorirepertuaarin kanssa. Siksi tällä ainutlaatuisella alatyypillä on sekä T-solujen että NK-solujen ominaisuuksia. Toisin kuin NK-solut, jotka kehittyvät luuytimessä, NK-T-solut kehittyvät kateenkorvassa.
Myeloidiset solut
Yhteiset myeloidiset esisolut, jotka ovat hematopoieettisten kantasolujen jälkeläisiä, synnyttävät useita erityyppisiä myeloidisia soluja, mukaan lukien makrofagit, dendriittiset solut ja useat muut synnynnäisen immuunijärjestelmän solut ja verisolut.
Makrofagit
Makrofagit voidaan laukaista tunnistamaan antigeenejä, kuten vaurioituneita soluja tai vierasta materiaalia, ja tuhoamaan niitä tarpeen mukaan. Makrofageja on useimmissa kudoksissa, ja ne reagoivat tarvittaessa infektioihin ja kuoleviin soluihin. Tunnistettu materiaali tuhoutuu makrofagissa fagosytoosin avulla, mistä solut ovat saaneet nimensä (”iso syöjä” kreikaksi). Makrofagit saavat erilaisia muotoja, kun niitä on eri paikoissa, ja ne voivat suorittaa muitakin tehtäviä kuin fagosytoosin.
Kudosvaurion tai patogeeni-infektion yhteydessä veressä olevat monosyytit rekrytoituvat vaurioituneeseen kudokseen ja erilaistuvat makrofageiksi. Kudoksen lokalisaatiosta riippuen on olemassa erityyppisiä makrofageja, kuten Kupfferin soluja maksassa, alveolaarisia makrofageja keuhkoissa, mikroglia aivoissa jne. Nämä erityyppiset makrofagit ovat kaikki peräisin monosyyteistä, mutta ne ovat erikoistuneet toiminnassaan paikalliseen kudokseen. Suurimman osan yleisestä fagosytoositoiminnasta suorittavat paikalliset kudosmakrofagit. Sen lisäksi, että makrofagit fagosytoivat kuolleita soluja ja vierasta materiaalia, ne voivat myös viestiä muille immuunisoluille sytokiinien välityksellä. Makrofagit hoitavat jossain määrin antigeenin esittämisen kriittistä tehtävää ja toimivat näin ollen yhdessä T-solujen kanssa adaptiivisen immuniteetin tukemiseksi. Lisäksi makrofagit voivat erittää sytokiineja, kuten IL-12:ta, ja niillä on rooli paikallisissa immuunivasteissa, kun taas toiset erittävät suuria määriä IL-10:tä, joka välittää niiden roolia kudosten korjaamisessa. Näin ollen ”suursyöjillä” on useita tehtäviä immuunijärjestelmässä päätehtävänsä eli fagosytoosin lisäksi.
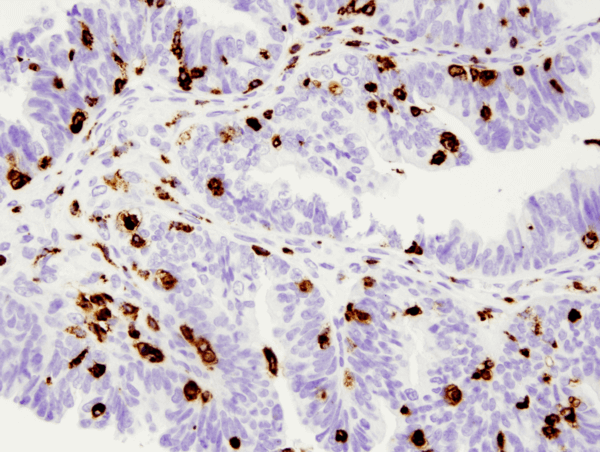
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-analyysi parafiiniin upotetusta ihmisen munasarjan seroottisesta papillaarikarsinoomasta käyttäen #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-analyysi parafiiniin sulautetusta ihmisen munasarjan seroottisesta papillaarisesta karsinoomasta käyttäen #76437.
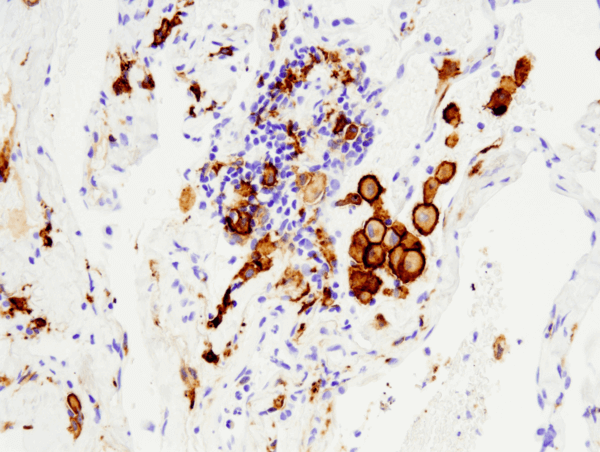
CD163 (D6U1J) Rabbit mAb #93498: IHC-analyysi parafiiniin sulautetusta ihmisen ei-pienisoluisesta keuhkokarsinoomasta käyttäen #93498:a, joka on suoritettu Leica® Bond™ Rx:llä.
CD163 (D6U1J) Rabbit mAb #93498: IHC-analyysi parafiiniin sulautetusta ihmisen ei-pienisoluisesta keuhkokarsinoomasta käyttäen #93498, joka on suoritettu Leica® Bond™ Rx:llä.
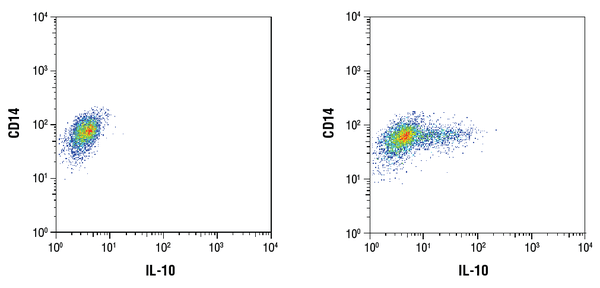
IL-10 (D13A11) XP® Rabbit mAb #12163: Virtaussytometrinen analyysi puhdistetuista CD14+ ihmisen perifeerisen veren mononukleaarisoluista, joita ei ole käsitelty (vasemmalla) tai joita on käsitelty LPS:llä (100ng/ml, 16 h; oikealla) CD14-vasta-aineella ja #12163:lla. Brefeldiini A #9972 (300ng/ml) lisättiin käsittelemättömiin ja käsiteltyihin soluihin 1 tunnin LPS-stimulaation jälkeen. Toissijaisena vasta-aineena käytettiin anti-kani IgG (H+L), F(ab’)2-fragmentti (Alexa Fluor® 647 -konjugaatti) #4414.
IL-10 (D13A11) XP® Rabbit mAb #12163: Virtaussytometrinen analyysi puhdistetuista CD14+ ihmisen perifeerisen veren mononukleaarisoluista, joita ei ole käsitelty (vasemmalla) tai joita on käsitelty LPS:llä (100ng/ml, 16 h; oikealla) käyttäen CD14-vasta-ainetta ja #12163:a. Brefeldiini A #9972 (300ng/ml) lisättiin käsittelemättömiin ja käsiteltyihin soluihin 1 tunnin LPS-stimulaation jälkeen. Toissijaisena vasta-aineena käytettiin anti-kani IgG (H+L), F(ab’)2-fragmentti (Alexa Fluor® 647 -konjugaatti) #4414.
Dendriittisolut
Makrofagien tavoin dendriittisillä soluilla on kyky nielaista solu- ja vierasperäistä materiaalia, mutta sen sijaan, että ne sulattaisivat sitä poistettavaksi, dendriittiset solut käsittelevät materiaalia ja esittelevät sen antigeeneinä T-soluille. Näin ollen dendriittisolut toimivat antigeenejä esittelevinä soluina eli apusoluina ja välittävät siten tietoa patogeeneistä synnynnäisen ja adaptiivisen immuunijärjestelmän välillä. Dendriittisolut ovat saaneet nimensä siitä, että niiden erilliset soluprojektiot ulottuvat ulos ja tarttuvat haitalliseen materiaaliin sulatettavaksi.
Hematopoieettisista luuytimen esiasteista syntyvät, aluksi epäkypsät dendriittisolut käyvät läpi ”oppimisvaiheen”, jossa ne tutkivat paikallista aluettaan vieraan materiaalin varalta ja käynnistävät tunnistusvasteen hahmontunnistusreseptoreiden välityksellä (yksi yleinen näiden reseptoreiden joukko on tollin kaltaiset reseptorit). Nämä epäkypsät dendriittisolut voivat sijaita eri paikoissa, joissa on pääsy ulkoiseen ympäristöön, kuten nenän, vatsan, keuhkojen ja jopa ihon limakalvoilla. Antigeenin tunnistamisen jälkeen dendriittisolut siirtyvät imusolmukkeeseen, jossa ne kouluttavat T-solut tunnistamaan antigeenin ja vastaamaan siihen. Dendriittisolut ovat ainoat antigeenin esittelevät solut, jotka aktivoivat sekä muisti- että naiiveja T-soluja. Tollin kaltaiset reseptorit ovat hyvin tutkittu reseptoriluokka, jota esiintyy makrofageissa ja dendriittisoluissa ja joka välittää vieraiden patogeenien tunnistamista ja niihin reagoimista. Sen lisäksi, että dendriittiset solut ovat suoraan vuorovaikutuksessa T-solujen kanssa, ne voivat antaa signaalin myös sytokiinien, kuten IL-12:n, välityksellä, joka valmistaa immuunijärjestelmää myöhempää hyökkäystä haitallista materiaalia vastaan. Toiset dendriittisolutyypit voivat erittää sytokiineja, jotka antavat signaalin rekrytoida lisää makrofageja puhdistamaan ylikuormitettua jätemateriaalia. Antigeenin esittelyn tärkeimpinä soluvälittäjinä dendriittisillä soluilla on siten välttämätön rooli synnynnäisen ja adaptiivisen immuunijärjestelmän välisessä vuorovaikutuksessa.
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-analyysi parafiiniin upotetusta ihmisen eturauhasen adenokarsinoomasta käyttäen #455812, joka on suoritettu Leica® Bond™ Rx:llä.
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-analyysi parafiiniin sulautetusta ihmisen eturauhasen adenokarsinoomasta käyttäen #455812, joka on suoritettu Leica® Bond™ Rx:llä.
Muut synnynnäisen immuunijärjestelmän solut ja signalointi
Muihin synnynnäisen immuunijärjestelmän soluihin kuuluvat syöttösolut, jotka toimivat haavojen paranemisessa ja auttavat suojautumaan patogeeneiltä. Kun patogeeni laukaisee solun, syöttösolut voivat erittää sytokiineja sekä histamiinia ja hepariinia sisältäviä rakeita, jotka välittävät muuta immuunivastetta, kuten makrofagien rekrytointia ja verisuonten laajentumista. Neutrofiilejä, eosinofiilejä ja basofiilejä kutsutaan yhdessä granulosyyteiksi niiden sytoplasmassa olevien tyypillisten rakeiden vuoksi. Neutrofiileissä granulukset vapauttavat myrkyllisiä yhdisteitä, jotka kohdistuvat patogeeneihin, kuten sieniin ja bakteereihin.
Immunology in Health and Disease
Cancer Immunology
Immuunisolujen valjastamisesta syövän torjuntaan on tullut erittäin ajankohtainen tutkimusaihe kliinisessä menestyksessä saavutetun menestyksen vuoksi. Nykyisessä immunoterapiassa on viime aikoina keskitytty kohdentamaan signaalitarkastuspisteproteiineja, kuten PD-1:tä, jotka normaalisti estävät T-solujen aktivoitumisen ja vasteen. Adoptiivinen soluhoito on toinen mielenkiintoinen lähestymistapa, jossa potilaalta kerättyjä T-soluja muokataan immunologisesti. T-solut muokataan ilmentämään tiettyä kimeeristä antigeenireseptoria, joka on spesifinen potilaan syöpäsoluille. T-solut fuusioidaan sitten uudelleen potilaaseen, ja ne on nyt ohjelmoitu etsimään syöpäsoluja ja tappamaan ne normaalin T-solutoiminnan mukaisesti. Nämä ja muut lähestymistavat, joilla immuunijärjestelmää manipuloidaan hyökkäämään potilaan haitallisten syöpäsolujen kimppuun, edustavat uraauurtavaa hoitomuotojen luokkaa syövän hoidossa.